Содержание
- 2. Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных
- 3. По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан». Так называли всех
- 4. Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый -
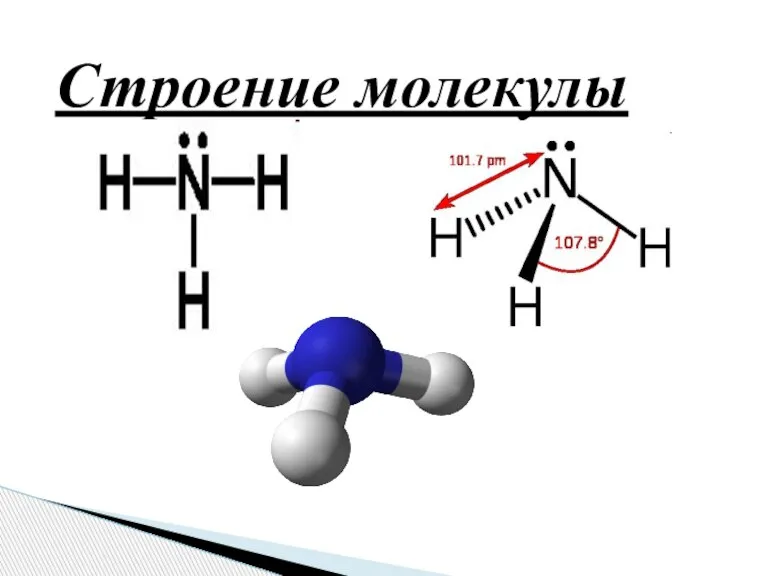
- 5. Строение молекулы
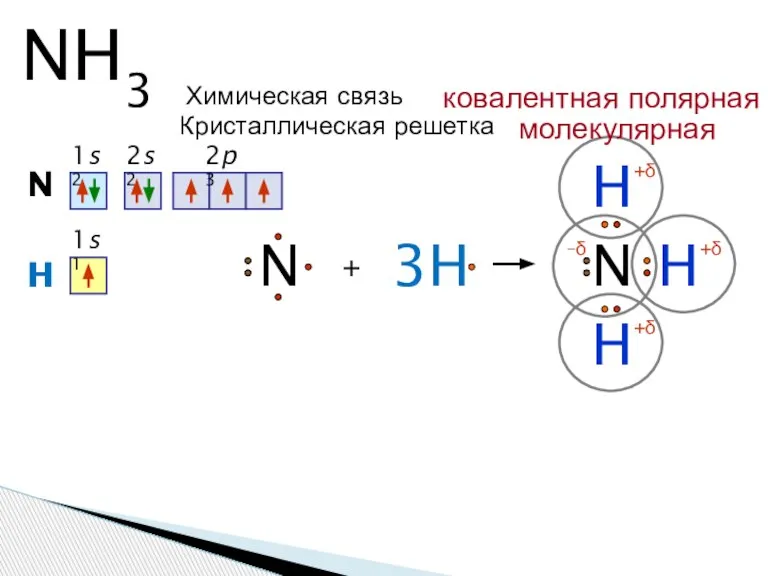
- 6. NH3 N 1s2 2s2 2p3 + H N H H 3H H N 1s1 +δ +δ
- 7. Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота
- 8. Физические свойства (при н.у. ) бесцветный газ с резким характерным запахом (запах нашатырного спирта) легче воздуха
- 9. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных вызвать токсический
- 10. Получение аммиака Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: 2NH4Cl +
- 11. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г)
- 12. Химические свойства аммиака Для аммиака характерны реакции: 1) с изменением степени окисления атома азота (реакции окисления);
- 13. Реакции с изменением степени окисления атома азота (реакции окисления) N-3 → N0→ N+2 NH3-сильный восстановитель
- 14. с кислородом Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 Каталитическое окисление амииака
- 15. с оксидами металлов 2NH3 +3CuO =3Cu + N2 +3H2O
- 16. с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- 17. Реакции без изменения степени окисления атома азота (присоединение - образование иона аммония NH4+ по донорно-акцепторному механизму
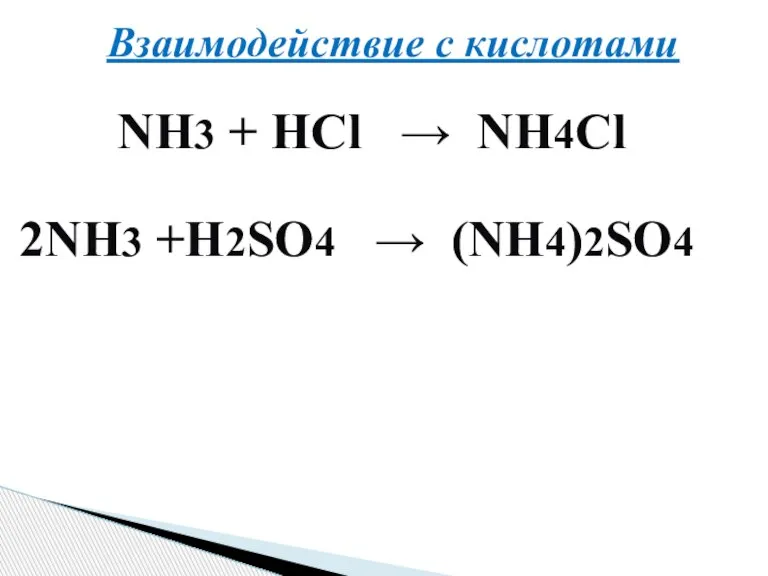
- 18. Взаимодействие с кислотами NH3 + HCl → NH4Cl 2NH3 +H2SO4 → (NH4)2SO4
- 19. Взаимодействие с водой NH3 + H2O = NH4OH При добавлении фенолфталеина‑ раствор становится малиновым, так как
- 20. Применение аммиака Производство пластмасс и волокон 2. В составе моющих средств
- 21. 3. Производство азотных удобрений 4. В сельском хозяйстве
- 22. 5. Производство азотной кислоты 6. Получение взрывчатых веществ
- 23. 7. В медицине
- 24. По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
- 26. Скачать презентацию




















 Презентация на тему Екатерина Великая
Презентация на тему Екатерина Великая  «Стимулирование экономической активности на 2012-2016 гг.»
«Стимулирование экономической активности на 2012-2016 гг.» Учет возрастных психологических особенностей детей и подростков
Учет возрастных психологических особенностей детей и подростков Презентация на тему Перевод чисел в десятичную систему счисления 11 класс
Презентация на тему Перевод чисел в десятичную систему счисления 11 класс  Требования к оформлению презентации
Требования к оформлению презентации Презентация на тему Лес - природное сообщество 3 класс
Презентация на тему Лес - природное сообщество 3 класс Биомедикал системс
Биомедикал системс Презентация на тему Блокада Ленинграда. Дети, война
Презентация на тему Блокада Ленинграда. Дети, война Кафедра лучевой диагностики и лучевой терапии
Кафедра лучевой диагностики и лучевой терапии Эксплуатация МТ. Основные задачи. Приемка в эксплуатацию
Эксплуатация МТ. Основные задачи. Приемка в эксплуатацию ООО ИнтерТех, Новосибирск. Проектирование, монтаж и комплексное обслуживание инженерных сетей
ООО ИнтерТех, Новосибирск. Проектирование, монтаж и комплексное обслуживание инженерных сетей Предоставление платных образовательных услуг
Предоставление платных образовательных услуг Профессия столяра
Профессия столяра Крылатые выражения
Крылатые выражения Мифологема Мировое Древо
Мифологема Мировое Древо Лизинговые продукты
Лизинговые продукты Справится ли местоимение с ролью обращения?
Справится ли местоимение с ролью обращения? Законы термодинамики
Законы термодинамики Ровеньковский горный колледж
Ровеньковский горный колледж 2ca34114d08bf472 (1)
2ca34114d08bf472 (1) Франція: пам’ятки архітектури
Франція: пам’ятки архітектури Метод проекций. Проекции точки. Лекция 1
Метод проекций. Проекции точки. Лекция 1 Удмуртское национальное блюдо шаньги
Удмуртское национальное блюдо шаньги Что такое бёрдинг?
Что такое бёрдинг? Гибриды больших кошек
Гибриды больших кошек Какой бывает транспорт? 2 класс
Какой бывает транспорт? 2 класс «Масленица…»
«Масленица…» Модулі нагріву МН-500 Укрінтерм на базі конденсаційного теплообмінника
Модулі нагріву МН-500 Укрінтерм на базі конденсаційного теплообмінника