Содержание
- 2. ядро електрони “+” “-” Атом - найдрібніша складова речовини Атом (з грецької “неподільний”) – найдрібніша, хімічно
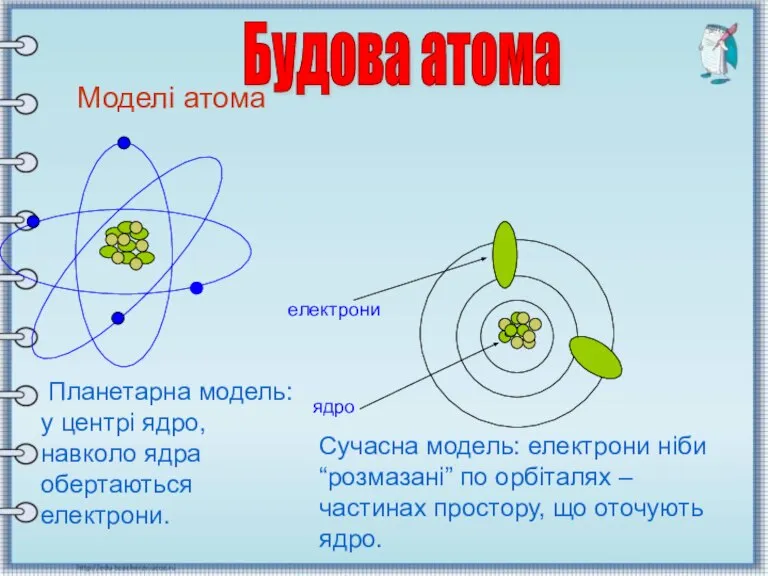
- 3. Моделі атома Моделі атома Планетарна модель: у центрі ядро, навколо ядра обертаються електрони. електрони ядро Сучасна
- 4. Будова атома Атоми надзвичайно малі, а їх ядро ще у 10-100 разів менші за сам атом.
- 5. Ім’я: Атом – найдрібніша частинка речовини. Батьки: Демокріт, Левкіпп – 2500р. тому, давньогрецькі вчені (гіпотеза про
- 6. Розміри атомів приблизно дорівнюють 0,0000000001м. Розміри атомів приблизно дорівнюють 0,0000000001м. Якби всі люди нашої планети проводили
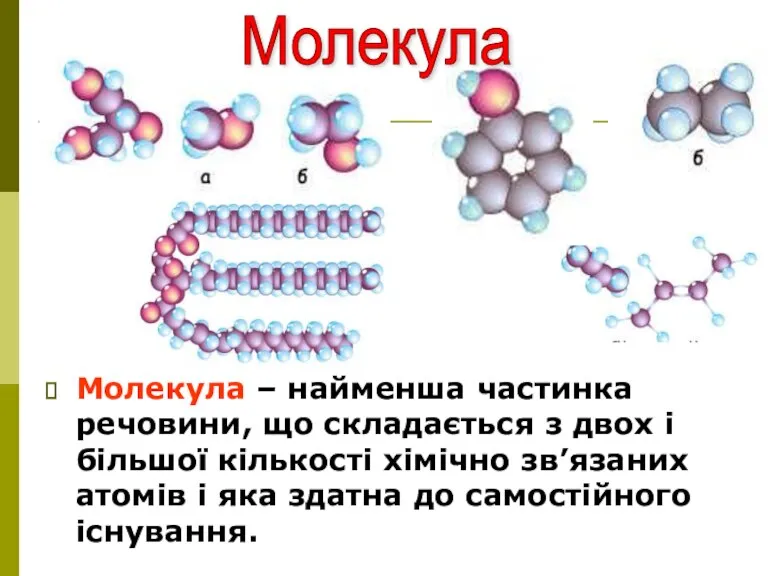
- 7. Молекула – найменша частинка речовини, що складається з двох і більшої кількості хімічно зв’язаних атомів і
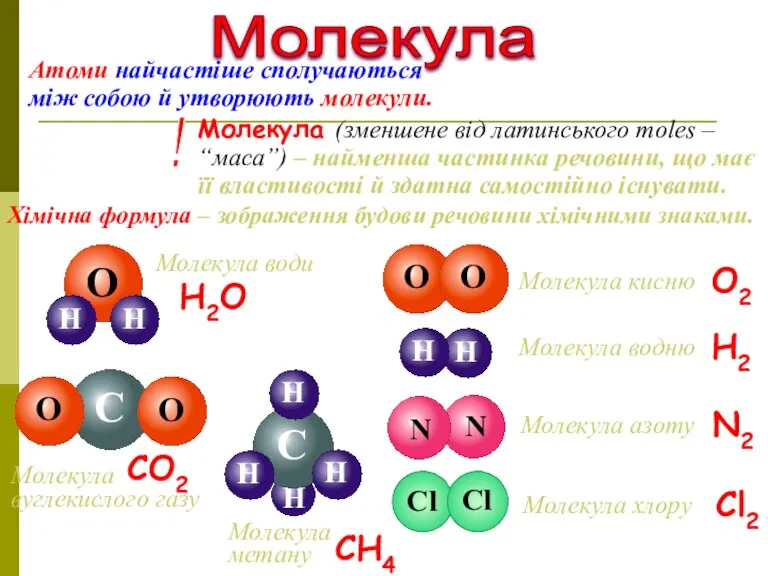
- 8. Молекула Молекула (зменшене від латинського moles – “маса”) – найменша частинка речовини, що має її властивості
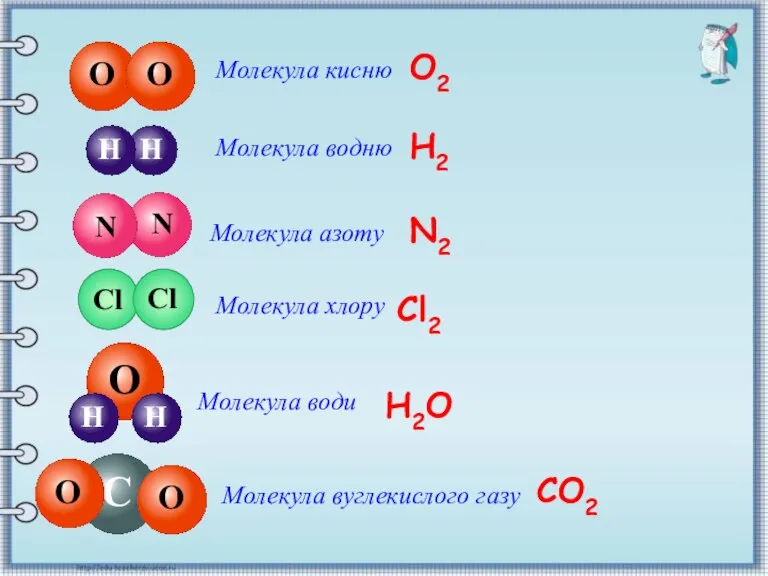
- 9. О Молекула кисню Молекула водню Молекула азоту Молекула хлору О2 Н2 N2 Cl2 Молекула води Н2O
- 10. 1. Всі тіла складаються з частинок. 2. Ці частинки перебувають у безперервному хаотичному русі. 3. Частинки
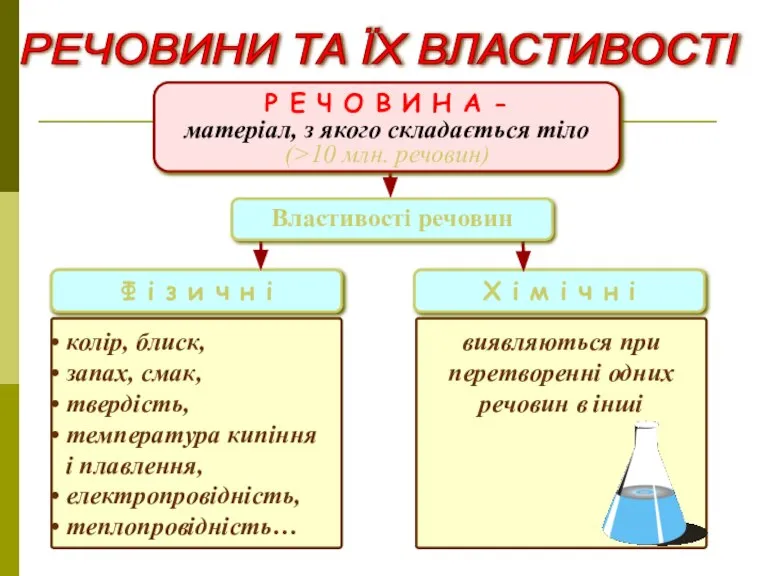
- 11. РЕЧОВИНИ ТА ЇХ ВЛАСТИВОСТІ Р Е Ч О В И Н А - матеріал, з якого
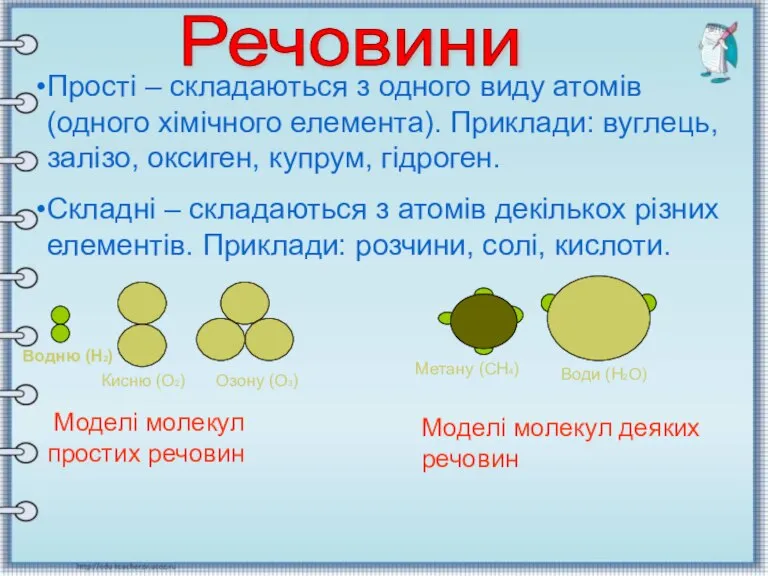
- 12. Прості – складаються з одного виду атомів (одного хімічного елемента). Приклади: вуглець, залізо, оксиген, купрум, гідроген.
- 13. Хімічні елементи Хімічний елемент (з латинської “стихія”, “первинна речовина”) – певний за будовою тип атома. Йєнс
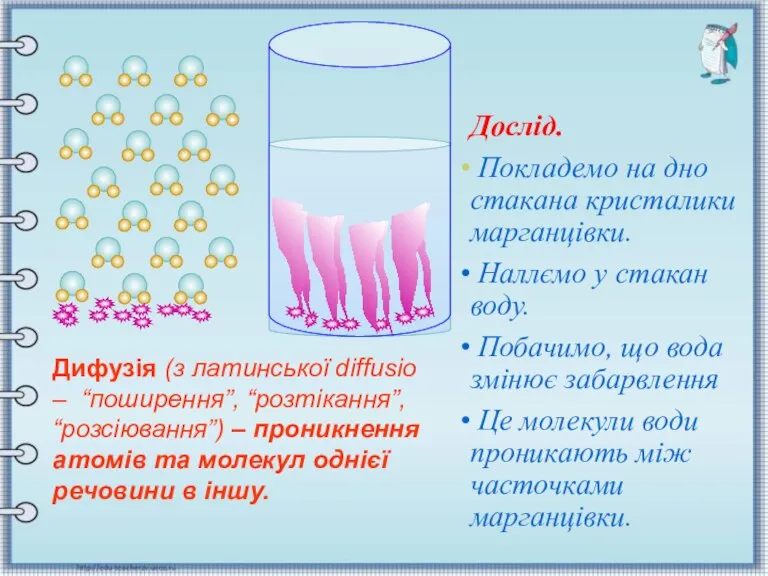
- 14. Англійський ботанік Броун (ХІХст.) Англійський ботанік Броун (ХІХст.) Дифузією називають взаємне проникнення дотичних речовин одна в
- 15. Дослід. Покладемо на дно стакана кристалики марганцівки. Наллємо у стакан воду. Побачимо, що вода змінює забарвлення
- 16. Між молекулами є проміжки. Молекули рухаються хаотично. Зі збільшенням температури збільшується швидкість молекул. Явище дифузії існує
- 17. * Усі речовини складаються з: води; повітря; з молекул і атомів. Речовина – це: те, з
- 19. Скачать презентацию









 Военно-поисковое движение
Военно-поисковое движение Опасности радиационных аварий
Опасности радиационных аварий  Ландшафтный проект
Ландшафтный проект  Презентация на тему Рост и развитие животных
Презентация на тему Рост и развитие животных Изобразительное искусство « Наши любимые узоры. В гостях у народных мастеров»
Изобразительное искусство « Наши любимые узоры. В гостях у народных мастеров» Интеллектуальная собственность и софтверный бизнес: Как защитить и избежать рисков? Игорь Моцный, Руководитель группы/ Интеллекту
Интеллектуальная собственность и софтверный бизнес: Как защитить и избежать рисков? Игорь Моцный, Руководитель группы/ Интеллекту Комплекс управления уличным освещением "Луч"
Комплекс управления уличным освещением "Луч" Подключение к АК 20.10.21(1)
Подключение к АК 20.10.21(1) О состоянии и перспективах развития рынка систем диспетчеризации и автоматизации на Юге РоссииПрезентация специального выпуска
О состоянии и перспективах развития рынка систем диспетчеризации и автоматизации на Юге РоссииПрезентация специального выпуска ТИПЫ АЛГОРИТМОВ
ТИПЫ АЛГОРИТМОВ Passive voice
Passive voice  Газ и газобаллонное оборудование для авто
Газ и газобаллонное оборудование для авто №33
№33 Украина
Украина  Схема и описание (план действий)
Схема и описание (план действий) Rough sketch. Javá tea
Rough sketch. Javá tea Русская культурав ХIV – XVI вв.
Русская культурав ХIV – XVI вв. Физическая активность для сохранения женского здоровья (13)
Физическая активность для сохранения женского здоровья (13) УСКОРИТЕЛЬ ПРОТОНОВBWLAP/ABC3(2)D для ЯРТ энергетики
УСКОРИТЕЛЬ ПРОТОНОВBWLAP/ABC3(2)D для ЯРТ энергетики С ю р р е а л и з м
С ю р р е а л и з м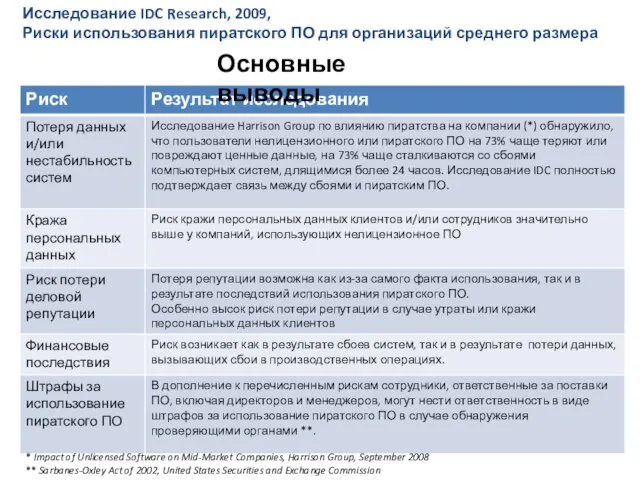 Основные выводы
Основные выводы Впровадження ґендерної рівності в країнах ЄС на прикладі Іспанії Гаврилець Ольга Павлівна Завідувач Сектору взаємодії з Верховно
Впровадження ґендерної рівності в країнах ЄС на прикладі Іспанії Гаврилець Ольга Павлівна Завідувач Сектору взаємодії з Верховно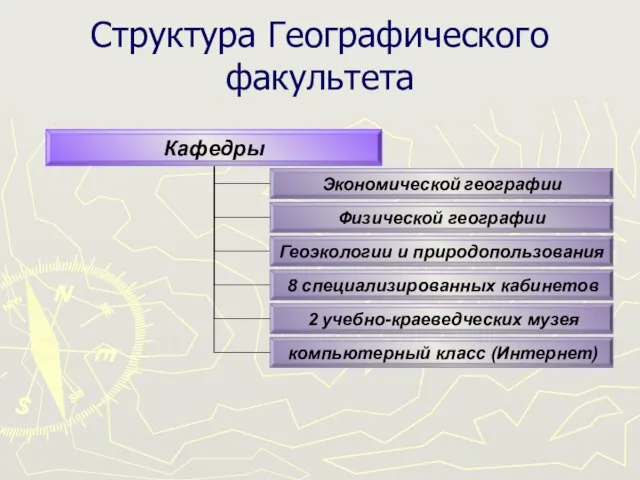 Структура Географического факультета
Структура Географического факультета Народные игрушки
Народные игрушки Николай Николаевич Ге. 1831 —1894
Николай Николаевич Ге. 1831 —1894 Скриптовые языки на примере Perl
Скриптовые языки на примере Perl Живопись и ее выразительные средства
Живопись и ее выразительные средства Славяне. Мифы славян
Славяне. Мифы славян