Слайд 2Основные вопросы
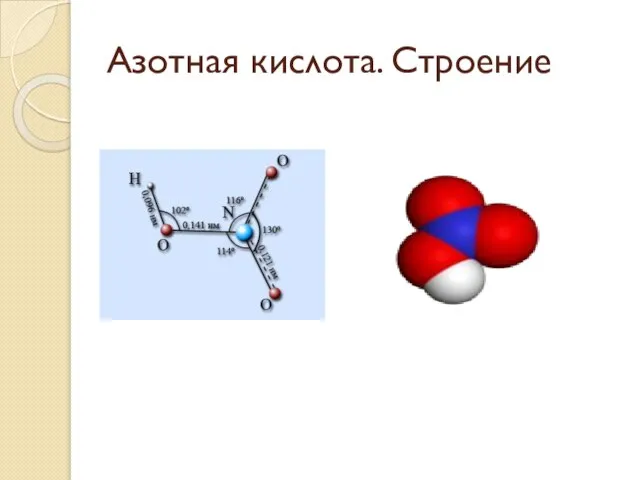
Строение молекулы азотной кислоты.
Физические свойства.
Получение азотной кислоты.
Химические свойства.
Свойства нитратов.
Применение азотной кислоты

и нитратов.
Слайд 4Физические свойства
Дымящаяся жидкость, ρ=1,52 г/мл, безцветная, едкий запах, Ткип=82,6ºС Т=-42ºС - прозрачные

кристаллы, очень гигроскопична
Сильный окислитель. Разрушает животные и растительные ткани
Слайд 5Получение HNO3
В лаборатории NaNO3(ТВ.)+H2SO4(КОНЦ)=NaHSO4 + HNO3↑
В промышлености 4NH3 + 5O2 =
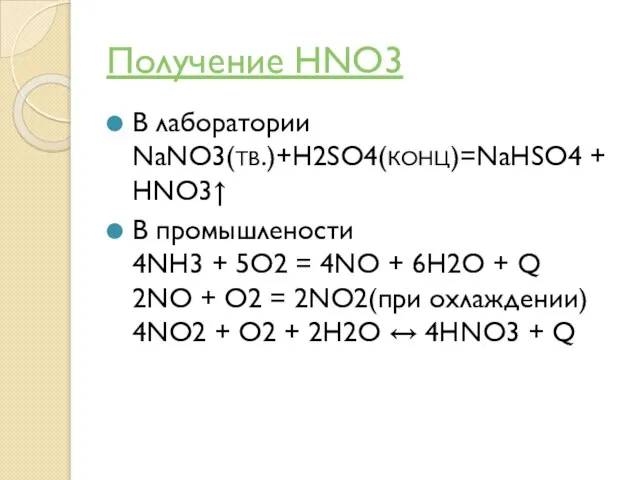
4NO + 6H2O + Q 2NO + O2 = 2NO2(при охлаждении) 4NO2 + O2 + 2H2O ↔ 4HNO3 + Q
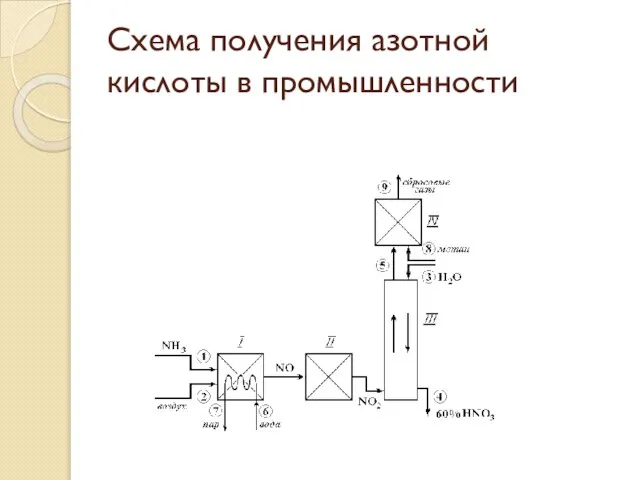
Слайд 6Схема получения азотной кислоты в промышленности
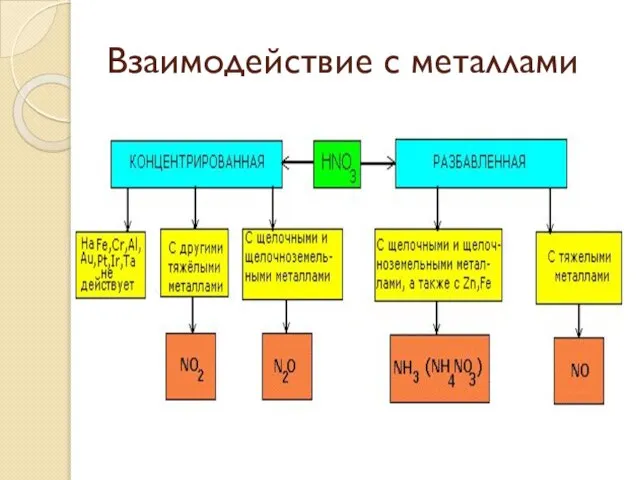
Слайд 7Химические свойства
Азотная кислота является сильным окислителем, концентрированная азотная кислота окисляет серу до

серной, а фосфор - до фосфорной кислот, некоторые органические соединения (например амины и гидразины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Слайд 8Свойства общие с другими кислотами
Составьте уравнения реакций
HNO3 + Mg(OH)2 =
HNO3 +

Al2O3 =
HNO3 + (NH4)2CO3 =
Слайд 9Проверьте уравнения
2HNO3 + Mg(OH)2 = Mg(NO3)2 + 2H2O (реакция нейтрализации)
6HNO3 + Al2O3

= 2Al(NO3)3 + 3H2O (реакция обмена)
2HNO3 + (NH4)2CO3 = 2NH4NO3 + CO2î + H2O (реакция обмена)
Слайд 11Лабораторный эксперимент № 1
В пробирку с концентрированной азотной кислотой осторожно добавляйте

несколько тонких кусочков медной проволоки. Реакция идёт без нагревания, учащиеся наблюдают изменение цвета раствора и выделение красно-бурого газа NO2
Составьте уравнение происходящей реакции
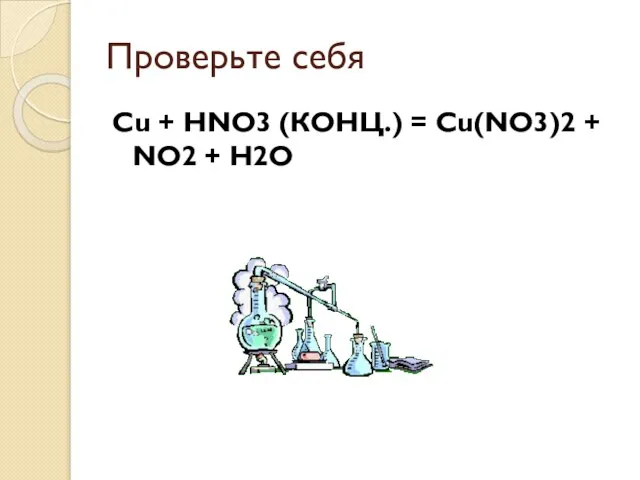
Слайд 12Проверьте себя
Cu + HNO3 (КОНЦ.) = Сu(NO3)2 + NO2 + H2O
Слайд 13Лабораторный эксперимент № 2
В пробирку с разбавленной азотной кислотой осторожно добавляйте

несколько тонких кусочков медной проволоки. Реакция идёт при нагревании. Наблюдайте изменение цвета раствора и выделение бесцветного газа NO
Составьте уравнение происходящей реакции
Слайд 14Проверьте себя
Cu + HNO3(разб.) = Cu(NO3)2 + NO + H2O
0 +1

Cu – 2e = Cu 3 восстановитель окисляется
+5 +2
N + 3e = N 2окислитель восстанавливается 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Слайд 15Подведение итогов
Каковы физические свойства азотной кислоты?
Почему азотную кислоту хранят в склянках из

тёмного стекла?
Почему азотную кислоту используют для получения взрывчатых веществ?
Перечислите особенности взаимодействия азотной кислоты с металлами.
С какими металлами не реагирует азотная кислота?












 Личность как предмет изучения
Личность как предмет изучения «1С-Рейтинг:Микрокредитная организация»
«1С-Рейтинг:Микрокредитная организация» Создание сводного электронного каталога "Книжные памятники Архангельской области": итоги и перспективы
Создание сводного электронного каталога "Книжные памятники Архангельской области": итоги и перспективы Линейная функция
Линейная функция Финансирование инновационной деятельности. Финансовые инновации в современной России
Финансирование инновационной деятельности. Финансовые инновации в современной России Анализируем художественный текст
Анализируем художественный текст Правоохранительные органы РФ
Правоохранительные органы РФ Желтый блокнот. Что такое проект? Пять П проекта
Желтый блокнот. Что такое проект? Пять П проекта Одежда и украшения. Вторая половина XIX века
Одежда и украшения. Вторая половина XIX века Организаторское поведение
Организаторское поведение Боеприпасы. Взрыватели и трубки
Боеприпасы. Взрыватели и трубки Математика для малышей
Математика для малышей Условия жизни разных народов
Условия жизни разных народов КИСЕЛЕ КИШЕ
КИСЕЛЕ КИШЕ Calculate your visit
Calculate your visit Анатомия класса. Схожесть с др. языками
Анатомия класса. Схожесть с др. языками Электронное телевидение
Электронное телевидение Круговорот воды в природе
Круговорот воды в природе Страхи в младшем школьном возрасте
Страхи в младшем школьном возрасте Русская армия в 18 веке и её знаменитые полководцы
Русская армия в 18 веке и её знаменитые полководцы Управление информационными ресурсами
Управление информационными ресурсами Свойства площадей. Площадь прямоугольника. Площадь параллелограмма
Свойства площадей. Площадь прямоугольника. Площадь параллелограмма Контрперенос и принципы работы бессознательного
Контрперенос и принципы работы бессознательного Упрощенный рассказ о моде. Часть 1. Платья и под ними. Ампир
Упрощенный рассказ о моде. Часть 1. Платья и под ними. Ампир Пищеварительная система у позвоночных животных
Пищеварительная система у позвоночных животных Что такое космогрядка
Что такое космогрядка Символика калужской области
Символика калужской области Презентация на тему Строение и функции пищеварительной системы
Презентация на тему Строение и функции пищеварительной системы