Содержание
- 2. «Что мы должны знать о лекарствах-генериках» Информационная листовка ВОЗ для стран СНГ «…фирменный и генерический препараты
- 3. С Т А Т И С Т И К А Производители : Generic ~ десятки тысяч
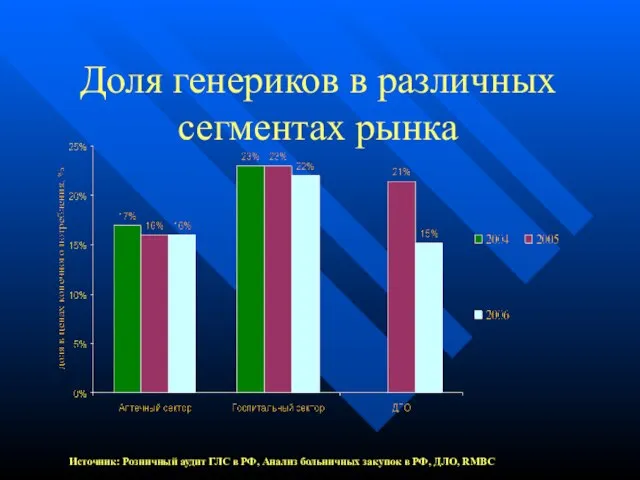
- 4. Доля генериков в различных сегментах рынка Источник: Розничный аудит ГЛС в РФ, Анализ больничных закупок в
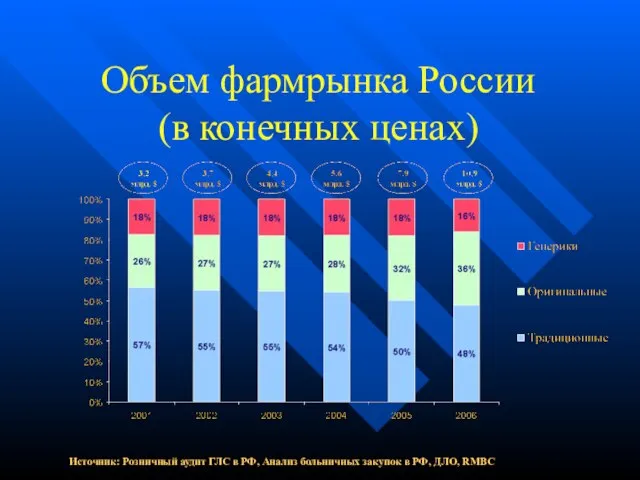
- 5. Объем фармрынка России (в конечных ценах) Источник: Розничный аудит ГЛС в РФ, Анализ больничных закупок в
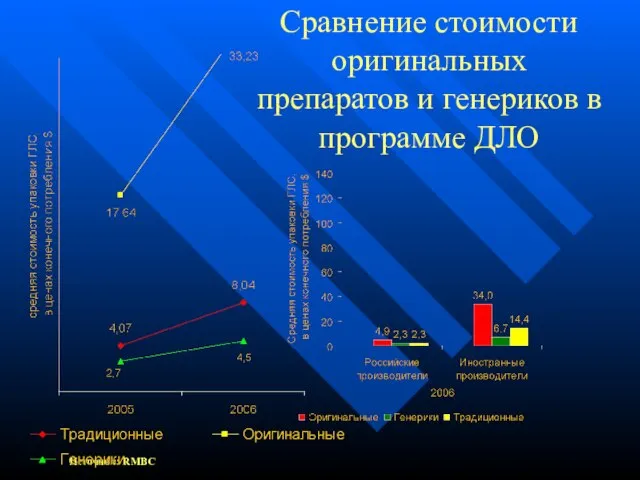
- 6. Сравнение стоимости оригинальных препаратов и генериков в программе ДЛО Источник: RMBC
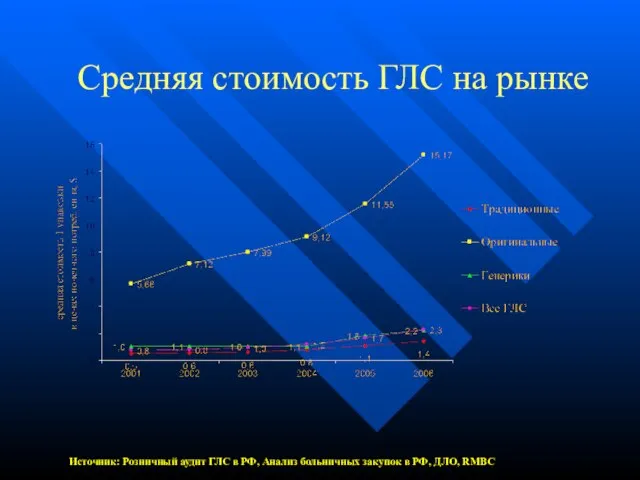
- 7. Средняя стоимость ГЛС на рынке Источник: Розничный аудит ГЛС в РФ, Анализ больничных закупок в РФ,
- 8. G E N E R I C – ХАРАКТЕРНЫЙ ДЛЯ ОПРЕДЕЛЕННОГО КЛАССА ВОЗ – «многоисточниковый продукт»
- 9. Г Е Н Е Р И К Несмотря на дешевизну, остаются лишь копиями, с более низким
- 10. Gen- eric РАЗРАБОТКА (GLP) ИССЛЕДОВАНИЯ (GCP) ТРАНСПОРТИРОВКА-ХРАНЕНИЕ GDP ПРОИЗВОДСТВО GMP
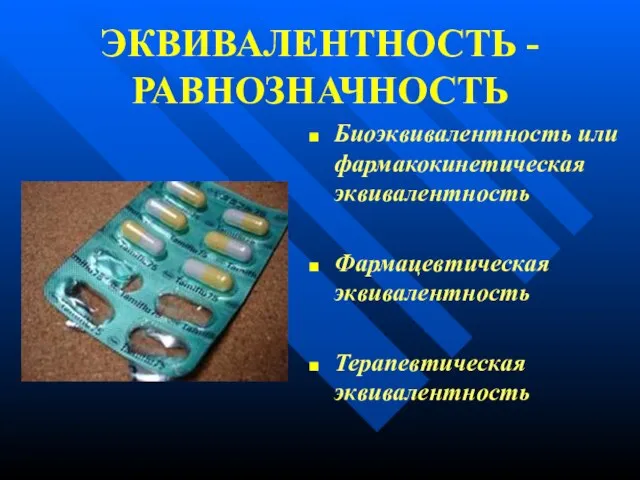
- 11. ЭКВИВАЛЕНТНОСТЬ - РАВНОЗНАЧНОСТЬ Биоэквивалентность или фармакокинетическая эквивалентность Фармацевтическая эквивалентность Терапевтическая эквивалентность
- 12. Б И О Э К В И В А Л Е Н Т Н О С
- 13. Electronic Orange Book Approved Drug Products with Therapeutic Equivalence Evaluations Current through February 2007** ** In
- 14. Может ли генерический препарат быть эффективнее оригинала? DICLOFENAC ДИКЛО-Ф ДИКЛОБЕНЕ ДИКЛОБЕРЛ ДИКЛОВИТ ДИКЛОГЕН ДИКЛОМАКС ДИКЛОНАТ П
- 15. ТЕРАПЕВТИЧЕСКАЯ ЭКВИВАЛЕНТНОСТЬ Клиническая эквивалентность ЛС по эффективности, изученная на больных Клиническая эквивалентность по переносимости и безопасности
- 16. Исследование клинической эффективности по достижению целевого уровня АД у больных артериальной гипертонией 5 препаратов эналаприла (ВМА
- 17. Гомеопатические генерики
- 19. Скачать презентацию











 Характеристика стран восточной Европы
Характеристика стран восточной Европы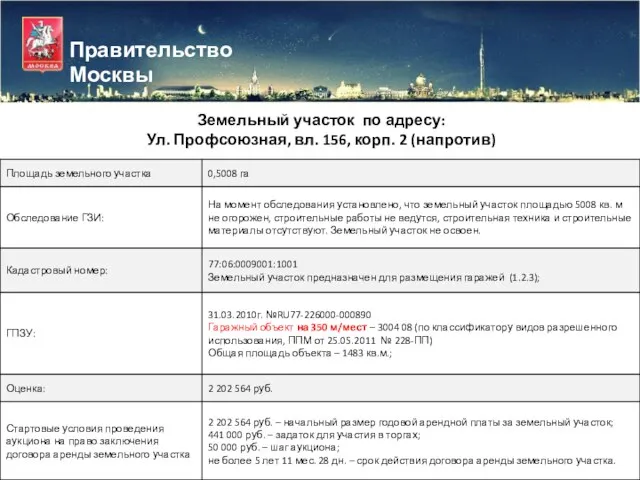 Правительство Москвы
Правительство Москвы Психолого – педагогическая служба в образовательном процессе
Психолого – педагогическая служба в образовательном процессе Стандарты кредитной надежности
Стандарты кредитной надежности Методика оценки командной эффективности. Социальные драйверы командной эффективности
Методика оценки командной эффективности. Социальные драйверы командной эффективности T-fest
T-fest Студенты-гуманитарии и вытеснение “систематического” мышления “поисковым”:к постановке проблемы
Студенты-гуманитарии и вытеснение “систематического” мышления “поисковым”:к постановке проблемы Презентация на тему Страны Африки. Ливия
Презентация на тему Страны Африки. Ливия  Проведение недель профессионального мастерства как форма коллективной методической работы
Проведение недель профессионального мастерства как форма коллективной методической работы  OpenOffice.org Writer
OpenOffice.org Writer GK120产品保养调整介绍
GK120产品保养调整介绍 Таргетированная реклама
Таргетированная реклама Musical Crossword
Musical Crossword Работа с контурной картой возраст гор
Работа с контурной картой возраст гор Учимся рисовать гуашью букет подсолнухов
Учимся рисовать гуашью букет подсолнухов ВИДЫ ТЕПЛОПЕРЕДАЧИ
ВИДЫ ТЕПЛОПЕРЕДАЧИ 23 февраля День защитника Отечества
23 февраля День защитника Отечества Растения Красной книги
Растения Красной книги Интегрированный урок в начальной школе
Интегрированный урок в начальной школе Курск Малая родина моя
Курск Малая родина моя Organic therapy
Organic therapy Приходи в Диснейленд
Приходи в Диснейленд אנחנו רוצים מחברות חדשות
אנחנו רוצים מחברות חדשות Христианская семья
Христианская семья Изготовление ящика для инструментов
Изготовление ящика для инструментов Воспитательный потенциал семьи
Воспитательный потенциал семьи Приходи на ФПММ — у нас интересно!
Приходи на ФПММ — у нас интересно! Биография Ф. И. Тютчева
Биография Ф. И. Тютчева