Содержание
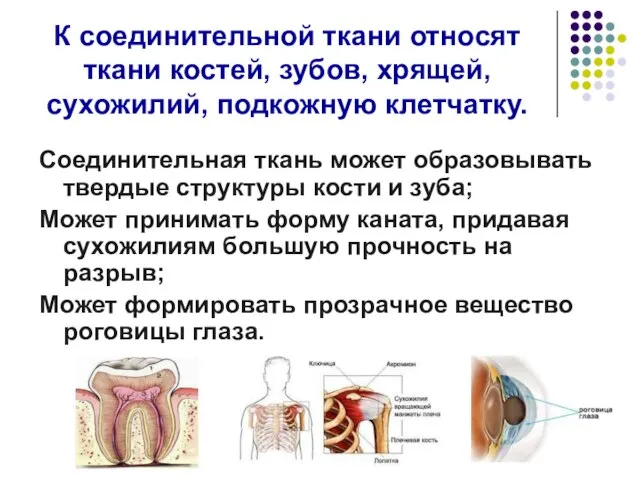
- 2. К соединительной ткани относят ткани костей, зубов, хрящей, сухожилий, подкожную клетчатку. Соединительная ткань может образовывать твердые
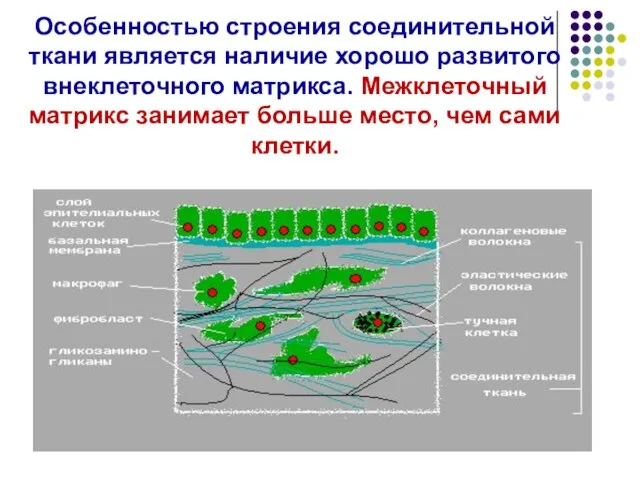
- 3. Особенностью строения соединительной ткани является наличие хорошо развитого внеклеточного матрикса. Межклеточный матрикс занимает больше место, чем
- 4. Внеклеточный матрикс (ВКМ) соединительной ткани: 1. Имеет сложный химический состав, содержит разнообразные белки и полисахариды, в
- 5. Белки внеклеточного матрикса Среди белков внеклеточного матрикса выделяют белки двух функциональных типов - фибриллярные и адгезивные.
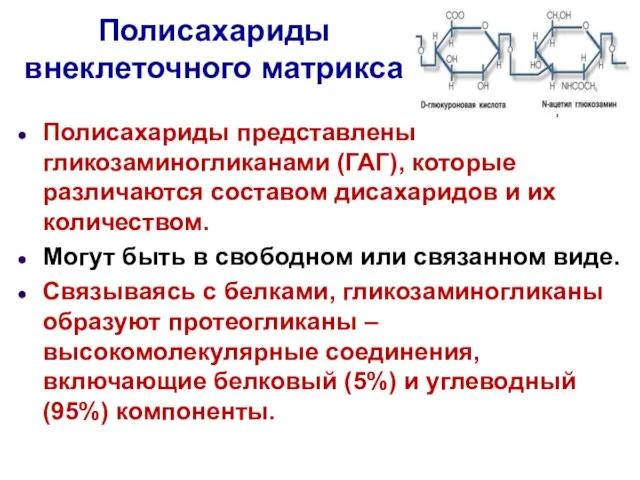
- 6. Полисахариды внеклеточного матрикса Полисахариды представлены гликозаминогликанами (ГАГ), которые различаются составом дисахаридов и их количеством. Могут быть
- 7. Полисахариды – гликозамингликаны и протеогликаны, а также и адгезивные белки составляют группу неколлагеновых белков межклеточного матрикса.
- 8. Коллаген – основной структурный белок соединительной ткани Коллагены составляют приблизительно 30 % общего количества белка в
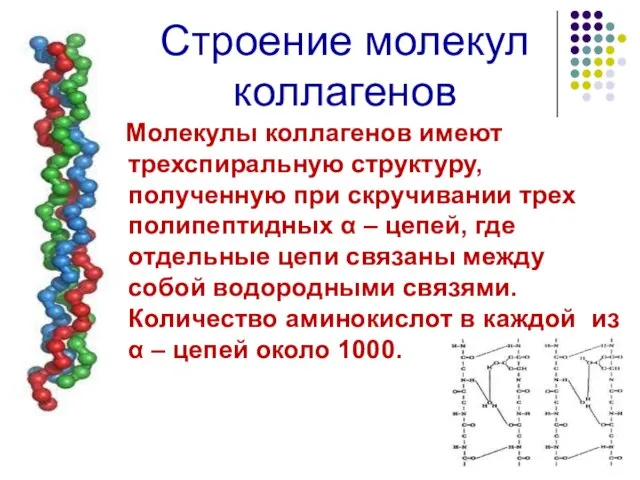
- 9. Строение молекул коллагенов Молекулы коллагенов имеют трехспиральную структуру, полученную при скручивании трех полипептидных α – цепей,
- 10. Особенности аминокислотного состава коллагена Полипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], где Гли – глицин,
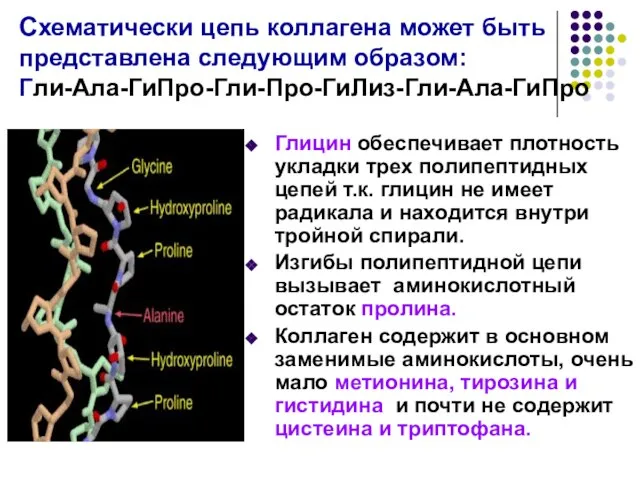
- 11. Схематически цепь коллагена может быть представлена следующим образом: Гли-Ала-ГиПро-Гли-Про-ГиЛиз-Гли-Ала-ГиПро Глицин обеспечивает плотность укладки трех полипептидных цепей
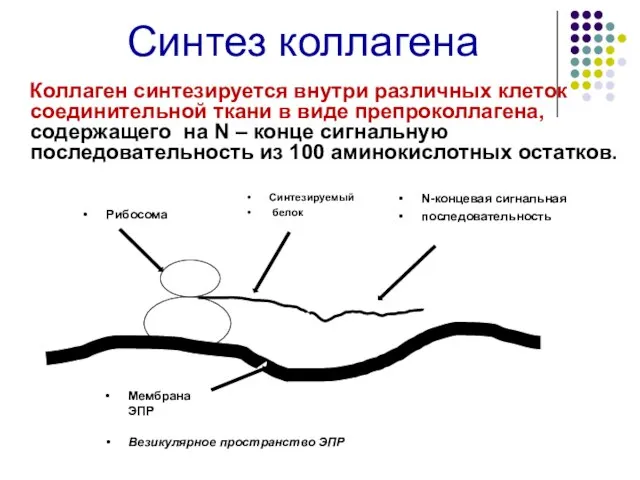
- 12. Синтез коллагена Коллаген синтезируется внутри различных клеток соединительной ткани в виде препроколлагена, содержащего на N –
- 13. Созревание коллагена (процессинг) После синтеза цепи коллагена следует сложный многоступенчатый процесс - созревания коллагена. Включает 2
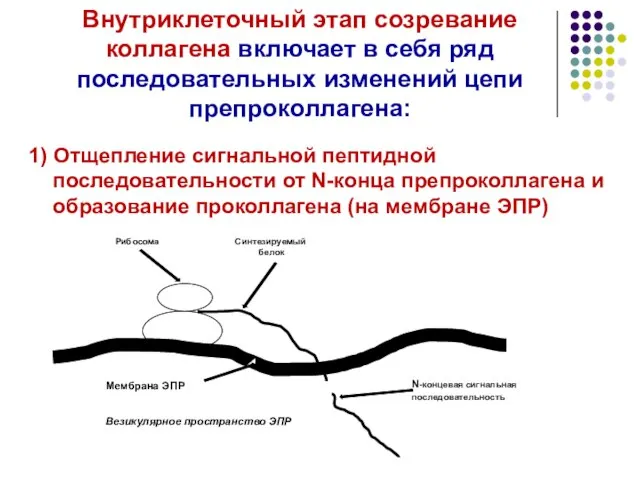
- 14. Внутриклеточный этап созревание коллагена включает в себя ряд последовательных изменений цепи препроколлагена: 1) Отщепление сигнальной пептидной
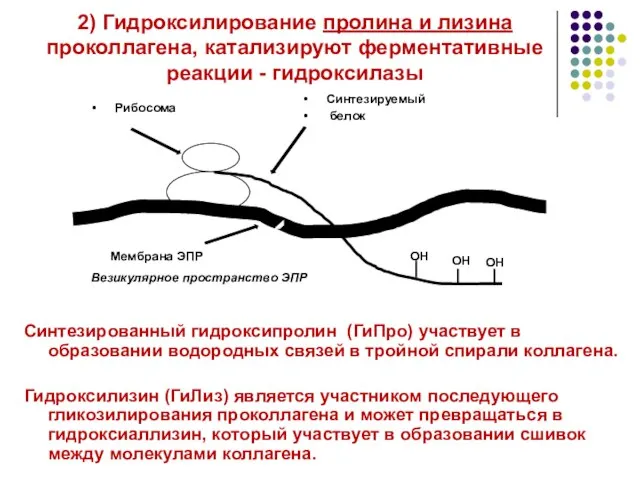
- 15. 2) Гидроксилирование пролина и лизина проколлагена, катализируют ферментативные реакции - гидроксилазы Синтезированный гидроксипролин (ГиПро) участвует в
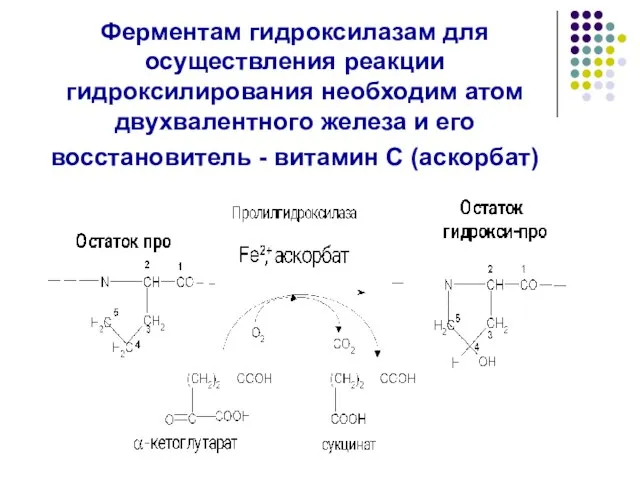
- 16. Ферментам гидроксилазам для осуществления реакции гидроксилирования необходим атом двухвалентного железа и его восстановитель - витамин С
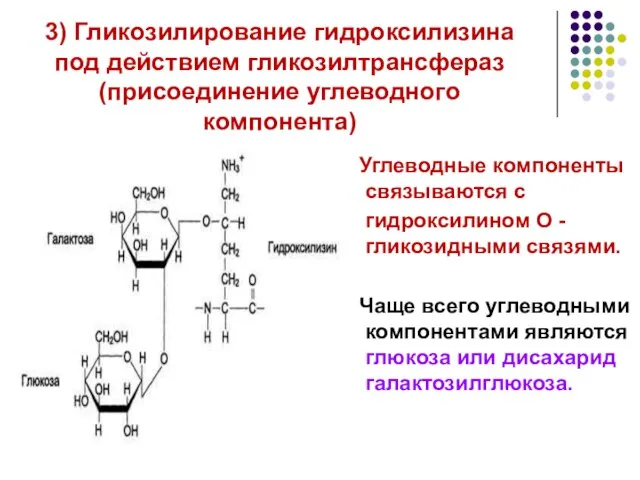
- 17. 3) Гликозилирование гидроксилизина под действием гликозилтрансфераз (присоединение углеводного компонента) Углеводные компоненты связываются с гидроксилином О -
- 18. 4) Формирование тройной спирали проколлагена Каждая α – цепь проколлагена соединяется водородными связями с двумя другими
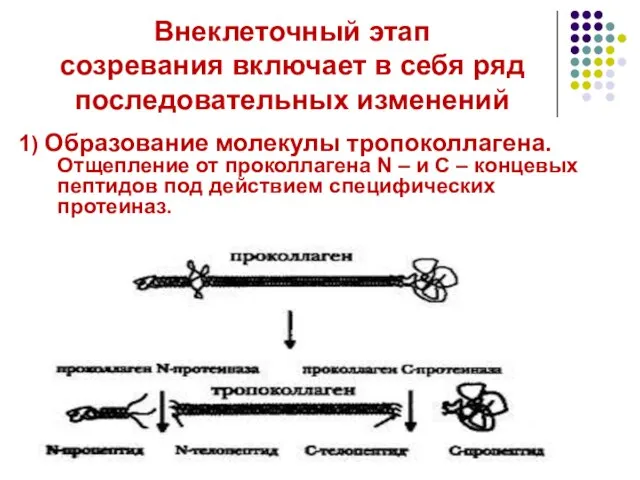
- 19. Внеклеточный этап созревания включает в себя ряд последовательных изменений 1) Образование молекулы тропоколлагена. Отщепление от проколлагена
- 20. 2) Формирование фибрилл коллагена Из сформировавшихся молекул тропоколлагена происходит сборка коллагеновых фибрилл, в которых одна нить
- 21. 3) Стабилизация и укрепление фибрилл коллагена Модифицированные аминокислоты - гидроксипролин и гидроксилизин играют важную роль в
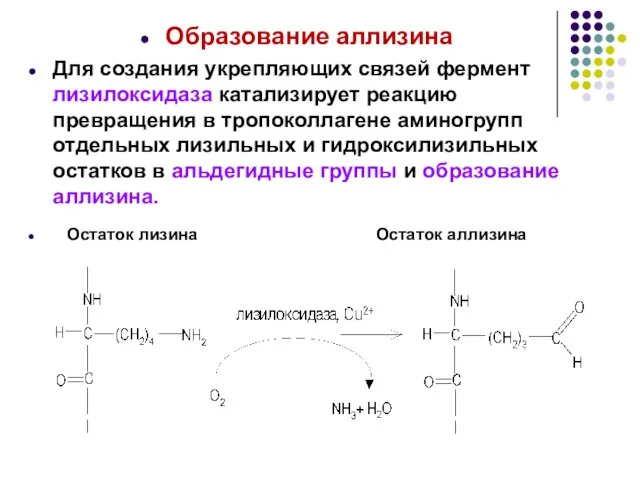
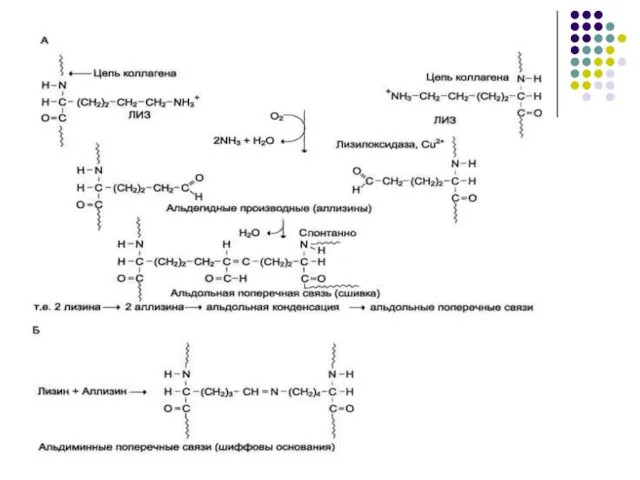
- 22. Образование аллизина Для создания укрепляющих связей фермент лизилоксидаза катализирует реакцию превращения в тропоколлагене аминогрупп отдельных лизильных
- 23. Возникшие альдегидные группы участвуют в образовании ковалентных связей, которые стабилизируют фибриллы коллагена. Альдольная сшивка – аллизин
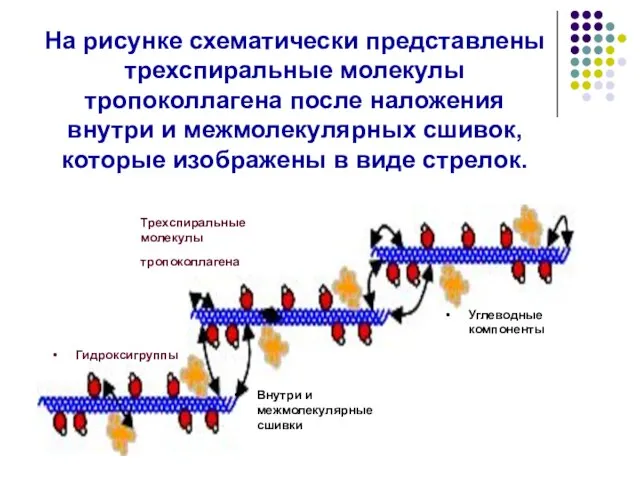
- 25. На рисунке схематически представлены трехспиральные молекулы тропоколлагена после наложения внутри и межмолекулярных сшивок, которые изображены в
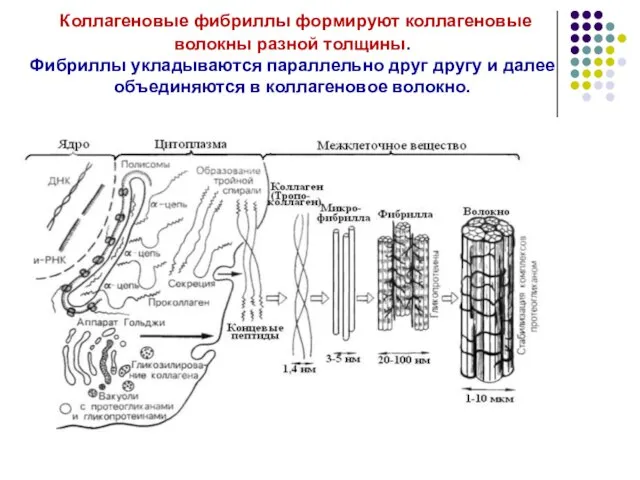
- 27. Коллагеновые фибриллы формируют коллагеновые волокны разной толщины. Фибриллы укладываются параллельно друг другу и далее объединяются в
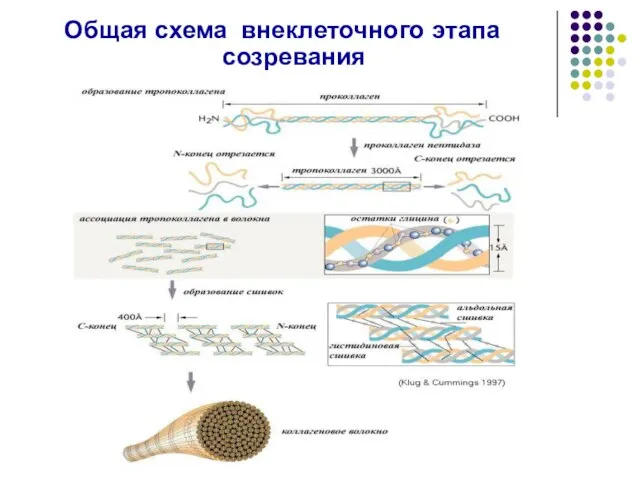
- 28. Общая схема внеклеточного этапа созревания
- 29. Уникальные свойства коллагенов Коллагеновые волокна обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку, в
- 30. Катаболизм коллагена Распад коллагена происходит медленно под действием коллагеназ. Основной фермент - Са 2+, Zn 2+
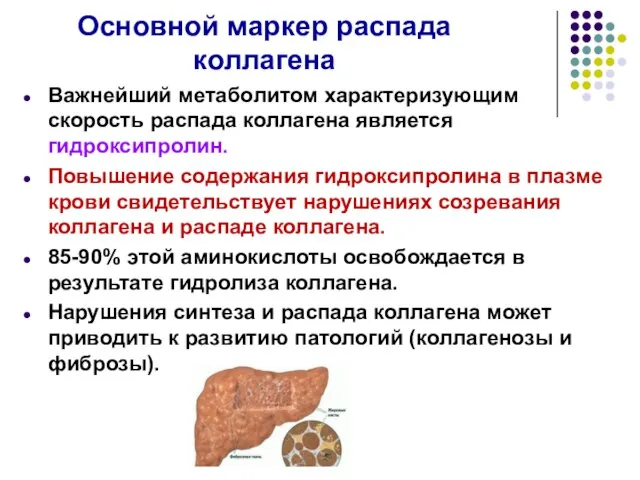
- 31. Основной маркер распада коллагена Важнейший метаболитом характеризующим скорость распада коллагена является гидроксипролин. Повышение содержания гидроксипролина в
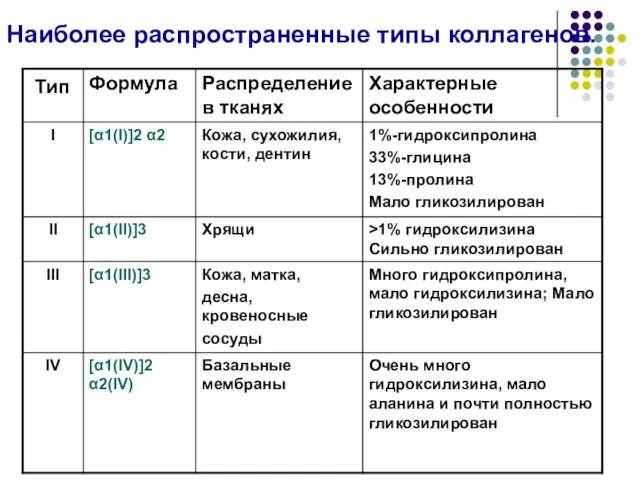
- 32. Типы коллагена В настоящее время известно около 20 различных типов коллагена, различающихся по первичной и пространственной
- 33. Наиболее распространенные типы коллагенов.
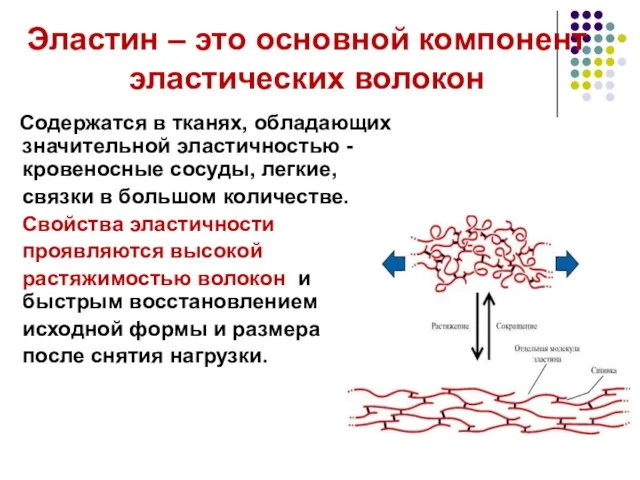
- 34. Эластин – это основной компонент эластических волокон Содержатся в тканях, обладающих значительной эластичностью - кровеносные сосуды,
- 35. Особенности аминокислотного состава эластина Эластин – гликопротеин с молекулярной массой 70кДа, содержит много гидрофобных аминокислот -
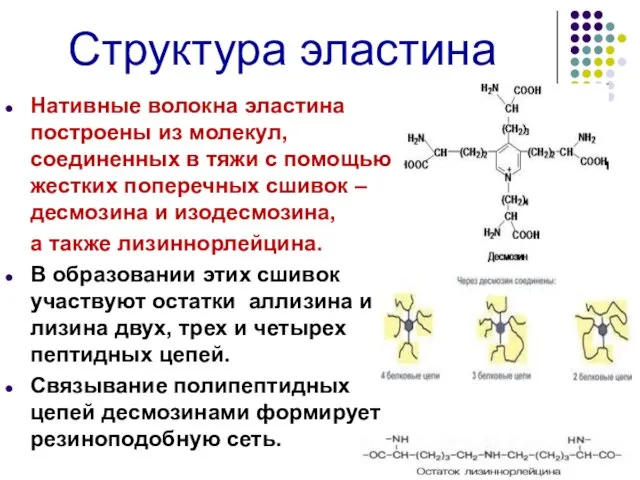
- 36. Структура эластина Нативные волокна эластина построены из молекул, соединенных в тяжи с помощью жестких поперечных сшивок
- 37. Неколлагеновые белки межклеточного матрикса К этой группе белков относятся относятся адгезивные белки, такие как фибронектин, ламинин,
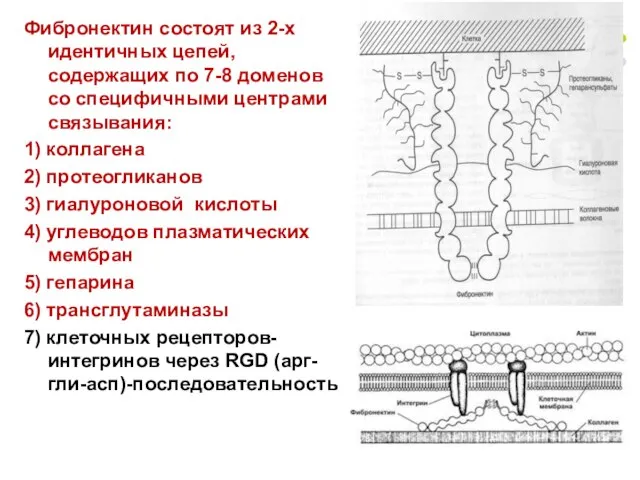
- 38. Фибронектин состоят из 2-х идентичных цепей, содержащих по 7-8 доменов со специфичными центрами связывания: 1) коллагена
- 39. Адгезивные белки часто содержат последовательность Арг-Гли-Асп (RGD), участвующую в присоединении к клеточным белковым рецепторам – интегринам,
- 40. Ламинины – гликопротеины базальных мембран (3), отделяющую соединительную ткань от эпителия Содержит несколько центров связывания с
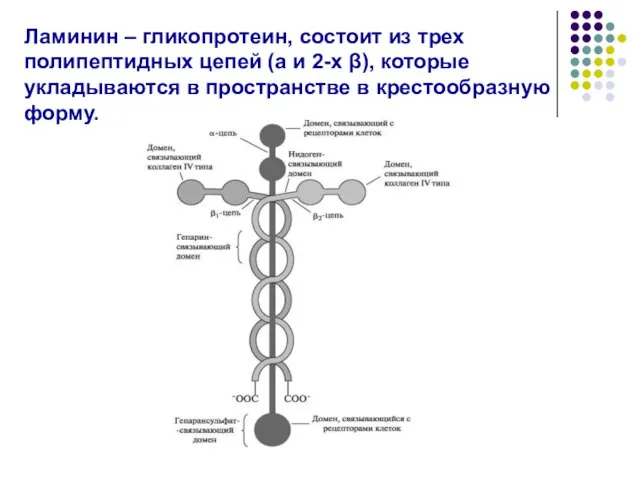
- 41. Ламинин – гликопротеин, состоит из трех полипептидных цепей (a и 2-х β), которые укладываются в пространстве
- 42. К неколлагеновым белкам относятся Gla-белки. (это белки, содержащие аминокислотные остатки 7-карбокси глутаминовой кислоты) Матриксный gla-белок содержит
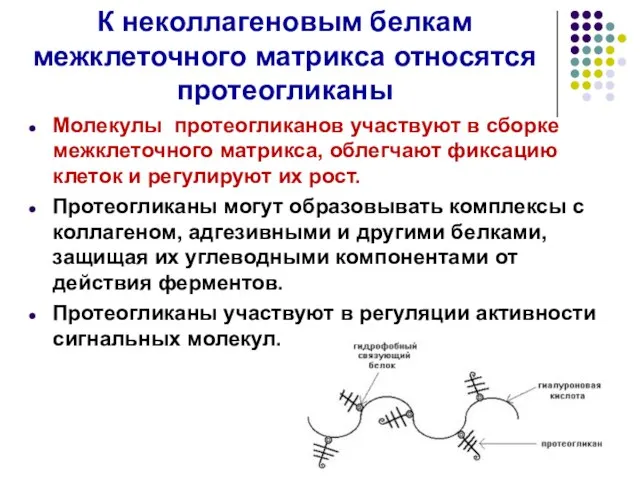
- 43. К неколлагеновым белкам межклеточного матрикса относятся протеогликаны Молекулы протеогликанов участвуют в сборке межклеточного матрикса, облегчают фиксацию
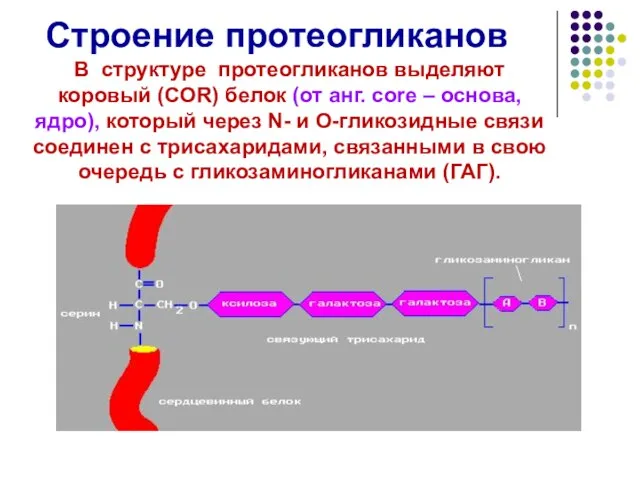
- 44. Строение протеогликанов В структуре протеогликанов выделяют коровый (COR) белок (от анг. сore – основа, ядро), который
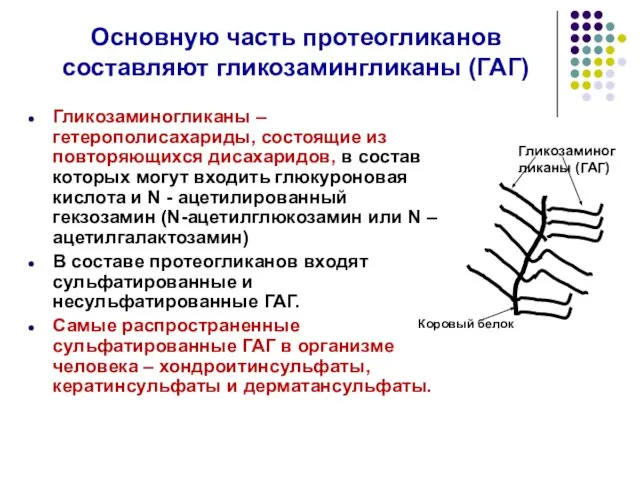
- 45. Основную часть протеогликанов составляют гликозамингликаны (ГАГ) Гликозаминогликаны – гетерополисахариды, состоящие из повторяющихся дисахаридов, в состав которых
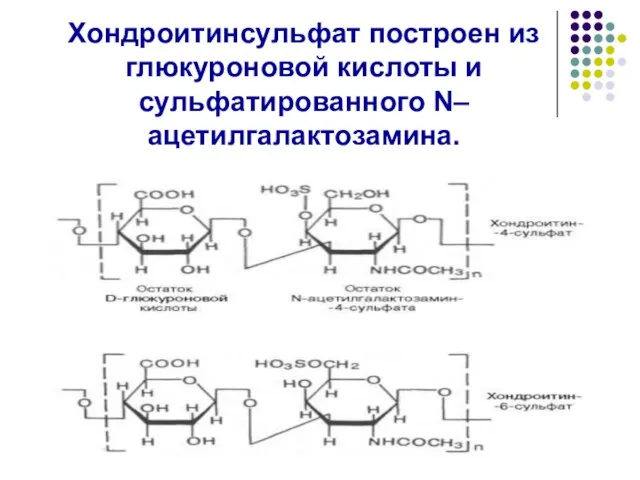
- 46. Хондроитинсульфат построен из глюкуроновой кислоты и сульфатированного N–ацетилгалактозамина.
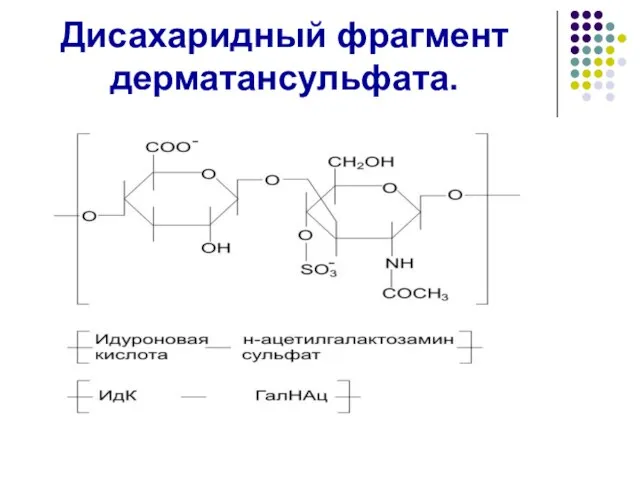
- 47. Дисахаридный фрагмент дерматансульфата.
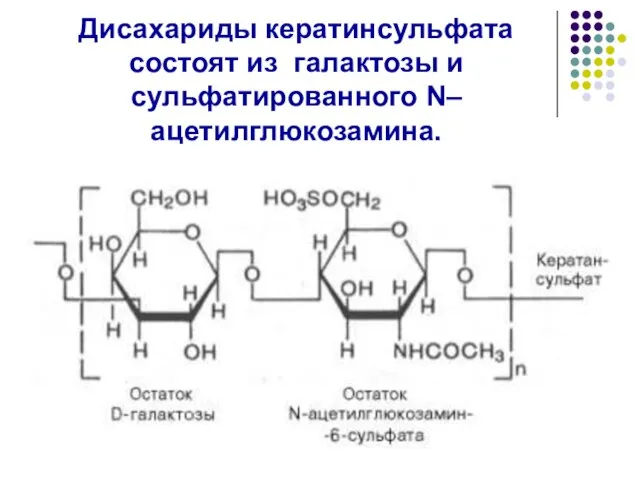
- 48. Дисахариды кератинсульфата состоят из галактозы и сульфатированного N–ацетилглюкозамина.
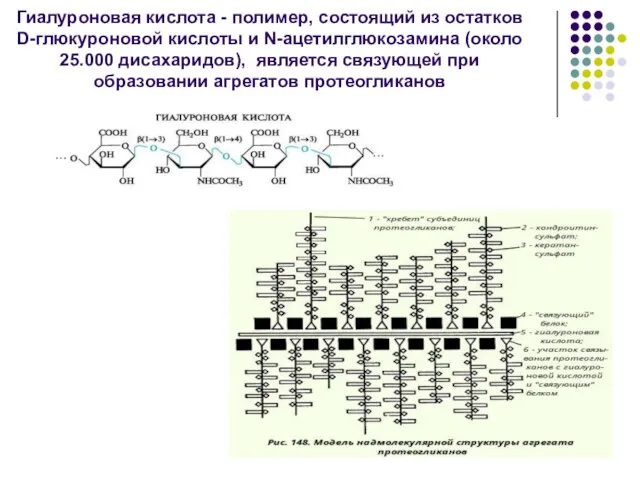
- 49. Гиалуроновая кислота - полимер, состоящий из остатков D-глюкуроновой кислоты и N-ацетилглюкозамина (около 25.000 дисахаридов), является связующей
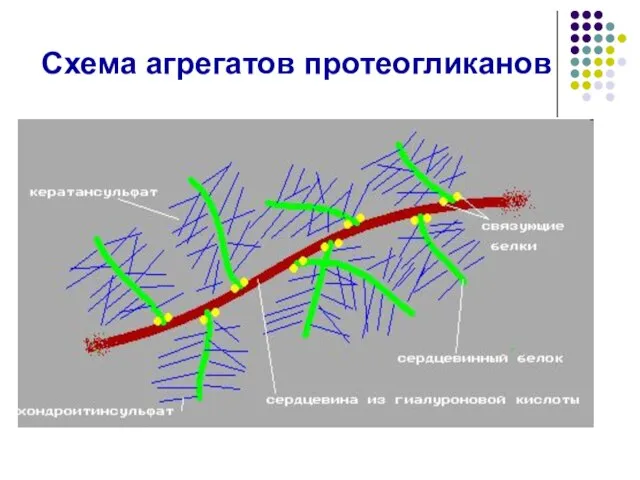
- 50. Схема агрегатов протеогликанов
- 51. Функции гликозаминогликанов - участвуют в организации межклеточного матрикса, являются основным скрепляющим веществом. - взаимодействуют с клеточными
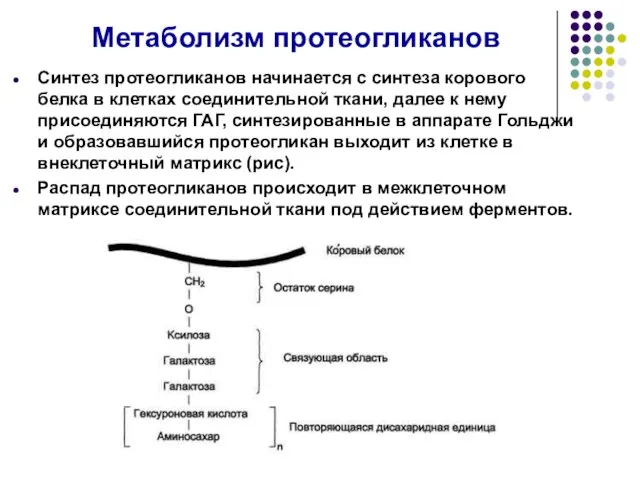
- 52. Метаболизм протеогликанов Синтез протеогликанов начинается с синтеза корового белка в клетках соединительной ткани, далее к нему
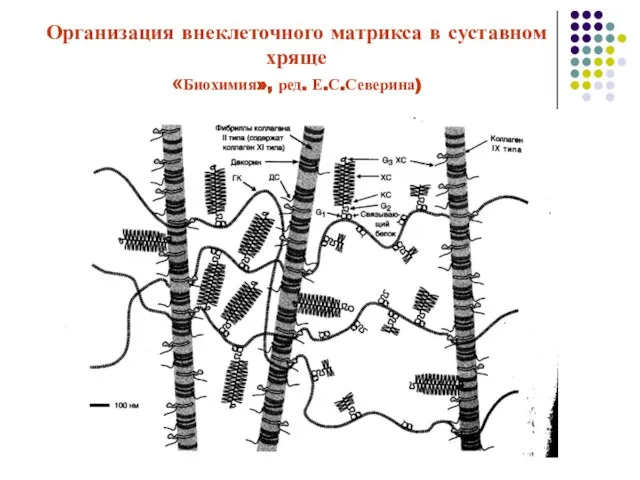
- 53. Организация внеклеточного матрикса в суставном хряще «Биохимия», ред. Е.С.Северина)
- 55. Скачать презентацию




![Особенности аминокислотного состава коллагена Полипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/367341/slide-9.jpg)















 Материя 2. Два способа существования материи
Материя 2. Два способа существования материи  История развития компьютерной техники
История развития компьютерной техники Магазин ООО Тринити-К
Магазин ООО Тринити-К Ак шараптар
Ак шараптар Проектирование сухого отсека ракеты-носителя из композиционных материалов с применением численной оптимизации
Проектирование сухого отсека ракеты-носителя из композиционных материалов с применением численной оптимизации Оборотный капитал корпорации
Оборотный капитал корпорации  Визуализация процесса распространения трещин в хрупких анизотропных материалах при компьютерном моделировании
Визуализация процесса распространения трещин в хрупких анизотропных материалах при компьютерном моделировании MADHU JAYANTI INTERNATIONAL LTD.
MADHU JAYANTI INTERNATIONAL LTD. Презентация на тему Царство Животные Тип Членистоногие Подтип Хелицеровые Класс Паукообразные
Презентация на тему Царство Животные Тип Членистоногие Подтип Хелицеровые Класс Паукообразные  Презентація1
Презентація1 Нанесение размеров с учётом формы предмета
Нанесение размеров с учётом формы предмета Хакасская национальная одежда
Хакасская национальная одежда Урок обучения грамоте
Урок обучения грамоте Компьютеры будущего
Компьютеры будущего Текстовые задачи как средство развития творческих способностей младших школьников
Текстовые задачи как средство развития творческих способностей младших школьников Презентация на тему Киевская земля (княжество)
Презентация на тему Киевская земля (княжество)  Деление и дроби (5 класс)
Деление и дроби (5 класс) Защита имущественных прав несовершеннолетних
Защита имущественных прав несовершеннолетних Петроград- Ленинград в годы НЭПа. - презентация
Петроград- Ленинград в годы НЭПа. - презентация Правописание падежных окончаний имён прилагательных
Правописание падежных окончаний имён прилагательных 707d6447bc8d447ca089a52f336ece7d
707d6447bc8d447ca089a52f336ece7d Пример презентации политики Хрущева
Пример презентации политики Хрущева НАЦИОНАЛЬНЫЙ ПАРК «ХВАЛЫНСКИЙ»
НАЦИОНАЛЬНЫЙ ПАРК «ХВАЛЫНСКИЙ» Кукла-оберег На удачу
Кукла-оберег На удачу Линейный алгоритм
Линейный алгоритм Презентация на тему Биография Ивана Сергеевича Тургенева
Презентация на тему Биография Ивана Сергеевича Тургенева Международный день отказа от курения
Международный день отказа от курения Презентация на тему Влияние человека на животных
Презентация на тему Влияние человека на животных