елемента в періодичній системі. Атоми – електронейтральні, а тому кількість електронів в кожному з них рівна відповідному порядковому номеру елемента:
де:
– заряд ядра,
– сумарна кількість електронів в атомі,
– порядковий номер елемента.
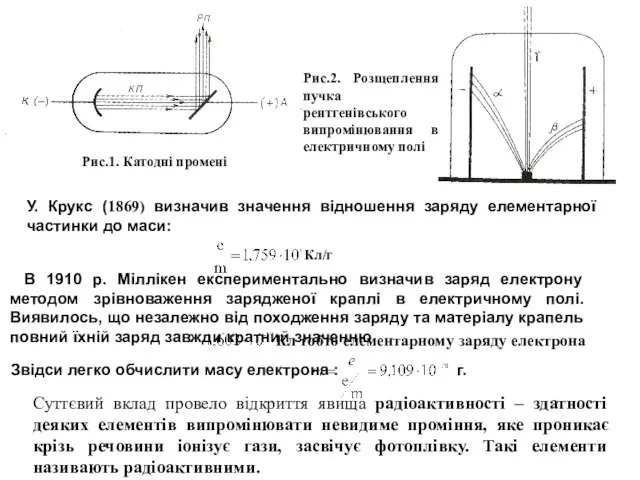
Цю гіпотезу підтвердив Мозлі (1913), кількісно досліджуючи рентгенівське випромінювання.
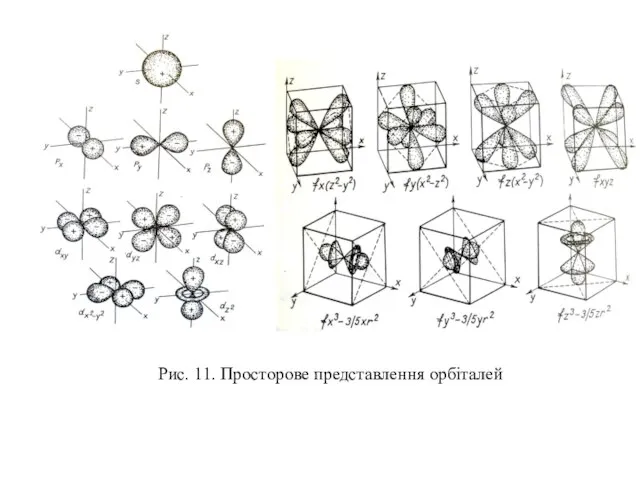
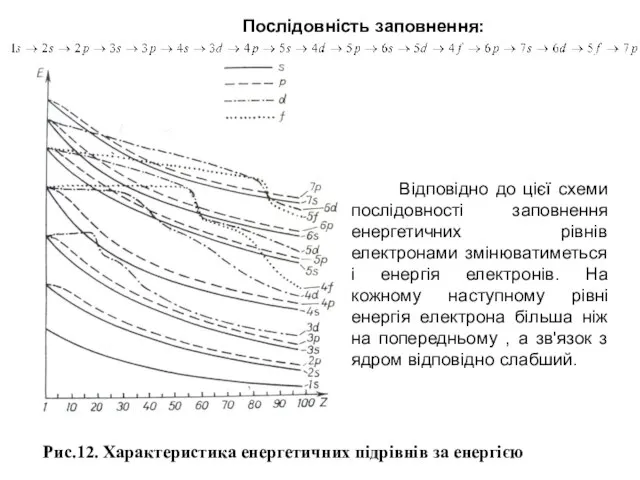
Рентгенівські спектри поділяють на неперервні (гальмівні), які не залежать від матеріалу аноду, та лінійчасті (характеристичні), що складаються з невеликого числа серій ліній і залежать від матеріалу аноду. Частинка при гальмуванні може випромінювати довільну частину своєї енергії, тому спектр є неперервним. Рентгенівський спектр, що характеризує енергетичні переходи внутрішніх електронів атома є лінійчастим. Серії його ліній позначають літерами K, L, M, N, O, P відповідно до електронних шарів.































 Создание онтологической базы знаний рекрутинговой системы
Создание онтологической базы знаний рекрутинговой системы Станковое искусство
Станковое искусство Презентация на тему ШКОЛА БЕЗОПАСНОСТИ
Презентация на тему ШКОЛА БЕЗОПАСНОСТИ  Родители принявшие участие в жизнедеятельности класса.
Родители принявшие участие в жизнедеятельности класса. 2011 год
2011 год Методики прогнозирования численности населения страны или крупных регионов. Подготовили: студенты 1 курса Группа Т1202 Токман
Методики прогнозирования численности населения страны или крупных регионов. Подготовили: студенты 1 курса Группа Т1202 Токман «Авиация для России» - прорывной проект гражданского авиастроения
«Авиация для России» - прорывной проект гражданского авиастроения -О чём притча? -Что оказалось самым дорогим даром? -Как ты думаешь, почему? -Как в Библии показан путь восстановления связи человека с
-О чём притча? -Что оказалось самым дорогим даром? -Как ты думаешь, почему? -Как в Библии показан путь восстановления связи человека с Учреждения высшего профессионального образования ДНР
Учреждения высшего профессионального образования ДНР Аналитическо-проектная работа по анализу кадровой политики организации
Аналитическо-проектная работа по анализу кадровой политики организации ПРЕДЛОЖЕНИЕ О СОТРУДНИЧЕСТВЕ
ПРЕДЛОЖЕНИЕ О СОТРУДНИЧЕСТВЕ Презентация на тему Политическая карта мира
Презентация на тему Политическая карта мира Предварительное исследование воды из разных источников
Предварительное исследование воды из разных источников Восстание Спартака (6 класс)
Восстание Спартака (6 класс)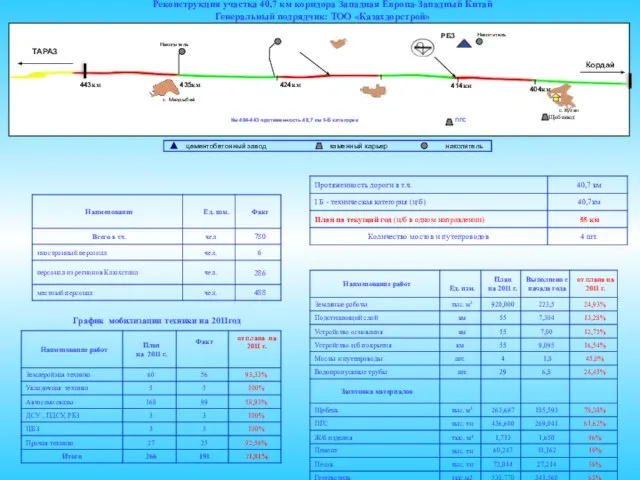 Реконструкция участка 40,7 км коридора Западная Европа-Западный Китай Генеральный подрядчик: ТОО «Казахдорстрой»
Реконструкция участка 40,7 км коридора Западная Европа-Западный Китай Генеральный подрядчик: ТОО «Казахдорстрой» Авторское право и дизайн
Авторское право и дизайн Итоги воспитательной работы 2010-2011 уч.год
Итоги воспитательной работы 2010-2011 уч.год Как измерить длину окружности?
Как измерить длину окружности? Карева Е.Н.
Карева Е.Н. Предварительное резюме к лекциям ноября-декабря.I. Исследование как перемещение
Предварительное резюме к лекциям ноября-декабря.I. Исследование как перемещение Наука, доверие, независимость
Наука, доверие, независимость Ги де Мопассан. «Ожерелье».Литература. 8 класс.(Внеклассное чтение.)
Ги де Мопассан. «Ожерелье».Литература. 8 класс.(Внеклассное чтение.) Использование телефона является самой быстрорастущей причиной ДТП как в России, так и за рубежом
Использование телефона является самой быстрорастущей причиной ДТП как в России, так и за рубежом Omapalvelu. Lisäselvityspyyntö
Omapalvelu. Lisäselvityspyyntö Организация приготовления, подготовки к реализации и хранения холодных блюд, кулинарных
Организация приготовления, подготовки к реализации и хранения холодных блюд, кулинарных 6 класс. Английский язык. Автор презентации: учитель английского языка Скирта Ольга Николаевна МБОУ Кулешовская СОШ №16 2011г.
6 класс. Английский язык. Автор презентации: учитель английского языка Скирта Ольга Николаевна МБОУ Кулешовская СОШ №16 2011г. Анализ практики соблюдения антимонопольного законодательства при осуществлении расчетов торговых сетей
Анализ практики соблюдения антимонопольного законодательства при осуществлении расчетов торговых сетей А. И. Солженицын – публицист, политик, патриот
А. И. Солженицын – публицист, политик, патриот