Содержание
- 2. Задание Таблица 1 – Исходные данные Изучается реакция A+Y ? B+Z в растворителе. Свойства и характер
- 3. Гипотеза о схеме превращений [1] Вещество А: I–CH2–COOH–йодуксусная кислота. Галогенпроизводные соединения являются эффективными реагентами в реакциях
- 4. Таблица 2 – Физические свойства веществ [2] 4 [2] Никольский Б.П. Справочник химика. – Л.: Химия,
- 5. Таблица 2 – Физические свойства веществ [2] 5 [2] Никольский Б.П. Справочник химика. – Л.: Химия,
- 6. Гипотеза о механизме реакции [3] Сайкс П. Механизмы реакций в органической химии / П. Сайкс; под
- 7. 7 План кинетического эксперимента
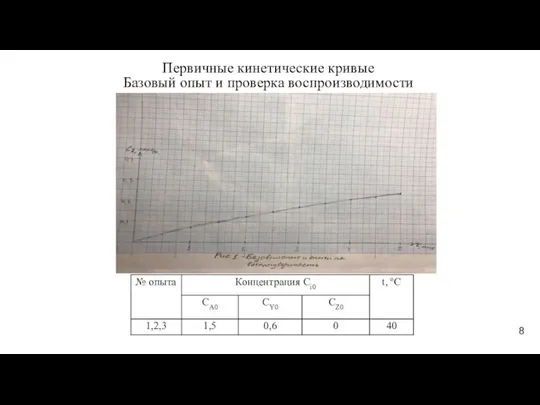
- 8. Первичные кинетические кривые Базовый опыт и проверка воспроизводимости 8
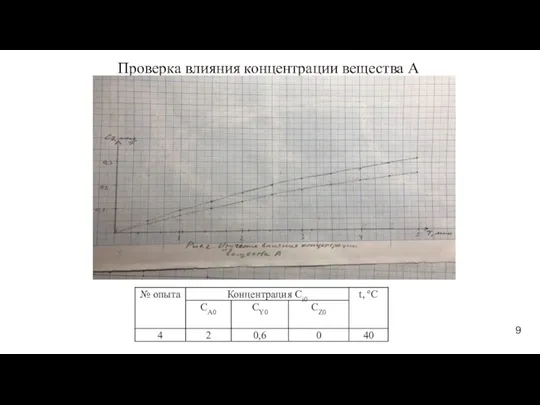
- 9. Проверка влияния концентрации вещества А 9
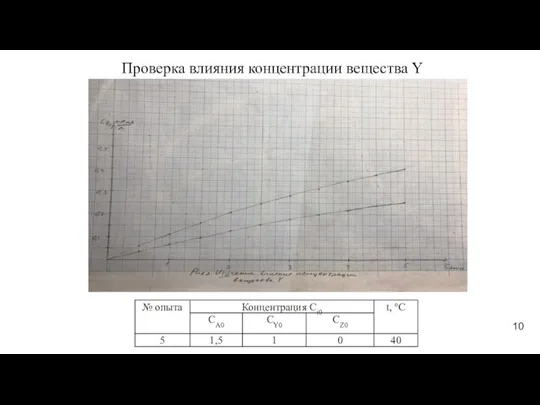
- 10. Проверка влияния концентрации вещества Y 10
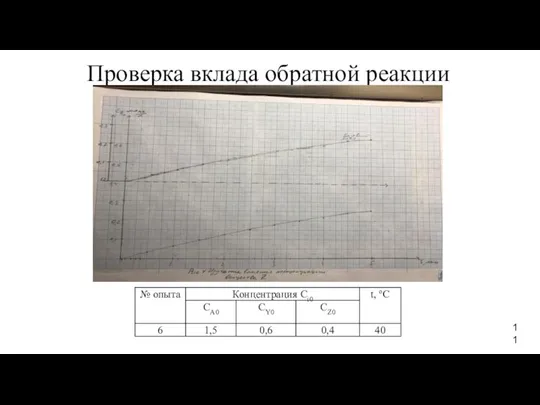
- 11. Проверка вклада обратной реакции 11
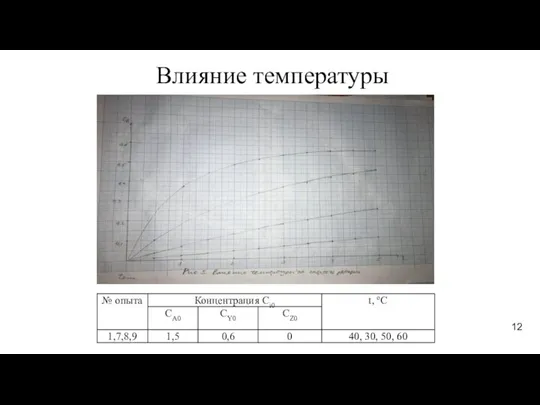
- 12. Влияние температуры 12
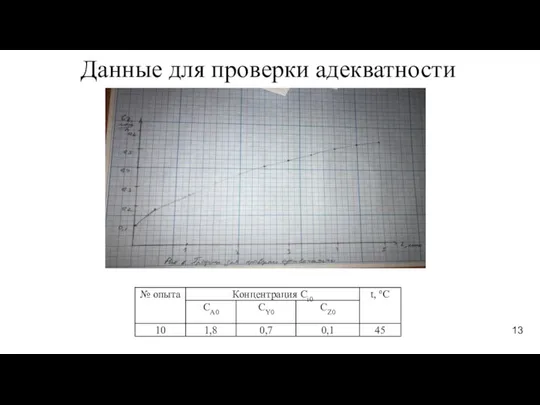
- 13. Данные для проверки адекватности 13
- 14. В результате анализа первичных кинетических кривых приходим к выводу, что кинетическое уравнение данной реакции имеет вид:
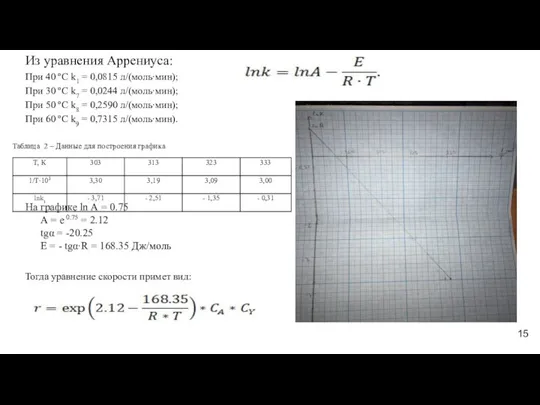
- 15. Из уравнения Аррениуса: При 40 ºС k1 = 0,0815 л/(моль∙мин); При 30 ºС k7 = 0,0244
- 16. Оценим дисперсию воспроизводимости. По трем параллельным опытам (1, 2 и 3) при τ = 5 мин
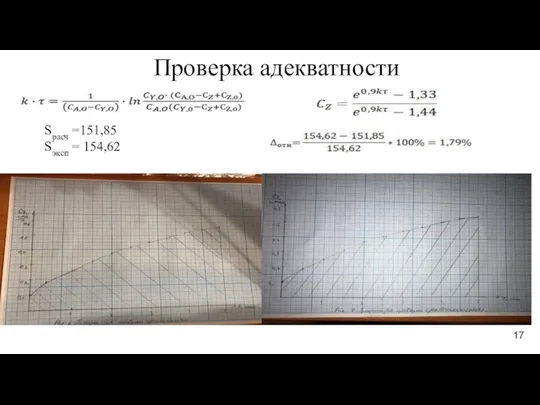
- 17. Проверка адекватности Sрасч =151,85 Sэксп = 154,62 17
- 18. Таблица 4 – Расчетные данные для оценки дисперсии адекватности 18
- 19. Выбор метода анализа [4] В растворе присутствуют катионы лития от обеих солей, поэтому раздельное количественное определение
- 20. Объём аликвотной части составляет 90 мл, он не должен превышать 10% от общего объёма, имеем, что
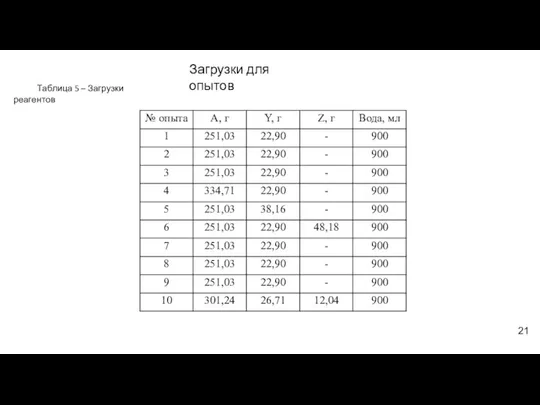
- 21. Таблица 5 – Загрузки реагентов Загрузки для опытов 21
- 22. Подбор реактора Схема экспериментальной установки. 1 – стеклянный трёхгорлый реактор с рубашкой; 2 – ртутный термометр
- 24. Скачать презентацию

![Гипотеза о схеме превращений [1] Вещество А: I–CH2–COOH–йодуксусная кислота. Галогенпроизводные соединения являются](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1179154/slide-2.jpg)
![Таблица 2 – Физические свойства веществ [2] 4 [2] Никольский Б.П. Справочник](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1179154/slide-3.jpg)
![Таблица 2 – Физические свойства веществ [2] 5 [2] Никольский Б.П. Справочник](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1179154/slide-4.jpg)
![Гипотеза о механизме реакции [3] Сайкс П. Механизмы реакций в органической химии](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1179154/slide-5.jpg)




![Выбор метода анализа [4] В растворе присутствуют катионы лития от обеих солей,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1179154/slide-18.jpg)


 Магазин спортивной одежды и спортинвентаря для фабрики предпринимательства
Магазин спортивной одежды и спортинвентаря для фабрики предпринимательства Риск в производственном менеджменте
Риск в производственном менеджменте Мировые культуры и межкультурные коммуникации. Лекция 7
Мировые культуры и межкультурные коммуникации. Лекция 7 Нарушения углеводного обмена
Нарушения углеводного обмена Лекция_6 ЭТД ФТД.ppt
Лекция_6 ЭТД ФТД.ppt Особенности русской живописи XIX века
Особенности русской живописи XIX века Национальные костюмы народов России
Национальные костюмы народов России Тест по психологии
Тест по психологии Общество и культура
Общество и культура Презентация на тему Автограф
Презентация на тему Автограф Peter Paul Rubens (1577 -1640)
Peter Paul Rubens (1577 -1640) Русские народные праздники
Русские народные праздники Жизнь и творчество И.С.Тургенева 1818 -1883
Жизнь и творчество И.С.Тургенева 1818 -1883 курсач
курсач Угадай-ка по картинам. Для 5-7 классов
Угадай-ка по картинам. Для 5-7 классов Дипломная работа: «Учет и анализ оплаты труда и расчетов с рабочими и служащими (на материалах «УЗ 9-ая городская клиническая больн
Дипломная работа: «Учет и анализ оплаты труда и расчетов с рабочими и служащими (на материалах «УЗ 9-ая городская клиническая больн День отца
День отца Creetings nohg
Creetings nohg Презентация на тему Мир дельфинов
Презентация на тему Мир дельфинов Презентация на тему Развивающее обучение что это такое
Презентация на тему Развивающее обучение что это такое  Конструктивные схемы каркасных гражданских зданий. Область применения
Конструктивные схемы каркасных гражданских зданий. Область применения «Наши таланты».
«Наши таланты». Аудитория Интернета
Аудитория Интернета Электроустановки и электрические сети
Электроустановки и электрические сети Круглый стол д.э.н., проф. Кузнецовой О.Д.
Круглый стол д.э.н., проф. Кузнецовой О.Д. Razvitie_ponyatia_o_chisle_Tselye_i_ratsionalnye_chisla_Deystvitelnye_chisla
Razvitie_ponyatia_o_chisle_Tselye_i_ratsionalnye_chisla_Deystvitelnye_chisla 1
1