Содержание
- 2. Что такое GMP? Give More Paper или Good Manufacturing Practice
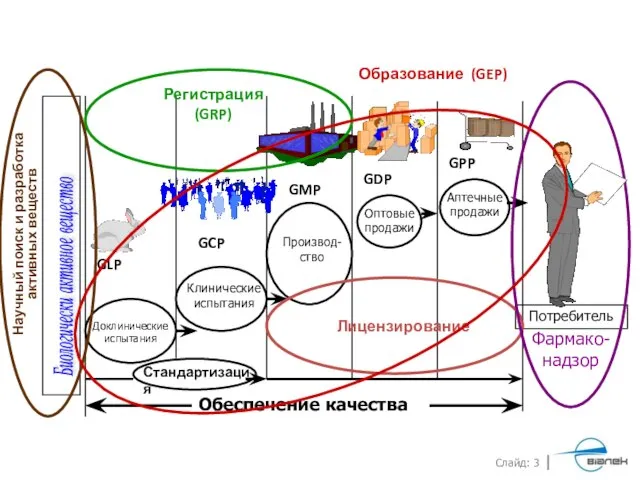
- 3. Биологически активное вещество Потребитель Доклинические испытания GLP Клинические испытания GCP Производ-ство GMP Оптовые продажи Аптечные продажи
- 4. Структура GMP Часть 1 Общие принципы GMP Часть 2 Общие требования к производству активных субстанций Часть
- 5. Структура GMP ЧАСТЬ 1 [Общие принципы GMP] Управление качеством Персонал Помещения и оборудование Документация Производство Контроль
- 6. ПРИЛОЖЕНИЯ Производство стерильной продукции Производство биологических препаратов для человека Производство радиофармацевтических препаратов Производство ветеринарных препаратов (за
- 7. ПРИЛОЖЕНИЯ Компьютеризированные системы Использование ионизирующего излучения при производстве лекарственных препаратов Производство образцов для клинических испытаний Производство
- 8. Структура GMP Часть 3 GMP Управление рисками по качеству (ICH Q9) Фармацевтическая система качества (ICH Q10)
- 9. Основные требования GMP Формализованная система качества Компетентность и гигиена персонала Предотвращение загрязнений (химических, биологических и механических)
- 10. Основные требования GMP Маркировка всего что движется Переработка и повторная обработка Контроль качества (отбор проб, входной,
- 11. Для корректной интерпретации GMP необходимо использовать множество неотраслевых стандартов: ИСО 14644 «Чистые помещения и связанные с
- 13. СЕМЬ ОСНОВНЫХ ШАГОВ: Формирование убежденности собственников и/или высшего руководства Диагностический аудит Базовое обучение Составление плана внедрения
- 14. ЗАПОВЕДИ Понять и принять философию GMP Установить персональную ответственность Создать простые документы Провести обучение всего персонала
- 15. GMP это не технический «буржуазный» барьер, направленный на создание преград для отечественных препаратов GMP это никак
- 16. Перед тем как приступить к внедрению каждый топ-менеджер должен принять философию GMP Мы должны понять, что
- 17. GMP это не точная наука GMP не дает единого рецепта «Что?» и «Как?» делать GMP –
- 18. Понять и принять философию GMP 1 Остановитесь! Оглянитесь! Если вдруг оказалось, что руководитель предприятия не принял
- 19. Установить персональную ответственность 2 В GMP заявлен принцип независимости службы производства от службы качества Обязательно нужно
- 20. Теория бракоделов ошибочна Помнить о том, что GMP-консультант это помощник, вдохновитель и координатор, но никак не
- 21. Если ответственность не подтверждена функциями, является ли она ответственностью данного работника? Если функция не обеспечена правами,
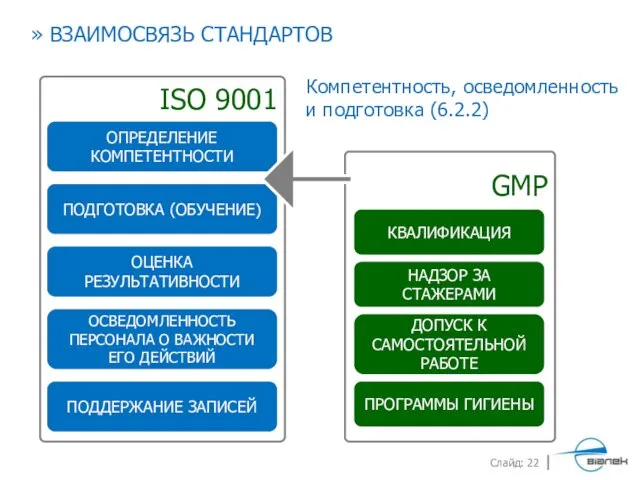
- 22. Компетентность, осведомленность и подготовка (6.2.2) ОПРЕДЕЛЕНИЕ КОМПЕТЕНТНОСТИ ПОДГОТОВКА (ОБУЧЕНИЕ) ОЦЕНКА РЕЗУЛЬТАТИВНОСТИ ОСВЕДОМЛЕННОСТЬ ПЕРСОНАЛА О ВАЖНОСТИ ЕГО
- 23. Создать простые документы 3 GMP требует большого количества документов – с этим нужно смириться! Определите какая
- 24. Выявите способных, воспитайте умелых, нагрузите их практикой! Вовлекайте исполнителей Сделайте подготовку документа рутинной обязанностью персонала Важно
- 25. На начальном этапе делайте документы на одном листе (таблицы, блок-схемы, краткое описание процедур) См. Пример Создать
- 26. Создать простые документы 3 Пишите только нужные документы Разделите этапы разработки документа Структура (на одном листе)
- 27. Хороший документ – тот документ, который четко и понятно подсказывает, что нужно делать, а не ставит
- 28. СТАНДАРТНАЯ ОПЕРАЦИОННАЯ ПРОЦЕДУРА [1] Прием сырья и материалов на склад Исполнитель: Заведующий складом сырья … Ход
- 29. Провести обучение всего персонала 4 Передайте философию GMP персоналу Обучение проводите по простым документам Используйте иллюстрации,
- 30. Начните с туалетов Не подменяйте понятий и требований в отношении одежды (одежда должны соответствовать классу чистоты
- 31. Фиксировать все события 6 Убедите себя, что фиксация событий спасает вам жизнь Нет подтверждающих записей –
- 32. Управлять изменениями и отклонениями 7 С первых дней внедрения GMP создайте систему управления изменениями Определите, что
- 33. См. Запрос на изменение См. Оценка целесообразности Объясняйте опасность бесконтрольных изменений Оценивайте эффективность до принятия решения
- 34. Управлять изменениями и отклонениями 7 Создайте систему управления отклонениями Вовлекайте в поиск причин исполнителей работы Классифицируйте
- 35. Не усложнять и вовремя остановиться 8 Делать только то, что понимаете Установить приоритеты (Все и сразу
- 36. Не обманывать себя! 9 Не бояться отклонений Проводить эффективные самоинспекции Любовный треугольник «Хороший документ – Плохой
- 37. Ежедневно двигаться вперед 8 Сжечь мосты Поверить в магию САРА, не забыть о колдовстве успеха Продолжайте
- 38. Для мысли о признании соответствия GMP Вам потребуется не менее 3-6 лет
- 39. Убеждайте собственника тратить деньги не на разработку новых препаратов, а хотя бы на элементарное приведение уже
- 40. Рекомендуемые сайты www.gmpnews.ru www.gmp-club.com forum.gmp-club.com www.fda.gov www.gmp-compliance.org www.cleanrooms.ru
- 42. Скачать презентацию


![Структура GMP ЧАСТЬ 1 [Общие принципы GMP] Управление качеством Персонал Помещения и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/418706/slide-4.jpg)





















![СТАНДАРТНАЯ ОПЕРАЦИОННАЯ ПРОЦЕДУРА [1] Прием сырья и материалов на склад Исполнитель: Заведующий](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/418706/slide-27.jpg)












 конфигурация по расчету квартплаты в Украине
конфигурация по расчету квартплаты в Украине ЮРИЙ ДОЛГОРУКИЙ Памятники Юрию Долгорукому в Москве.
ЮРИЙ ДОЛГОРУКИЙ Памятники Юрию Долгорукому в Москве. День психологического здоровья
День психологического здоровья Congestion and Pollution
Congestion and Pollution Организация региональной системы электронного обучения детей из удаленных и малокомплектных школ Новосибирской области с испол
Организация региональной системы электронного обучения детей из удаленных и малокомплектных школ Новосибирской области с испол Бир белек Бир китеп
Бир белек Бир китеп Личностно-ориентированное обучение
Личностно-ориентированное обучение Аристотель
Аристотель prezentaciy
prezentaciy Презентация Бузенковой Елены Анатольевны, воспитателя ГБДОУ д/c №24 Калининского района.
Презентация Бузенковой Елены Анатольевны, воспитателя ГБДОУ д/c №24 Калининского района. Киевские князья и их прозвища
Киевские князья и их прозвища Политические партии
Политические партии  Сказочник Андерсен
Сказочник Андерсен Презентация на тему Понятие и содержание должности государственной службы. Реестры должностей федеральной государственной служб
Презентация на тему Понятие и содержание должности государственной службы. Реестры должностей федеральной государственной служб Инвестиционный проект
Инвестиционный проект Королевство франков. Правление Хлодвига
Королевство франков. Правление Хлодвига Сәулет және дизайн-орта тұжырымдамасын жасау
Сәулет және дизайн-орта тұжырымдамасын жасау Презентация на тему Африка 7 класс
Презентация на тему Африка 7 класс Россия при преемниках Петра I
Россия при преемниках Петра I КРАСОТА И РИСК ПИРСИНГА
КРАСОТА И РИСК ПИРСИНГА Использование компьютера как инструмента образовательного процесса
Использование компьютера как инструмента образовательного процесса Европейская модель менеджмента
Европейская модель менеджмента Современная фирма. Продукт фирмы
Современная фирма. Продукт фирмы СЕРЬЕЗНО О ЕГЭ
СЕРЬЕЗНО О ЕГЭ Технология гидрокрекинга. Мифы об автомобильном масле
Технология гидрокрекинга. Мифы об автомобильном масле Правовая игра Знатоки Конституции
Правовая игра Знатоки Конституции Презентация на тему Китай: традиции против модернизации.
Презентация на тему Китай: традиции против модернизации. «Методы изучения физики. »
«Методы изучения физики. »