Слайд 2Исследование токсичности Протефлазида
Оценка безопасности использования препарата проводилась в соответствии с требованиями ГОСТ

12.1.007-76.
Изучение острой токсичности при введении per os, накожно и внутрибрюшинно проводили на трех видах взрослых животных обоих полов (мыши, крысы, коты).
Энтеральное и внутрибрюшинное введение препарата обеспечивали в соответствии с общепринятыми методическими рекомендациями, которые регламентируются только физиологичностью объема введения жидкости по отношению к массе тела исследуемого животного.
Слайд 3Исследование токсичности Протефлазида
При аппликации препарата учитывалась как масса тела, так и площадь,

на которую наносили препарат.
В зависимости от дозы Протефлазида регистрировали гибель животных.
При введении максимально возможных физиологических доз препарата гибель животных происходит в течение 2-х часов с момента аппликации. Уменьшение доз препарата «удлинняет» проявление клиники токсического действия препарата.
Слайд 4Исследование токсичности Протефлазида
Ограничение животных в употреблении жидкости в течение первых 5-8 часов

после манипуляции, было одинаковым в контрольной и опытной группах.
В отношении к стандартному рациону, который использовали в виварии, особенностей, которые свидетельствовали об отклонениях от нормы, не было.
Факт существенной, статистически подтвержденной разницы в значении LD50 для мышей (9453.3-10315.8 мг/кг) и крыс (8107.0-8865.9 мг/кг) при значении КВЧ (коэффициент межвидовой чувствительности) ~ 0,85 свидетельствует о возможности межвидовой экстраполяции полученных результатов токсичности.
Слайд 5Исследование токсичности Протефлазида
Хронический токсикологический эксперимент проводили на белых крысах массой 204.5 ±

10.2 г в течение 120 дней, доза препарата составляла 0.1, 0.01 и 0.04 от среднелетальной.
Определяли влияние препарата на основные интегральные показатели, динамику изменений периферической крови и поверхностно-активные свойства сурфактантной системы легких.
Таким образом, было установлено, что максимально переносимая доза Протефлазида в хроническом эксперименте составляет 0.1 от LD 50, а порог хронического приспособительно — физиологического действия ~ 90 мг/кг.
Слайд 6Исследование токсичности Протефлазида
По данным исследования острой и хронической токсичности Протефлазид отнесен, при

введении per os, к 4-му классу токсичности (мало опасным веществам).
Влияние Протефлазида на функциональное состояние гепатоцитов изучалось при постановке гексеналовой пробы in vivo на половозрелых крысах в динамике при пероральном введении (0.01 от LD 50) на протяжении 30 суток. Продолжительность гексеналового сна указывает на то, что введение Протефлазида в субтоксических дозах статистически доказанных изменений не вызывает, пероральное введение препарата (0.001 от LD 50) не влияет на показатели экскреторной функции почек у животных.
Не установлено видовых и половых различий в чувствительности указанных животных к действию препарата.





 Учитель информатики в моем представлении
Учитель информатики в моем представлении Топливный элемент: проблемы и перспективы
Топливный элемент: проблемы и перспективы Овощи. Приготовление блюд из овощей
Овощи. Приготовление блюд из овощей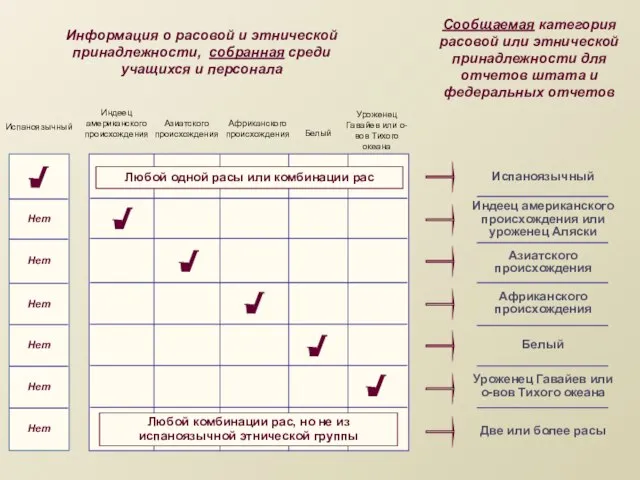 Информация о расовой и этнической принадлежности, собранная среди учащихся и персонала
Информация о расовой и этнической принадлежности, собранная среди учащихся и персонала Возможности интернета в развитии интеллектуального потенциала старшеклассников
Возможности интернета в развитии интеллектуального потенциала старшеклассников Тоталитарное государство
Тоталитарное государство Морской лев
Морской лев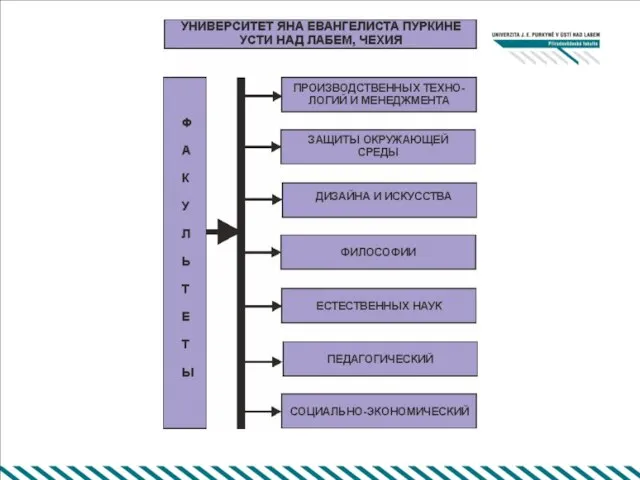 Университет Я. Э. Пуркине Факультет естественных наук Основан 4 ноября 2005 года. Цель факультета - подготовка бакалавров, магистров и
Университет Я. Э. Пуркине Факультет естественных наук Основан 4 ноября 2005 года. Цель факультета - подготовка бакалавров, магистров и Принципы и функции налогообложения
Принципы и функции налогообложения Технологическая карта
Технологическая карта Пульт горочный ПГУ-65
Пульт горочный ПГУ-65 ОАО «Российский банк развития»
ОАО «Российский банк развития» Сравнение скриптов TEMS
Сравнение скриптов TEMS Энергетика: вчера, сегодня, завтра
Энергетика: вчера, сегодня, завтра Житие Бориса и Глеба
Житие Бориса и Глеба Техника классического лыжного хода
Техника классического лыжного хода Салават Юлаев - национальный герой башкирского народа
Салават Юлаев - национальный герой башкирского народа ГРЕЙДИНГ
ГРЕЙДИНГ Основы православной культуры
Основы православной культуры Моя семья. Фотоальбом Артёма Тарасевича
Моя семья. Фотоальбом Артёма Тарасевича Методика Построение заборчика. Диагностика наглядно-действенного мышления у дошкольников
Методика Построение заборчика. Диагностика наглядно-действенного мышления у дошкольников Химические средства гигиены и косметики
Химические средства гигиены и косметики Колоноскопия и ирригоскопия. Виртуальная колоноскопия
Колоноскопия и ирригоскопия. Виртуальная колоноскопия Как пройти путь от создания идеи до действующего стартапа
Как пройти путь от создания идеи до действующего стартапа Презентація проекту“Порівняльний аналіз подій, що відбулися 150 років тому:1) 19 лютого(3 березня) 1861 р. цар Олександр ІІ видав маніф
Презентація проекту“Порівняльний аналіз подій, що відбулися 150 років тому:1) 19 лютого(3 березня) 1861 р. цар Олександр ІІ видав маніф Пантелеймон Куліш
Пантелеймон Куліш МЕЖДУНАРОДНЫЙ НАЛОГОВЫЙ КОНГРЕСС Заемное финансирование – практические аспекты Контролируемая задолженность: понятие и сложн
МЕЖДУНАРОДНЫЙ НАЛОГОВЫЙ КОНГРЕСС Заемное финансирование – практические аспекты Контролируемая задолженность: понятие и сложн Планирование и управление временем
Планирование и управление временем