Содержание
- 2. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Атомно-молекулярное учение В 1741 г. М.В.Ломоносов впервые высказал предположения
- 3. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Позже, в 1803 г., Дж.Дальтон также приходит к выводу
- 4. Крыжановская Т.Н., СОШ № 12. г. Северодонецк 1. Все вещества состоят из молекул, т.е. химическое соединение
- 5. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Закон постоянства состава вещества (Ж.Л.Пруст, 1799 г.). Качественный и
- 6. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Закон сохранения массы (М.В.Ломоносов, 1748 г., А.Л.Лавуазье, 1789 г.).
- 7. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Закон Авогадро (А.Авогадро, 1811 г., С.Канниццаро, 1858 г.) В
- 8. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Следствия из закона Авогадро: 1) При одинаковых условиях равные
- 9. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Закон эквивалентов (И.В.Рихтер, 1792 г.). Массы веществ, вступающих в
- 10. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Химический эквивалент элемента – такая его масса, которая соединяется
- 11. Крыжановская Т.Н., СОШ № 12. г. Северодонецк На основе закона эквивалентов выведены формулы для расчета эквивалентных
- 12. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Э(кислоты) = молярная масса кислоты /основность кислоты, например: Э(H2SO4)
- 13. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Э(основания) = молярная масса основания/кислотность основания, например: Э(Ca(OH)2) =
- 14. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Э(соли) = молярная масса соли/(валентность металла•число атомов металла), например:
- 15. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Для определения эквивалентной массы элемента необходимо знать состав его
- 16. Крыжановская Т.Н., СОШ № 12. г. Северодонецк При решении задач на вычисление эквивалентных масс необходимо иметь
- 17. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Для вычисления эквивалентной массы кислоты необходимо разделить её мольную
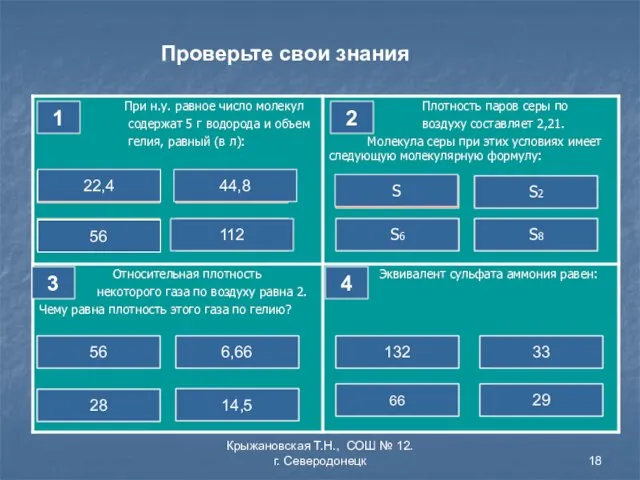
- 18. Крыжановская Т.Н., СОШ № 12. г. Северодонецк Правильно! Ошибка Ошибка Ошибка 1 22,4 44,8 112 56
- 20. Скачать презентацию
















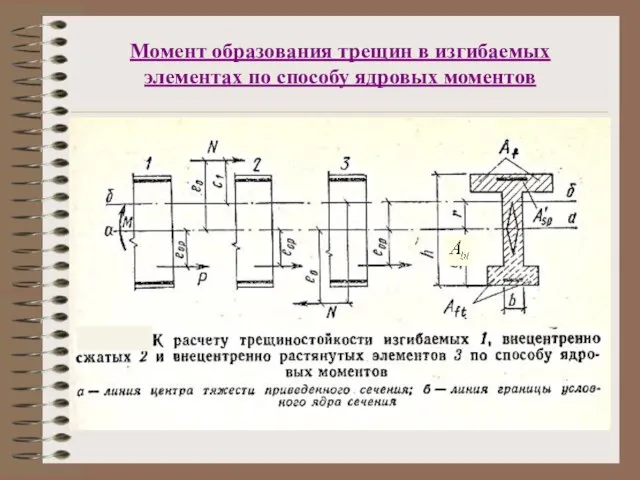 Момент образования трещин в изгибаемых элементах по способу ядровых моментов
Момент образования трещин в изгибаемых элементах по способу ядровых моментов Этапы подготовки мультимедийной презентации к аттестации
Этапы подготовки мультимедийной презентации к аттестации Задания
Задания Марийская медицина и религия
Марийская медицина и религия Захист практики
Захист практики Passahfest
Passahfest Тема урока:Выражение отношения в процентах
Тема урока:Выражение отношения в процентах 1С:Документооборот 8Опыт использования в бюджетных учреждениях
1С:Документооборот 8Опыт использования в бюджетных учреждениях Премьера театра Комедиантъ. Тайна заколдованного мешочка (5+)
Премьера театра Комедиантъ. Тайна заколдованного мешочка (5+) Mystery Shopping для производителей.Конференция. Extropolis. март 2007
Mystery Shopping для производителей.Конференция. Extropolis. март 2007 20161223_ekonomika_yaponii
20161223_ekonomika_yaponii День конституции. Викторина
День конституции. Викторина Классификация условий труда. Лекция 2.3
Классификация условий труда. Лекция 2.3 Сокровища ИнХимЭка. Проект создания сборника минералов
Сокровища ИнХимЭка. Проект создания сборника минералов Опричнина ИванаΙV Грозного
Опричнина ИванаΙV Грозного Договор строительного подряда
Договор строительного подряда Цифровизация в бюджетном секторе
Цифровизация в бюджетном секторе Лучшая специальность – «Химическая технология органических веществ»
Лучшая специальность – «Химическая технология органических веществ» Вид спорта бадминтон
Вид спорта бадминтон Употребление суффиксов существительных –чик-, -щик
Употребление суффиксов существительных –чик-, -щик Монгол улсын байгалийн н?хцлийн аж ахуйд ?з??лэх н?л??
Монгол улсын байгалийн н?хцлийн аж ахуйд ?з??лэх н?л?? Презентация на тему Создание Создание Содружества Независимых Государств
Презентация на тему Создание Создание Содружества Независимых Государств  Презентация на тему Война и мир Толстого
Презентация на тему Война и мир Толстого Атомная масса
Атомная масса Ямайка
Ямайка FLAG OF ENGLAND
FLAG OF ENGLAND  Лотерейные билеты Столото
Лотерейные билеты Столото Презентация на тему Генная Инженерия
Презентация на тему Генная Инженерия