Содержание
- 2. Как наша прожила б планета? Как люди жили бы на ней Без теплоты, магнита, света И
- 3. Проблемный вопрос. Что произойдёт, если в раствор или расплав электролита опустить электроды, которые присоединены к источнику
- 4. Электролиз – дословно: «лизис» – разложение, «электро» – электрическим током. Цель урока: изучить сущность и применение
- 5. Электролиз – это окислительно- -восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав
- 6. Электролиз План Электролиз расплава. Электролиз раствора. Сущность электролиза. Применение. Выводы.
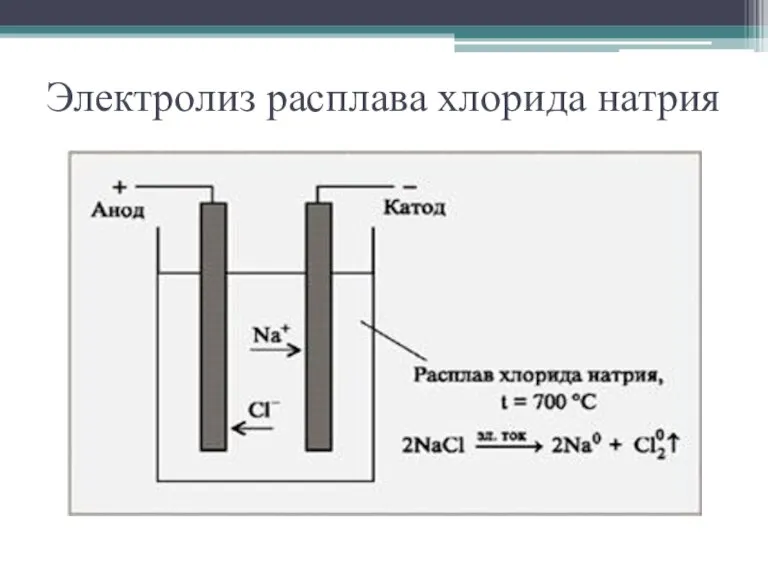
- 7. Электролиз расплава хлорида натрия
- 8. Электролиз является окислительно – - восстановительным процессом: на катоде всегда идёт процесс восстановления, на аноде всегда
- 9. Для определения результатов электролиза водных растворов существуют следующие правила: Процесс на катоде не зависит от материала
- 10. Процесс на аноде зависит от материала анода и от природы аниона. Если анод нерастворимый, т.е. инертный
- 11. Электрическая энергия Химическая энергия Электролиз Раствор NaCl Катод(-) Анод(+) H2О Расплав NaCl Катод(-) Анод(+) Na+ +
- 12. Работа с учебником (стр. 109-110) Проанализируйте процесс электролиза водного раствора сульфата натрия. Используя инструкции, запишите катодный
- 13. Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может
- 14. Внимательно наблюдайте за результатами электролиза сульфата меди. 1. Запишите катодный и анодный процессы, суммарное уравнение процесса.
- 15. Проверь себя! CuSO4 → Cu2+ + SO42- H2O Катод (-) Cu2+ SO42- Анод (+) Cu2+ +
- 16. Применение электролиза Катодные процессы Анодные процессы В гальваностегии ( никелирование, серебрение). В гальванопластике (изготовление копий). Получение
- 17. Гальванопластика политехнического государственного музея «Георгий Победоносец» Барельеф «Портрет Б.С.Якоби»
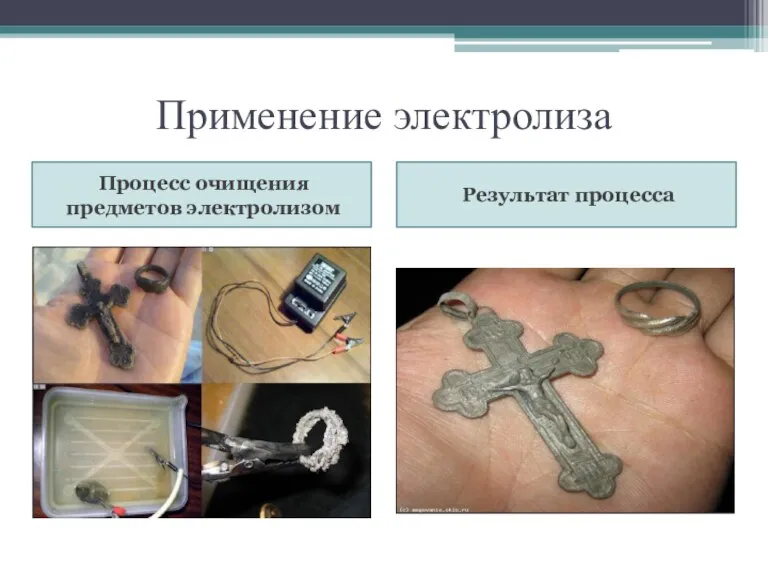
- 18. Применение электролиза Процесс очищения предметов электролизом Результат процесса
- 19. Установите правильную последовательность. окислительно-восстановительные реакции если через раствор или расплав Электролиз – это протекающие на электродах
- 20. Ответьте на вопросы. 1. При электролизе к аноду движутся: а) катионы б) анионы в) все ионы
- 21. Рефлексия. Если вы согласны с утверждениями, поставьте плюс, а если нет, то минус. 1. Я узнал
- 22. Домашнее задание Записи в тетради. Учебник «Химия – 10», стр. 107 - 111 (читать). Выполнить упр.
- 24. Скачать презентацию



















 Контрольний норматив. Тести і нормативи оцінки фізичної підготовленості студентів
Контрольний норматив. Тести і нормативи оцінки фізичної підготовленості студентів Inventions. Text provided by ukurcheev bogdan
Inventions. Text provided by ukurcheev bogdan Подходы к управлению
Подходы к управлению Колледж бодибилдеров
Колледж бодибилдеров Географические координаты
Географические координаты Презентация на тему Частушки
Презентация на тему Частушки СКАЗКА
СКАЗКА Проект «Первая помощь при переломах, вывихах и растяжении связок»
Проект «Первая помощь при переломах, вывихах и растяжении связок» Виртуальные машины
Виртуальные машины Презентация на тему "Формирование учебной мотивации у младших школьников" - скачать презентации по Педагогике
Презентация на тему "Формирование учебной мотивации у младших школьников" - скачать презентации по Педагогике Профессиональный клуб учителей
Профессиональный клуб учителей Сувенирная мастерская, 2 год обучения
Сувенирная мастерская, 2 год обучения БГТУ ВОЕНМЕХ им. Д.Ф. Устинова
БГТУ ВОЕНМЕХ им. Д.Ф. Устинова Пророки
Пророки 4.3.3. Химическая связь
4.3.3. Химическая связь Тема урока:Сделки и представительство.
Тема урока:Сделки и представительство. Мои пробабушка и продедушка
Мои пробабушка и продедушка Презентация на тему Изобразительное искусство классицизма и рококо
Презентация на тему Изобразительное искусство классицизма и рококо Проектирование блочной котельной
Проектирование блочной котельной Презентация на тему Характеристика стран ОПЕК
Презентация на тему Характеристика стран ОПЕК  Тренинг-семинар Твой характер – в твоих руках
Тренинг-семинар Твой характер – в твоих руках Мастер-класс Цветочное панно
Мастер-класс Цветочное панно Мастер-класс на тему: Мозаика из яичной скорлупы
Мастер-класс на тему: Мозаика из яичной скорлупы Соматоформды бұзылыстар
Соматоформды бұзылыстар Взаимодействие аллельных генов. Кодомирование
Взаимодействие аллельных генов. Кодомирование День Святого Валентина
День Святого Валентина IT-лицей Казанского федерального университета
IT-лицей Казанского федерального университета ПЕРИОДЫ ДЕТСКОГО ВОЗРАСТА. ЗНАЧЕНИЕ ГЕНЕТИЧЕСКИХ И НАСЛЕДСТВЕННЫХ факторов
ПЕРИОДЫ ДЕТСКОГО ВОЗРАСТА. ЗНАЧЕНИЕ ГЕНЕТИЧЕСКИХ И НАСЛЕДСТВЕННЫХ факторов