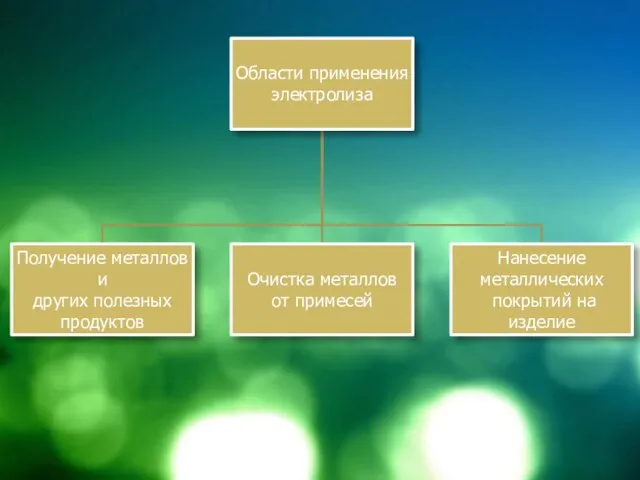
Слайд 3 Области применения электролиза
В основной химической промышленности – получение H2, O2, S,

галогенов, щелочей и др.
Электрометаллургия – получают металлы, в том числе щелочные и щелочно-земельные электролизом расплавов солей
Металлообрабатывающая промышленность – гальваностегия – нанесение металлических покрытий на изделия в декоративных целях, в целях защиты от коррозии (хромирование, никелирование, золочение, серебрение и т.д.)
Гальванопластика – снятие копий с изделий (скульптуры, грампластинки, рельефные рисунки). Внедрил Б. С. Якоби, под руководством которого таким образом изготовили украшения фронтона Большого театра, Исаакиевского Собора, Эрмитажа
Очистка металлов – рафинирование (очистку Ni, Pb, Cu проводят электрохимическим методом)
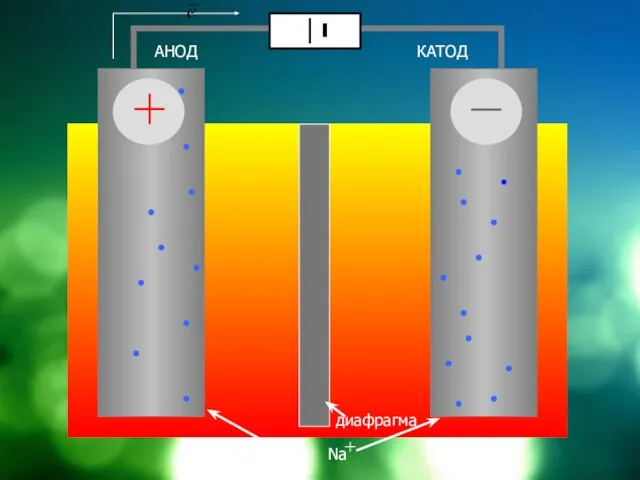
Слайд 4
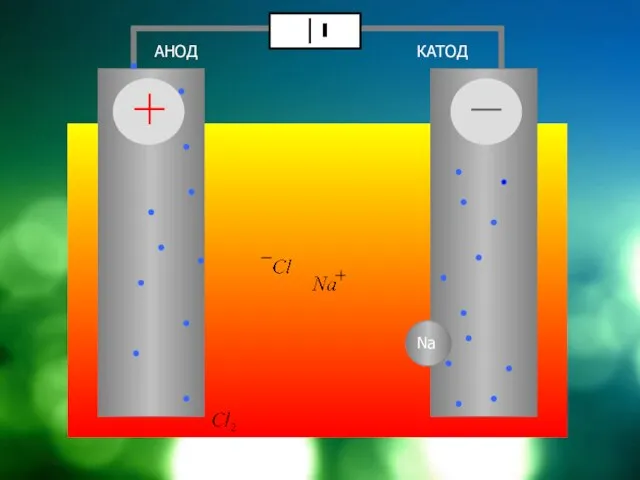
АНОД
КАТОД
диафрагма
NaCl = Cl + Na
Слайд 7
K(-) восстановление
A(+) окисление
2
2
1
расплав

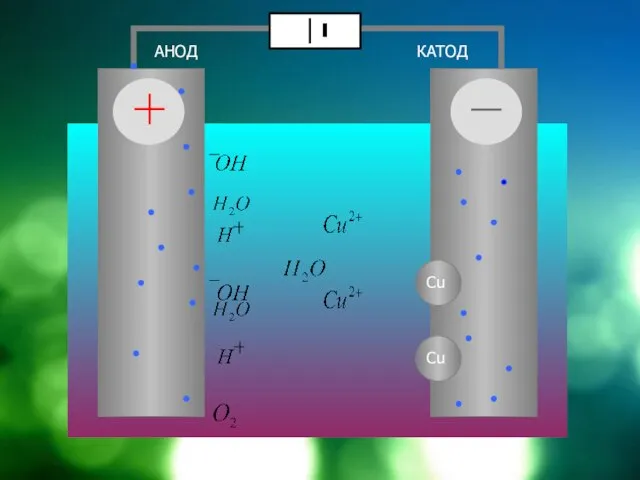
Слайд 9Схема электролиза раствора CuSO4

Слайд 11
K(-) восстановление
A(+) окисление
8
4
2
2
1

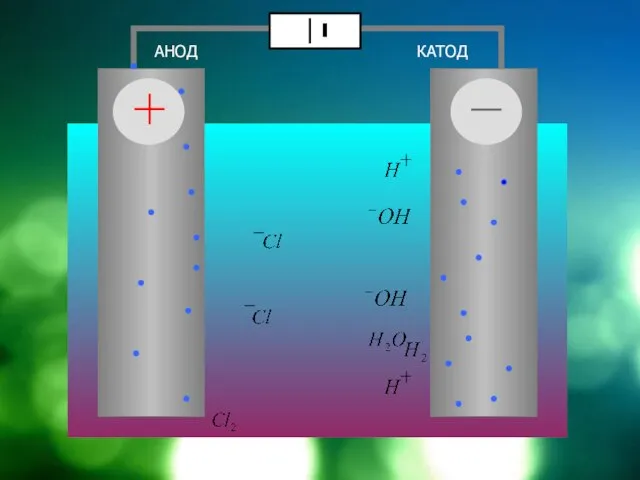
Слайд 12Схема электролизера на примере электролиза NaCl

Слайд 13
АНОД
КАТОД
диафрагма
NaCl = Cl + Na
HOH = OH +
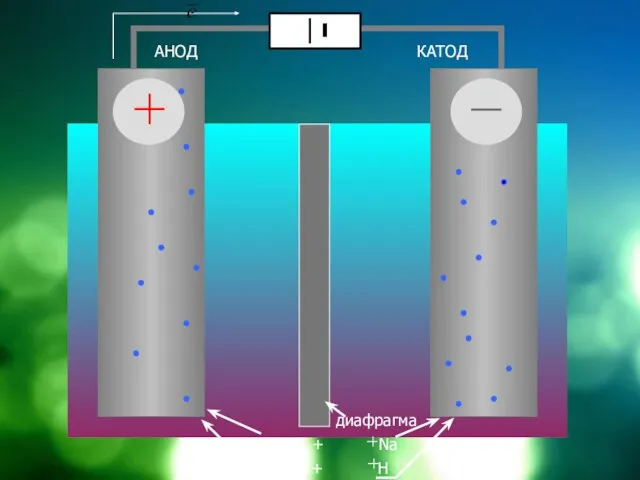
H









 Паспорт объекта сети Харьковская региональная дирекция
Паспорт объекта сети Харьковская региональная дирекция Презентация на тему Средства для борьбы с насекомыми
Презентация на тему Средства для борьбы с насекомыми Задачи и методы современной психологии
Задачи и методы современной психологии Подходы к моделированию ГРА
Подходы к моделированию ГРА Технология продуктивного чтения или формирование типа правильной читательской деятельности
Технология продуктивного чтения или формирование типа правильной читательской деятельности Заработать в интернете без вложений и без продаж
Заработать в интернете без вложений и без продаж Понятие стратегического менеджмента
Понятие стратегического менеджмента Ультразвуковой уровнемер на микроконтроллере PIC16F628
Ультразвуковой уровнемер на микроконтроллере PIC16F628 Роза из бумаги
Роза из бумаги ОАО «Противокарстовая и береговая защита» 606019, Нижегородская обл., г.Дзержинск, ул.Гастелло, 10/15 Тел./факс (8313) 25-98-01 E-mail:
ОАО «Противокарстовая и береговая защита» 606019, Нижегородская обл., г.Дзержинск, ул.Гастелло, 10/15 Тел./факс (8313) 25-98-01 E-mail:  Готовимся к части С
Готовимся к части С EBG Customer Training Map
EBG Customer Training Map Виды и назначение технологических карт
Виды и назначение технологических карт Учредитель: Администрация Городского округа «Город Волжск». Адрес:425000, ул. Коммунистическая, д.1.
Учредитель: Администрация Городского округа «Город Волжск». Адрес:425000, ул. Коммунистическая, д.1. Презентация на тему Русь и Золотая Орда (6 класс)
Презентация на тему Русь и Золотая Орда (6 класс) Анализ системы подготовки и аттестации кадров предприятия туризма. Задание 5
Анализ системы подготовки и аттестации кадров предприятия туризма. Задание 5 Нетрадиционная техника рисования граттаж Праздничный салют
Нетрадиционная техника рисования граттаж Праздничный салют сочинение
сочинение Проект « Профессии наших родителей»
Проект « Профессии наших родителей» Натюрморт
Натюрморт Ц у н а м и
Ц у н а м и Публичная презентация результатов педагогической деятельностии инновационной работыучителя начальных классов МКОУ «Лицей се
Публичная презентация результатов педагогической деятельностии инновационной работыучителя начальных классов МКОУ «Лицей се Психологический климат в семье (8 класс)
Психологический климат в семье (8 класс) Игры с залом PowerPoint
Игры с залом PowerPoint Кулинарный поединок
Кулинарный поединок Food rap
Food rap ЗУП КОРП: реализованная функциональность и выпуск конфигурации Докладчик: Лохтин Т.О.
ЗУП КОРП: реализованная функциональность и выпуск конфигурации Докладчик: Лохтин Т.О. Правила судейства игры Баскетбол
Правила судейства игры Баскетбол