Содержание
- 2. Виды сопряжения Виды сопряжения Сопряжение - явление выравнивания связей и зарядов в реальной молекуле по сравнению
- 3. Различают 2 основных вида сопряжения: π-π - сопряжение p-π – сопряжение. π-π – сопряженная система –
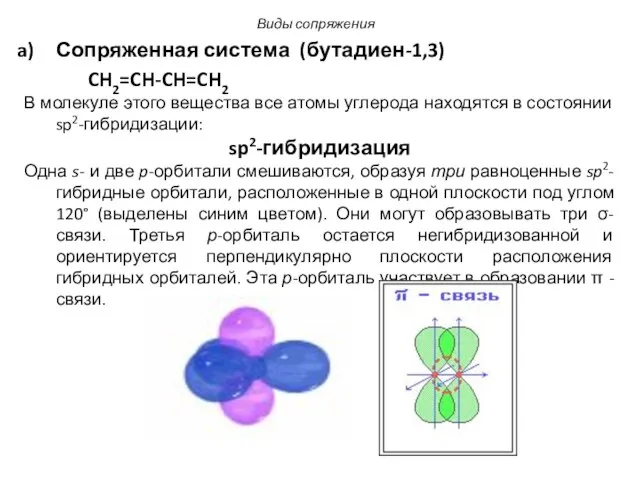
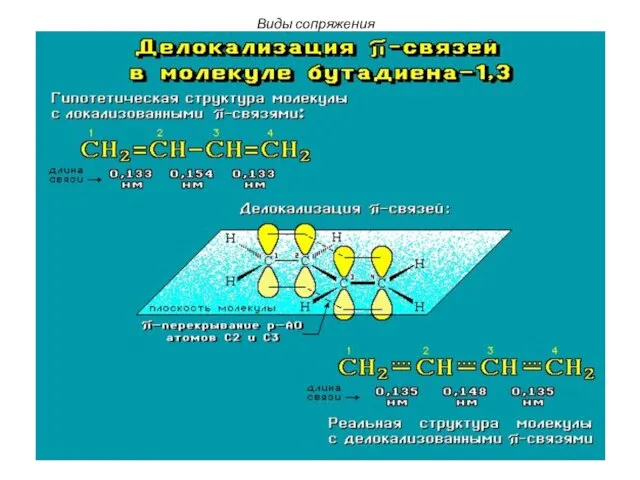
- 4. Сопряженная система (бутадиен-1,3) CH2=CH-CH=CH2 В молекуле этого вещества все атомы углерода находятся в состоянии sp2-гибридизации: sp2-гибридизация
- 5. В молекуле бутадиена-1,3: Все sp2-гибридизированные атомы углерода расположены в одной плоскости. Соединяясь между собой σ- связями
- 6. Виды сопряжения
- 7. Система сопряжения может включать гетероатом (О, N) π-π – сопряжение c гетероатомом в цепи осуществляется в
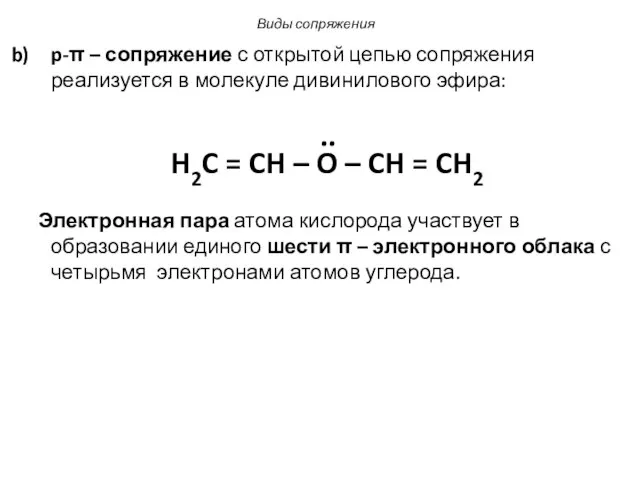
- 8. p-π – сопряжение с открытой цепью сопряжения реализуется в молекуле дивинилового эфира: .. H2C = CH
- 9. Ароматичность Ароматичность Ароматическими называют циклические соединения, имеющие замкнутую сопряженную систему, единое π-электронное облако в которых делокализовано
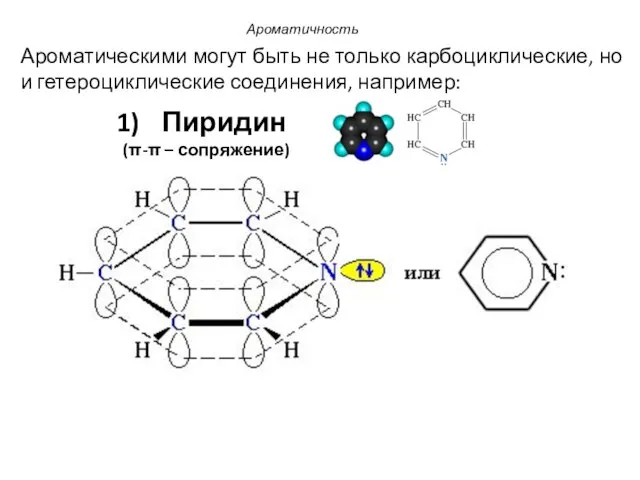
- 10. Ароматичность Ароматическими могут быть не только карбоциклические, но и гетероциклические соединения, например: Пиридин (π-π – сопряжение)
- 11. В пиридиновом атоме азота, находящемся в состоянии sp2-гибридизации, две гибридные орбитали участвуют в образовании σ-связей с
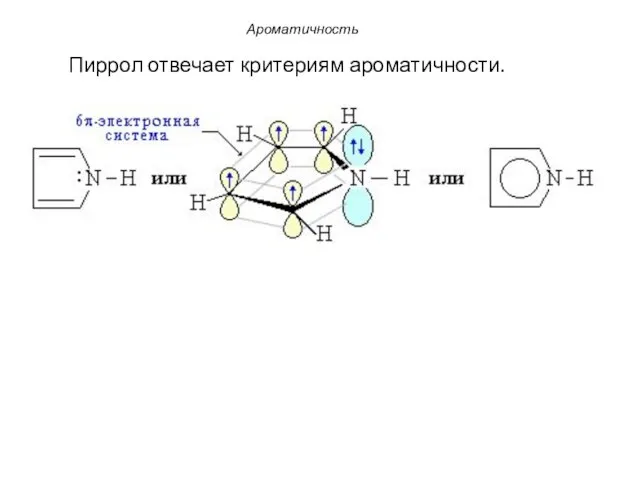
- 12. В пиррольном атоме азота, находящемся в состоянии sp2-гибридизации три гибридные орбитали участвуют в образовании σ-связей с
- 13. Пиррол отвечает критериям ароматичности. Ароматичность
- 14. Устойчивость сопряженных систем О термодинамической устойчивости сопряженной системы можно судить по величине энергии сопряжения, которая выделяется
- 15. Электронные эффекты заместителей Электронные эффекты заместителей ИНДУКТИВНЫЙ ЭФФЕКТ - это передача электронного влияния заместителя по цепи
- 16. Заместители, смещающие электронную плотность от себя в сторону углеродной цепи, проявляют положительный индуктивный эффект (+I). Это
- 17. Мезомерный эффект – это передача электронного влияния заместителя по сопряжённой системе. Действие мезомерного эффекта заместителей проявляется
- 18. Заместители, содержащие гетероатом с неподелённой парой электронов (гидроксогруппа, аминогруппа, атом хлора и др.), поставляют пару электронов
- 20. Скачать презентацию












 СОЦИАЛЬНЫЙ ПРОЕКТ «Там на ухоженных дорожках»
СОЦИАЛЬНЫЙ ПРОЕКТ «Там на ухоженных дорожках» Развитие креативности по Альберту Эйнштейну
Развитие креативности по Альберту Эйнштейну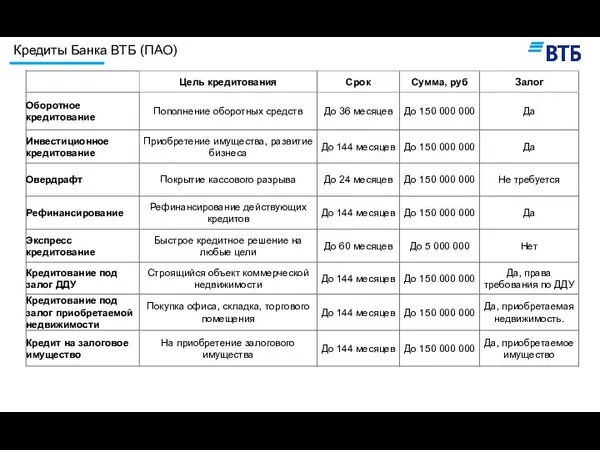 Кредиты банка ВТБ (ПАО)
Кредиты банка ВТБ (ПАО) Что же делать ?
Что же делать ? Права человека
Права человека Проблема готовности к школьному обучению в психолого – педагогических исследованиях .
Проблема готовности к школьному обучению в психолого – педагогических исследованиях . Псалмы 46-54
Псалмы 46-54 ЛР1
ЛР1 Мероприятия и промоушены. Август 2021
Мероприятия и промоушены. Август 2021 Про кошек и собак (2 класс)
Про кошек и собак (2 класс) РАЗГОВОР О ПРАВИЛЬНОМ ПИТАНИИ
РАЗГОВОР О ПРАВИЛЬНОМ ПИТАНИИ Информационно-техническое обеспечение рынка ценных бумаг
Информационно-техническое обеспечение рынка ценных бумаг Информация об областном конкурсе научных работ по проблемам развития агропромышленного комплекса.
Информация об областном конкурсе научных работ по проблемам развития агропромышленного комплекса. Карев Групп
Карев Групп 20170420_afrika.microsoft_powerpoint
20170420_afrika.microsoft_powerpoint Devoirs 2
Devoirs 2 Последствия после применения допинга (исследовательский проект )
Последствия после применения допинга (исследовательский проект ) Маркетинговое исследование авторынка
Маркетинговое исследование авторынка Уважаемые Десятиклассники! Познакомьтесь с материалами данной презентации и поучаствуйте в тестировании. Ответы на вопросы – те
Уважаемые Десятиклассники! Познакомьтесь с материалами данной презентации и поучаствуйте в тестировании. Ответы на вопросы – те Real Estate Market Analysis Basic Principles
Real Estate Market Analysis Basic Principles Посмотри вокруг 2 класс
Посмотри вокруг 2 класс Читает академик АН СИ Иван Петров
Читает академик АН СИ Иван Петров Методички 1) ЭКГ 2) Схема истории болезни
Методички 1) ЭКГ 2) Схема истории болезни Тропы
Тропы СОЧИНЯЙ - КА
СОЧИНЯЙ - КА Толерантность в школе
Толерантность в школе Презентация на тему Барельеф Изобразительное искусство
Презентация на тему Барельеф Изобразительное искусство Карьера в СМИ
Карьера в СМИ