Содержание
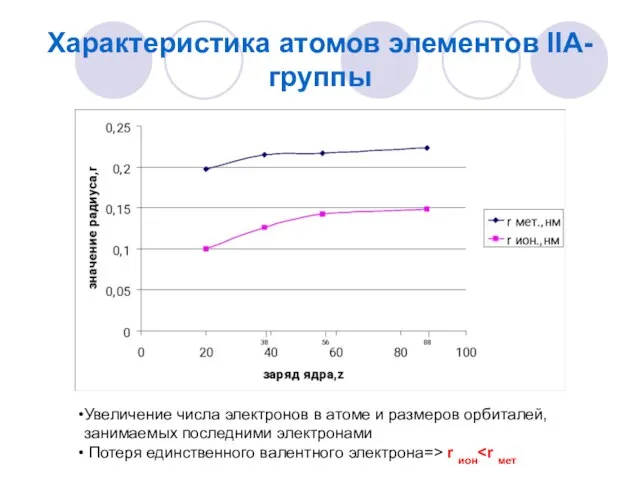
- 2. Характеристика атомов элементов IIA-группы Увеличение числа электронов в атоме и размеров орбиталей, занимаемых последними электронами Потеря
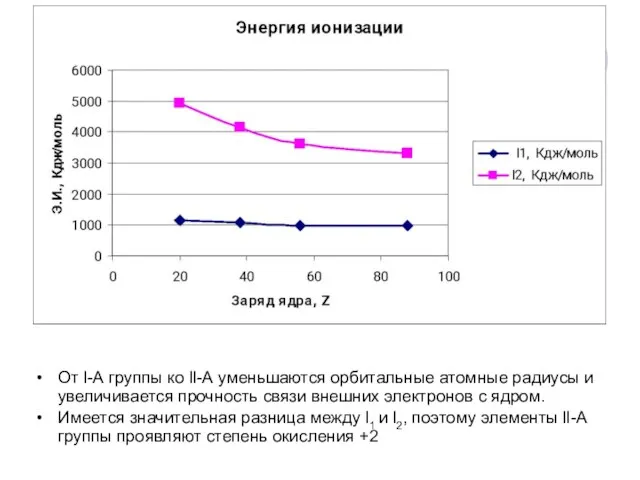
- 3. От l-А группы ко ll-А уменьшаются орбитальные атомные радиусы и увеличивается прочность связи внешних электронов с
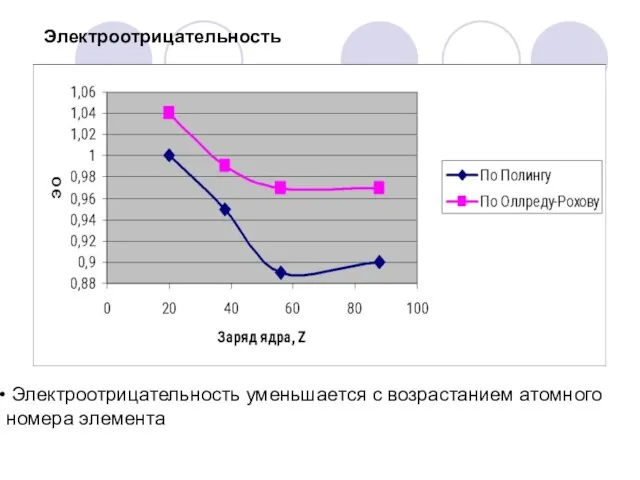
- 4. Электроотрицательность Электроотрицательность уменьшается с возрастанием атомного номера элемента
- 5. Особенности химии бериллия Ион Be2+ устойчив лишь в газовой фазе при высокой температуре Химическая связь в
- 6. В чистом виде Be, Mg и щелочноземельные металлы имеют серебристо-белый цвет. Все металлы, кроме Be, очень
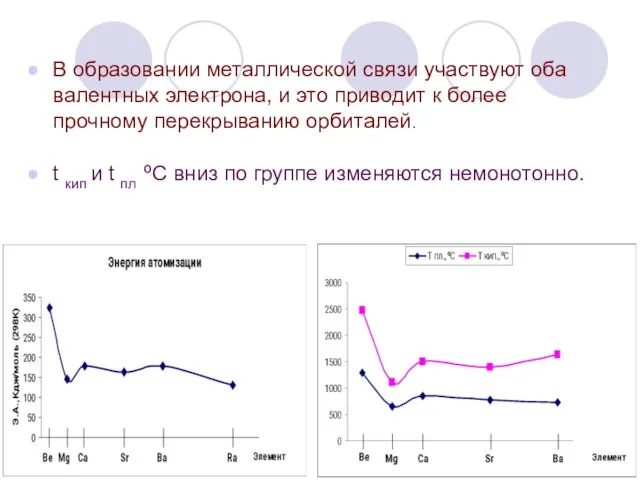
- 7. В образовании металлической связи участвуют оба валентных электрона, и это приводит к более прочному перекрыванию орбиталей.
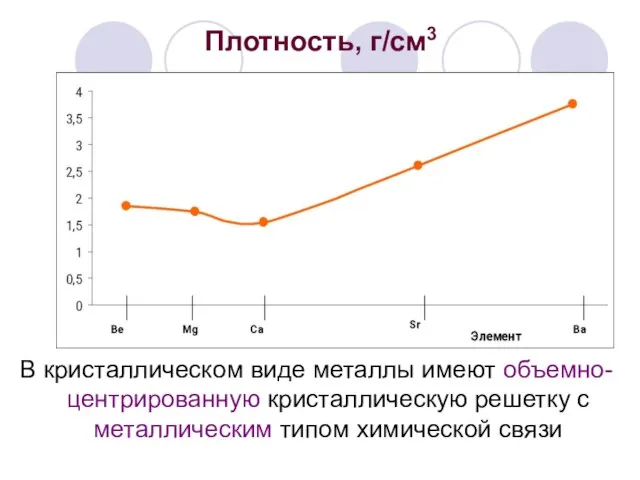
- 8. Плотность, г/см3 В кристаллическом виде металлы имеют объемно-центрированную кристаллическую решетку с металлическим типом химической связи
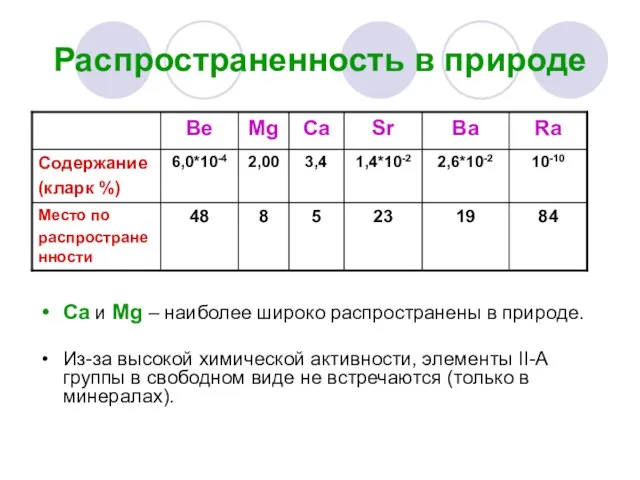
- 9. Распространенность в природе Ca и Mg – наиболее широко распространены в природе. Из-за высокой химической активности,
- 10. Минералы 2MgO*SiO2 (оливин) 3MgO*4SiO2*4H2O (тальк)
- 11. CaCO3 кальцит (известняк, мрамор, мел) SrSO4 (целестин)
- 12. BaSO4 (барит)
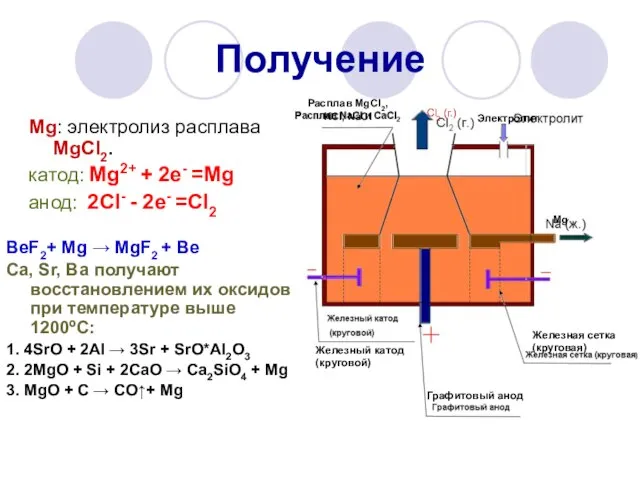
- 13. Получение Расплав MgCl2, KCl, NaCl Cl2 (г.) Электролит Железный катод (круговой) Графитовый анод Железная сетка (круговая)
- 14. Применение Be и его сплавы применяются в самолето- и ракетостроении, ядерной энергетике. Mg и его сплавы
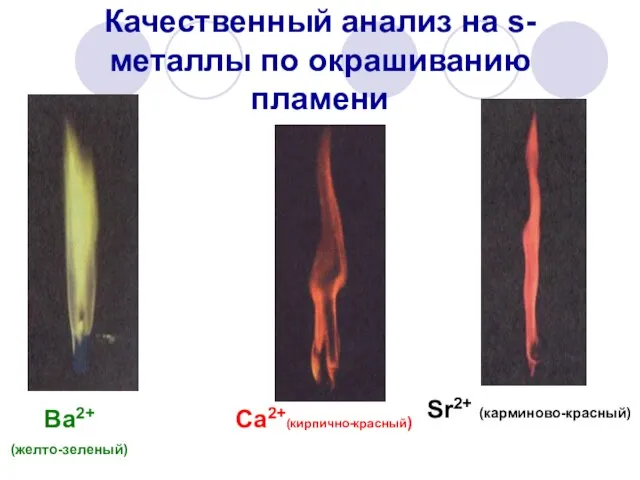
- 15. Качественный анализ на s-металлы по окрашиванию пламени Ba2+ (желто-зеленый) Ca2+(кирпично-красный) Sr2+ (карминово-красный)
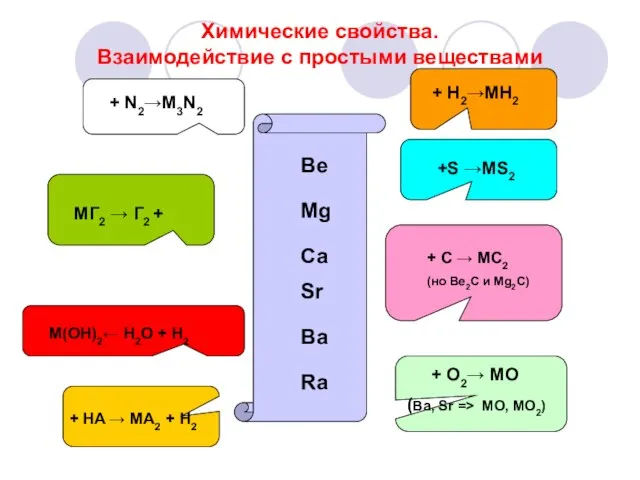
- 16. Химические свойства. Взаимодействие с простыми веществами Be Mg Ca Sr Ba Ra + H2→MH2 +S →MS2
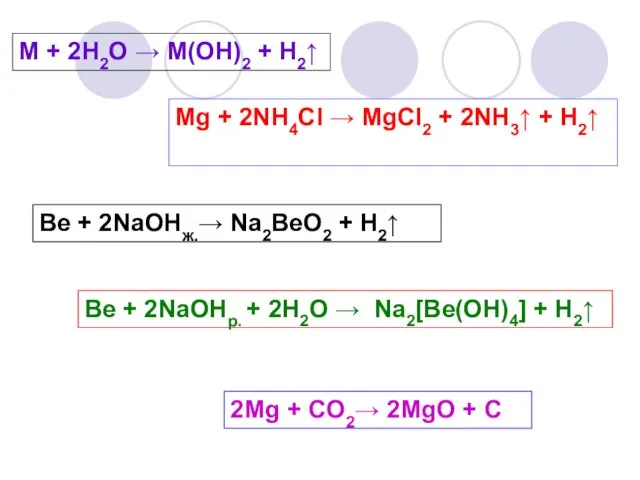
- 17. M + 2H2O → M(OH)2 + H2↑ Mg + 2NH4Cl → MgCl2 + 2NH3↑ + H2↑
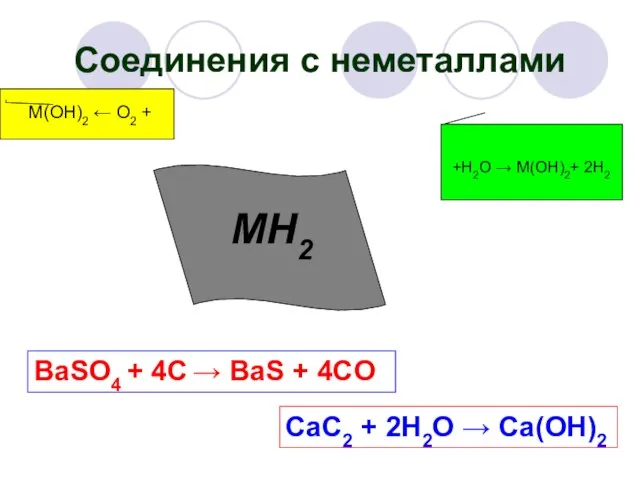
- 18. Соединения с неметаллами MH2 M(OH)2 ← O2 + +H2O → M(OH)2+ 2H2 BaSO4 + 4C →
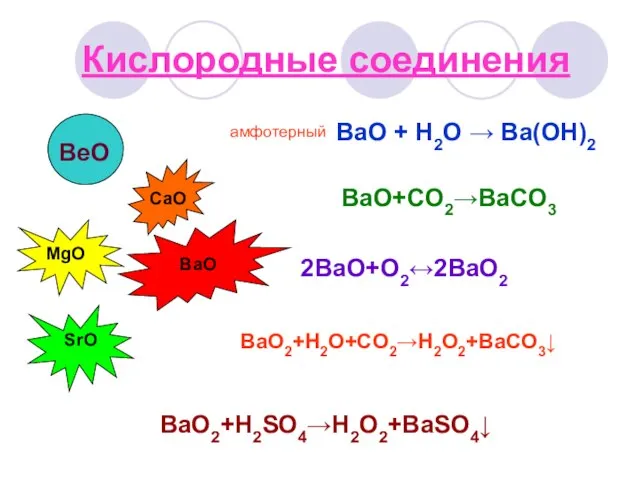
- 19. Кислородные соединения BeO амфотерный MgO CaO SrO BaO BaO + H2O → Ba(OH)2 BaO+CO2→BaCO3 2BaO+O2↔2BaO2 BaO2+H2O+CO2→H2O2+BaCO3↓
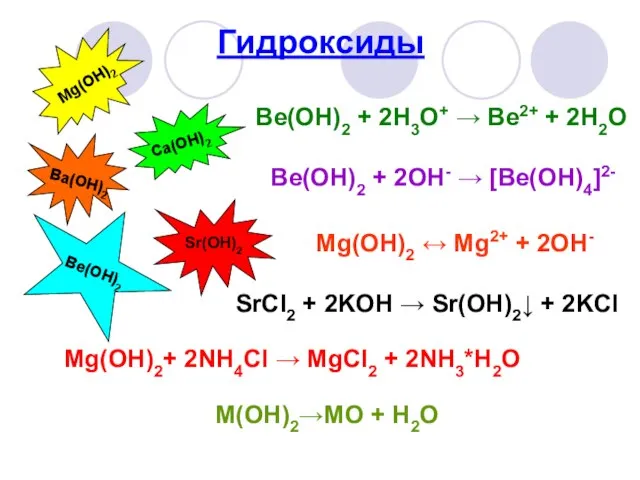
- 20. Гидроксиды Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 Be(OH)2 Be(OH)2 + 2H3O+ → Be2+ + 2H2O Be(OH)2 + 2OH-
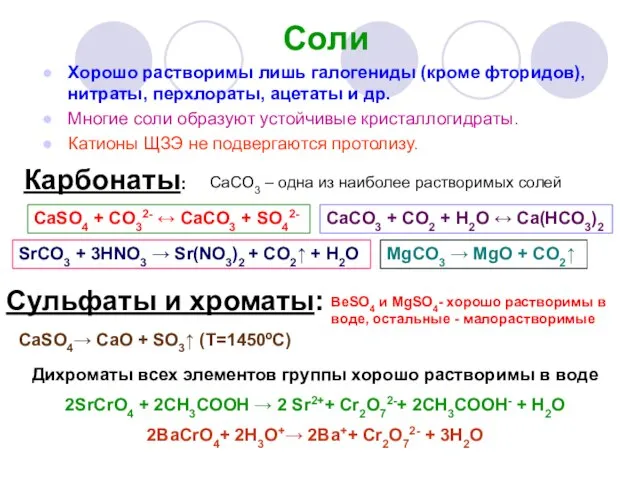
- 21. Хорошо растворимы лишь галогениды (кроме фторидов), нитраты, перхлораты, ацетаты и др. Многие соли образуют устойчивые кристаллогидраты.
- 22. Нитраты Ba(NO3)2 кристаллизуется в безводном состоянии Остальные соли образуют кристаллогидраты 2Mg(NO3)2→ 2MgO + 4NO2 + O2
- 23. Образование комплексных соединений более характерно, чем для щелочных металлов. В водном растворе Be входит в состав
- 24. Элементы II-А группы содержат на внешнем энергетическом уровне два электрона. Вниз по группе радиус атомов растет,
- 26. Скачать презентацию









 Евразия 4 класс
Евразия 4 класс Город будущего
Город будущего Рождество, да святки – ряженье, колядки.
Рождество, да святки – ряженье, колядки. Единая информационная база домашних животных и животных без владельцев
Единая информационная база домашних животных и животных без владельцев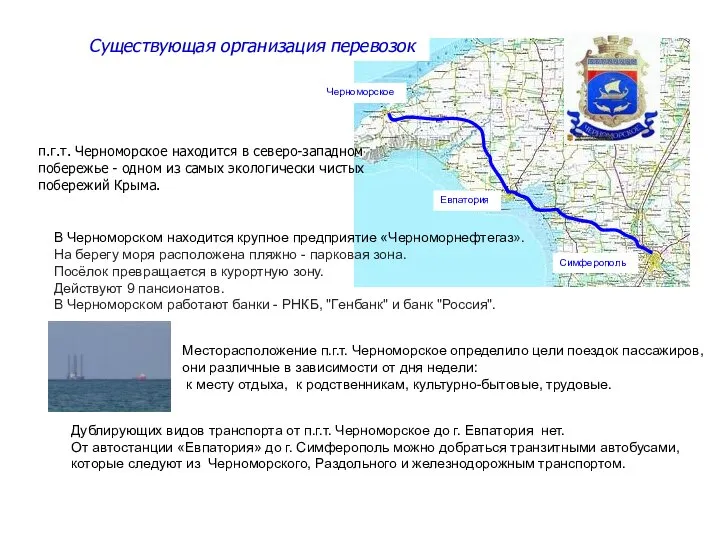 Существующая организация перевозок п.г.т. Черноморское
Существующая организация перевозок п.г.т. Черноморское Презентация на тему Разгром империи Наполеона. Венский конгресс (8 класс)
Презентация на тему Разгром империи Наполеона. Венский конгресс (8 класс) Классный час на тему:
Классный час на тему: Презентация на тему наклонения глагола
Презентация на тему наклонения глагола  404_A_N_D
404_A_N_D Сертификация СЭД на соответствие Закону «О персональных данных» Алексей Сидак, Центр безопасности информации Андрей Гриб, компан
Сертификация СЭД на соответствие Закону «О персональных данных» Алексей Сидак, Центр безопасности информации Андрей Гриб, компан Пейзаж
Пейзаж Анонимная сеть TOR
Анонимная сеть TOR Комплексный подход к работе с конверсией с помощью эконометрического моделирования
Комплексный подход к работе с конверсией с помощью эконометрического моделирования Хозяйство Руси и положение различных групп общества в XIV-XV вв
Хозяйство Руси и положение различных групп общества в XIV-XV вв Историческая школа в русской фольклористике
Историческая школа в русской фольклористике Осінні настрої
Осінні настрої Институт наук о Земле 2022
Институт наук о Земле 2022 Анализ финансового состояния в филиале ООО Авангард Цивильский бекон
Анализ финансового состояния в филиале ООО Авангард Цивильский бекон 9 класс МОУ «Сутчевская СОШ»
9 класс МОУ «Сутчевская СОШ» «СЕВЕРСТАЛЬ-УКРАИНА» — НАМ 5 ЛЕТ!
«СЕВЕРСТАЛЬ-УКРАИНА» — НАМ 5 ЛЕТ! Самоуправление
Самоуправление Презентация на классный час на тему_ Россия-страна возможностей_
Презентация на классный час на тему_ Россия-страна возможностей_ Электронный учебник Биография и педагогическое наследие Петра Францевича Лесгафта
Электронный учебник Биография и педагогическое наследие Петра Францевича Лесгафта Богатырский напиток, что силу и бодрость дает
Богатырский напиток, что силу и бодрость дает СХЕМА САЙТА
СХЕМА САЙТА Токарь
Токарь Герои, борцы, защитники. Изобразительное искусство
Герои, борцы, защитники. Изобразительное искусство Волшебный сундучок
Волшебный сундучок