Содержание
- 2. Что такое «фармацевтическая информация» 1. Общая характеристика ЛП Название лекарственного препарата (ЛП): 1. Брендовое (торговое) 2.
- 3. 2. Фармакологические свойства Фармакодинамика: 1. Фармакодинамические свойства ВСЕХ активных компонентов. 2. Механизм (первичная фармакологическая реакция) основного
- 4. 3. Показания к применению 1. Перечень КОНКРЕТНЫХ заболеваний, синдромов и симптомов по МКБ-Х 2. Возможность применения
- 5. 5. Побочное действие 1. ВСЕ возможные нежелательные явления и осложнения, которые можно прогнозировать на основании токсикологических
- 6. 8. Передозировка 1. Предполагаемые признаки острого и хронического отравления 2. Методы оказания помощи 3. Способы предупреждения
- 7. 11. Условия хранения 1. Указание на принадлежность к категориям - наркотические, психотропные, сильнодействующие, ядовитые – со
- 8. 14. Маркетинговая информация 1. Номера серий и их остаточный срок годности 2. Наличие препарата у дистрибьютеров
- 9. НАЗВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ 1. Химическое название - отражает состав и структуру ЛВ. (например: 5-этил-5-фенилбарбитуровая кислота) 2.
- 10. Классификации ЛС Алфавитные (на русском - от «А» до «Я» или иных языках) Химические (производные… +
- 11. Принципы отбора ЛП 1. Эффективные (Этио-патогенетические. А или В класс EBM. Поколение II и выше. Селективные/комбинации.
- 12. Достоверная фармацевтическая информация - основа системы безопасности лекарственных средств. При подготовке презентации были использованы материалы авторов
- 13. Современная фармакотерапия: высокоактивная («агрессивная», но много ОТС), обезличенная (официнальная, «перегрузка» MR), вариабельная (старение популяции, экофакторы), комбинированная
- 14. Масштаб проблем безопасности ЛС оценивается результатами фармако-эпидемиологических исследований: В США: 3,5-8,8 млн. пациентов ежегодно госпитализируется вследствие
- 15. Контроль безопасности ЛС – это выявление, анализ и предупреждение любых возможных проблем, связанных с ЛС (медицинских
- 16. Медицинские проблемы, связанные с ЛС. 1. Нежелательные побочные реакции (НПР). 2. Off-label (не по инструкции); и
- 17. Типы НПР (классификация ВОЗ)
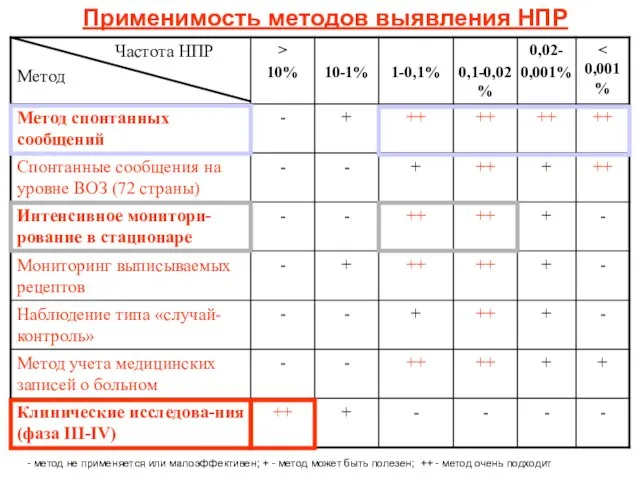
- 18. Применимость методов выявления НПР - метод не применяется или малоэффективен; + - метод может быть полезен;
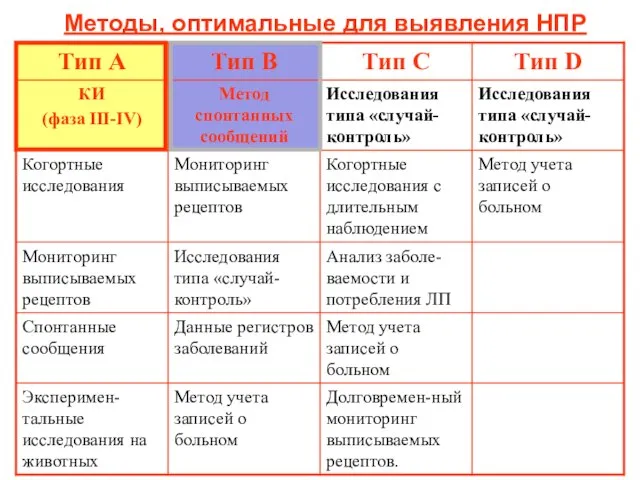
- 19. Методы, оптимальные для выявления НПР
- 20. Цель системы контроля безопасности – это снижение заболеваемости и смертности, вызываемых ЛС. Безопасность ЛП должна изучаться
- 21. Этапы исследования безопасности ЛС: ДКИ (вероятность предсказания переносимости человеком – 65-70%) КИ (выявляют риск НПР ⊇1%)
- 22. Для чего нужна фаза-4 ? В связи с тем, что ДКИ и КИ не позволяют выявить
- 23. Развитие систем контроля безопасности ЛС США: 1906 г. - Харли Вашингтон Вайли - “Бюро Химии” (с
- 24. Национальные центры контроля безопасности Включенные в структуру контрольно-разрешительных систем, регламентирующих обращение ЛС: США, Канада, Австралия, ФРГ,
- 25. Международное сотрудничество в области контроля безопасности ЛС 1962 г. (через 9 месяцев после выявления «талидомидовой эпидемии»)
- 26. Рекомендации по совершенствованию службы контроля безопасности ЛП Повышение уровня компетенции мед.и фарм.работников – введение в программы
- 27. Источники информации Официальные (инструкция на препарат) Прочие: Интернет (rlsnet.ru и др.) Справочники (РЛС, Видаль, Машковский и
- 28. Медицинские базы данных Реферативные БД MEDLINE - объем - 3800 журналов из 70 стран мира, 76%
- 29. Принципы информационного поиска в биомедицинских базах данных. Всякая база заключена в поисковую оболочку. Эти вещи надо
- 30. 3 метода поиска в биомедицинских базах данных. 1. «Сложение обломков». Суть - выделяем основные смысловые элементы,
- 31. Перечень значимых ресурсов. МEDLINE - http://www.ncbi.nlm.nih.gov/entrez/query.fcgi Клифар - http://www.drugreg.ru/Bases/WebReestrQuery.asp Информация о клинических исследованиях - http://www.clinicaltrials.gov/ Клинические
- 33. Скачать презентацию




























 Презентация на тему Республика Беларусь
Презентация на тему Республика Беларусь Народы мира Узбеки
Народы мира Узбеки Индивидуальный предприниматель - Не словом, а делом
Индивидуальный предприниматель - Не словом, а делом Анализ принципов организации трагического в пьесе В.Шекспира “Ричард III”
Анализ принципов организации трагического в пьесе В.Шекспира “Ричард III” Антипенкова Евгения Павловна, учитель истории, обществознания и кубановедения, МБОУ СОШ № 3 ст.Крыловской МО Крыловский район, К
Антипенкова Евгения Павловна, учитель истории, обществознания и кубановедения, МБОУ СОШ № 3 ст.Крыловской МО Крыловский район, К ОСНОВЫ УПРАВЛЕНИЯ КАЧЕСТВОМ
ОСНОВЫ УПРАВЛЕНИЯ КАЧЕСТВОМ От информационного общества к индустриальному
От информационного общества к индустриальному 12 апреля
12 апреля Нанотехнологии
Нанотехнологии Экономические потребности, блага и ресурсы. Экономический выбор
Экономические потребности, блага и ресурсы. Экономический выбор Храм Святой Софии в Константинополе
Храм Святой Софии в Константинополе птицы
птицы Эмоциональный интеллект. Развитие ребенка - развитие семьи
Эмоциональный интеллект. Развитие ребенка - развитие семьи БОЗ - Лекция №1. Вводная. Связь состава, строения и свойств строительных материалов
БОЗ - Лекция №1. Вводная. Связь состава, строения и свойств строительных материалов Иерархия потребностей. Управленческие приложения иерархии потребностей
Иерархия потребностей. Управленческие приложения иерархии потребностей ГИДРОИЗОЛЯЦИОННЫЕ СИСТЕМЫ
ГИДРОИЗОЛЯЦИОННЫЕ СИСТЕМЫ Тема_04
Тема_04 Планування особистой роботи менеджера
Планування особистой роботи менеджера Источники трудового права
Источники трудового права Упражнения для разминки
Упражнения для разминки Мероприятие “Поколение”
Мероприятие “Поколение” Сечение цилиндра плоскостью
Сечение цилиндра плоскостью Развитие универсальных учебных действий при обучении написанию сочинения- рассуждения
Развитие универсальных учебных действий при обучении написанию сочинения- рассуждения Примеры автоматных грамматик
Примеры автоматных грамматик 2009 г.
2009 г. Питомец под защитой. Кот и пес
Питомец под защитой. Кот и пес Першагина Татьяна Юрьевна
Першагина Татьяна Юрьевна Презентация на тему Физиология мышечного сокращения
Презентация на тему Физиология мышечного сокращения