Содержание
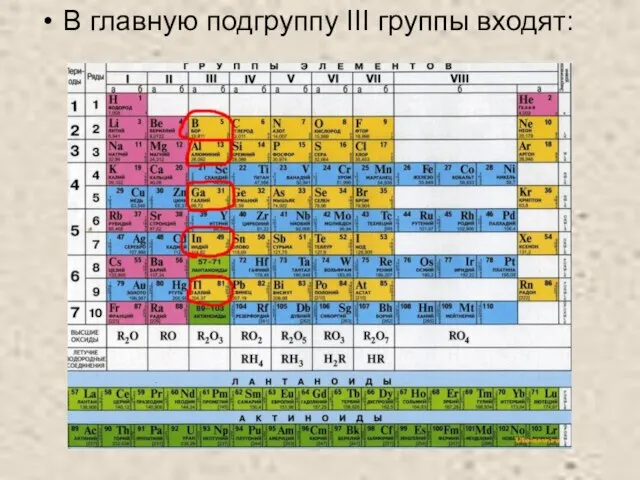
- 2. В главную подгруппу III группы входят:
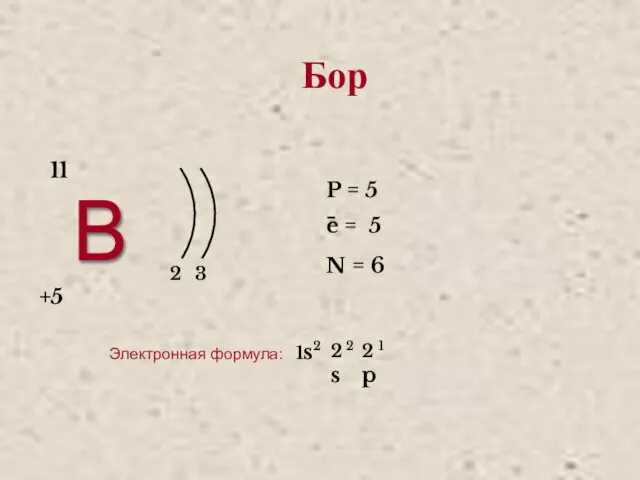
- 3. В 2 3 +5 11 P = 5 e = 5 N = 6 − Электронная
- 4. Алюминий Al 27 +13 0 2 8 3 P = 13 e = 13 N =
- 5. Галлий Ga +31 70 2 8 18 3 P = 31 e = 31 N =
- 6. Индий In 115 +49 8 18 3 18 2 P = 49 e = 49 N
- 7. Таллий − Tl 8 18 32 2 18 3 P = 81 e = 81 N
- 8. Общая характеристика На внешнем электронном уровне элементов главной подгруппы имеется по три электрона (s2р1). Они легко
- 9. Бор Бор (от лат. Borum). В свободном состоянии бор — бесцветное, серое или красное кристаллическое либо
- 10. Алюминий Алюми́ний (от лат. Aluminium)-лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Относится
- 11. Галлий. Га́ллий (от лат. Gallium) мягкий пластичный металл серебристо-белого цвета с синеватым оттенком. Относится к группе
- 12. Индий. И́ндий (от лат. Indium) ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета. Относится к группе лёгких
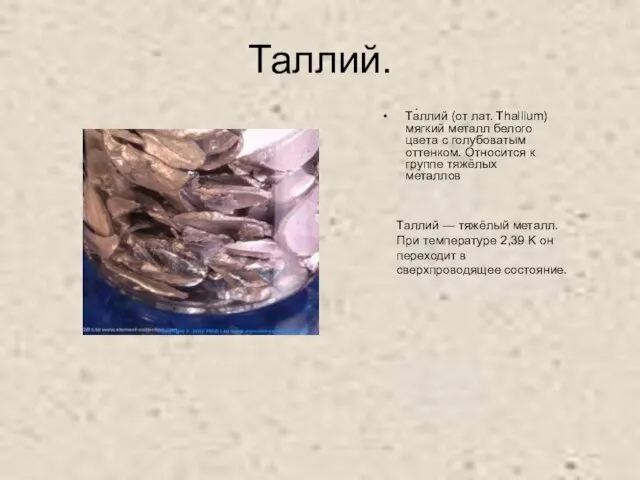
- 13. Таллий. Та́ллий (от лат. Thallium) мягкий металл белого цвета с голубоватым оттенком. Относится к группе тяжёлых
- 14. Применение. Бор
- 15. Применение Алюминий
- 16. Применение. Галлий
- 17. Применение. Индий
- 18. Применение. Таллий
- 19. Химические свойства Легко реагирует с простыми веществами: 1. С кислородом, образуя оксид алюминия: Al + O2
- 20. 2. С галогенами (кроме фтора), образуя хлорид, бромид или иодид алюминия: Al + Cl2 = Задание
- 21. с другими неметаллами реагирует при нагревании: с фтором, образуя фторид алюминия: Al + F2 = Задание
- 22. с серой, образуя сульфид алюминия: 2Al + S = Задание №4 Составьте уравнение реакции, расставьте коэффициенты
- 23. с азотом, образуя нитрид алюминия: 2Al + N = Задание №5 Составьте уравнение реакции, расставьте коэффициенты
- 24. с углеродом, образуя карбид алюминия: Al + 3С = Задание №6 Составьте уравнение реакции, расставьте коэффициенты
- 25. Со сложными веществами: с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи):
- 27. Скачать презентацию





















 История одной девушки……..
История одной девушки…….. Объект и его свойства
Объект и его свойства Потребительская корзина
Потребительская корзина Виды общения в психологии
Виды общения в психологии От кареты до ракеты
От кареты до ракеты Отчёт депутата госдумы Шишкоедова В.М, партия Единая Россия
Отчёт депутата госдумы Шишкоедова В.М, партия Единая Россия Эндокринологическая аллея. Остановка Исторический музей
Эндокринологическая аллея. Остановка Исторический музей Стоимость системы Пион до конца 2020 года. Умный транспорт. ООО Софтлайн
Стоимость системы Пион до конца 2020 года. Умный транспорт. ООО Софтлайн Muqayise olunan dillerde sual cumleleri
Muqayise olunan dillerde sual cumleleri 1401470
1401470 Ремёсла на Кубани
Ремёсла на Кубани Source:
Source: Уклад и общественное управление
Уклад и общественное управление Презентация на тему НОРВЕГИЯ
Презентация на тему НОРВЕГИЯ  ПРАВИЛА ДОРОЖНОГО ДВИЖЕНИЯИ СТАТИСТИКА ДОРОЖНО-ТРАНСПОРТНЫХ ПРОИСШЕСТВИЙ
ПРАВИЛА ДОРОЖНОГО ДВИЖЕНИЯИ СТАТИСТИКА ДОРОЖНО-ТРАНСПОРТНЫХ ПРОИСШЕСТВИЙ K-POP
K-POP Устройство персонального компьютера
Устройство персонального компьютера Презентация на тему Состав чисел первого десятка
Презентация на тему Состав чисел первого десятка Оптимизация распределительной деятельности
Оптимизация распределительной деятельности Постимпрессионизм
Постимпрессионизм Opime koos! Учимся вместе!
Opime koos! Учимся вместе! Вы блестящий учитель, у Вас прекрасные ученики!
Вы блестящий учитель, у Вас прекрасные ученики! Презентация на тему Путь к свободе через красоту
Презентация на тему Путь к свободе через красоту Предмет, метод, система и источники трудового права
Предмет, метод, система и источники трудового права Магистерская программа
Магистерская программа ОТЕЧЕСТВЕННАЯ ВОЙНА 1812г.
ОТЕЧЕСТВЕННАЯ ВОЙНА 1812г. Лекция 1. Мировое хозяйство: понятие и сущность. МРТ.
Лекция 1. Мировое хозяйство: понятие и сущность. МРТ. Рынок мощности
Рынок мощности