Содержание
- 2. Содержание 1. Химические и физические явления 2. Признаки протекания химических реакций 3. Условия протекания химических реакций
- 3. «Ах сколько нам открытий чудных готовит просвещенья дух» А.С.Пушкин Задачи : Повторить признаки и условия течения
- 4. Химические и физические явления Физические явления Химический состав молекул не меняется Кристаллизация Плавление Фильтрация Отстаивание Перегонка
- 5. Признаки протекания химической реакции Появление запаха Выделение осадка Выделение газа Изменение цвета Выделение тепла (экзотермическая реакция)
- 6. Проверь себя! В каком случае произошла химическая реакция? Почему вы так думаете? В крепко заваренный чай
- 7. Условия протекания химических реакций Чистота веществ (минимум примесей) Пропорциональность веществ по массе Пример:Ar (S)=32, Ar (Fe)
- 8. 3. Тщательное перемешивание 4. Применение катализатора Катализатор - Вещества, которые изменяют скорость химической реакции, оставаясь к
- 9. Михаил Васильевич Ломоносов 1711-1765 гг. Создатель многих химических производств в России (неорганических пигментов, глазурей, стекла, фарфора).
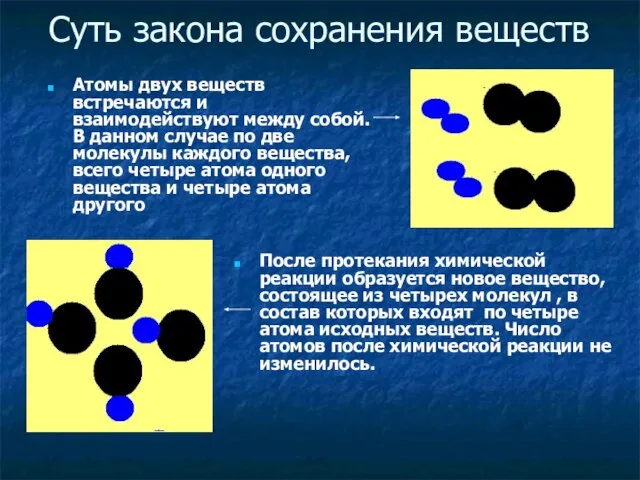
- 10. Суть закона сохранения веществ Атомы двух веществ встречаются и взаимодействуют между собой. В данном случае по
- 11. Проверь себя! Сколько атомов каждого элемента потребовалось для получения молекулы оксида алюминия и трех молекул сернистой
- 12. Для получения сульфида железа смешали 36 г серы и железо, в результате реакции получили 99 г
- 13. Химические уравнения Химическим уравнением называется условная запись химической реакции с помощью химических формул и математических знаков
- 14. Алгоритм составления химического уравнения В левой части уравнения записывают формулы веществ, вступивших в реакцию, соединяют их
- 15. Попробуйте свои силы Расставьте коэффициенты в уравнениях P+O2 P2O5 4P + 5O2 = 2P2O5 Al +
- 17. Скачать презентацию













 Наш кот
Наш кот Основные понятия теории информации
Основные понятия теории информации  Система правоотношений на транспорте
Система правоотношений на транспорте Тема 6. Социальные опасности и защита от них
Тема 6. Социальные опасности и защита от них Летняя кампания2011 года
Летняя кампания2011 года Баскетбо́л (англ. basket — корзина, ball — мяч)
Баскетбо́л (англ. basket — корзина, ball — мяч) Организация и проведение регионального этапа конкурса: разработка регионального плана мероприятий, формирование экспертной груп
Организация и проведение регионального этапа конкурса: разработка регионального плана мероприятий, формирование экспертной груп Светлые листья
Светлые листья Тренинг. Вводное занятие
Тренинг. Вводное занятие Операционные усилители
Операционные усилители Христианство и Ислам. История происхождения и основные характерные черты
Христианство и Ислам. История происхождения и основные характерные черты Лженаука в современном мире: медиасфера, высшее образование, школа
Лженаука в современном мире: медиасфера, высшее образование, школа Лыжная подготовка дошкольника
Лыжная подготовка дошкольника Электролиз
Электролиз Трихадеры в RAINBOW SIX
Трихадеры в RAINBOW SIX Одежда славян
Одежда славян Презентация на тему Как правильно переходить дорогу
Презентация на тему Как правильно переходить дорогу  Презентация на тему Антропогенез. Стадии антропогенеза
Презентация на тему Антропогенез. Стадии антропогенеза  Федеральный государственный образовательный стандарт
Федеральный государственный образовательный стандарт Старшая школа (2)
Старшая школа (2) Великие реформы 60-70 гг. XIX века
Великие реформы 60-70 гг. XIX века Опыт работы по теме:
Опыт работы по теме: Реализация музейно-образовательной программы Мы входим в мир прекрасного
Реализация музейно-образовательной программы Мы входим в мир прекрасного Россия в эпоху революций 1917 года и становления Советской власти
Россия в эпоху революций 1917 года и становления Советской власти ЛИТЕРАТУРА: В КАМНЕ И БРОНЗЕ
ЛИТЕРАТУРА: В КАМНЕ И БРОНЗЕ Раздельные пункты железных дорог. Раздел 6
Раздельные пункты железных дорог. Раздел 6 Характеристика видов рекламы
Характеристика видов рекламы Место риска в инвестировании капитала
Место риска в инвестировании капитала