Содержание
- 2. Индексы i, j относятся к электронам; a, b – к ядрам; M и m – массы
- 3. Разделить действия гамильтониана Ĥ на ядерную и электронную части точной Ψ(r,R) волновой функции нельзя. Это можно
- 4. ΨЭ({r,R}) – удовлетворяет уравнению: Ĥэ ΨЭ({r,R}) = EэΨЭ({r,R}), где ΨЯ({R}) – удовлетворяет уравнению:
- 5. Полная энергия молекул в приближении Борна Оппенгеймера есть: Е = ЕЭ + ТЯ, ТЯ – колебательно–вращательная
- 6. Полная энергия системы Хартри-Фока для молекулы: При учете приближения Борна-Оппенгеймера уравнения Хартри-Фока для молекулы можно решить
- 7. Приближение МО ЛКАО. Уравнения Рутана. Двигаясь по молекуле (состоящей из m атомов), каждый электрон попадает под
- 8. Другими словами - Теория метода Молекулярных Орбиталей исходит из предположения, что первоначально сближаются только ядра вместе
- 9. Обобщенное уравнение на собственные значения называется уравнением Рутана: F- матрица оператора Фока, S- матрица перекрытия для
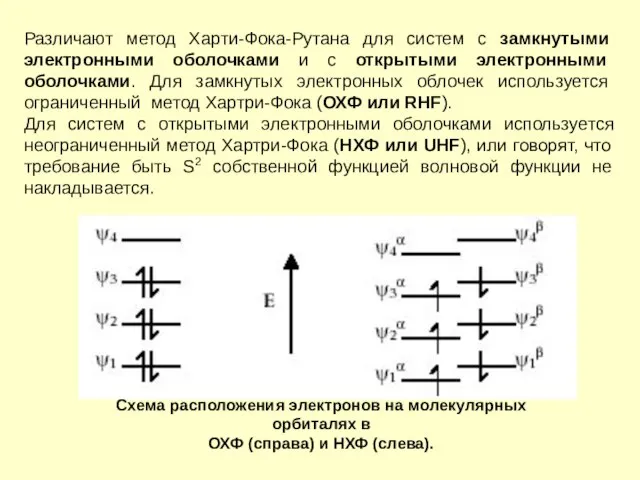
- 10. Различают метод Харти-Фока-Рутана для систем с замкнутыми электронными оболочками и с открытыми электронными оболочками. Для замкнутых
- 11. Однако из-за снятия указанного фундаментального ограничения на электронную волновую функцию, ее смысл в НХФ часто подвергается
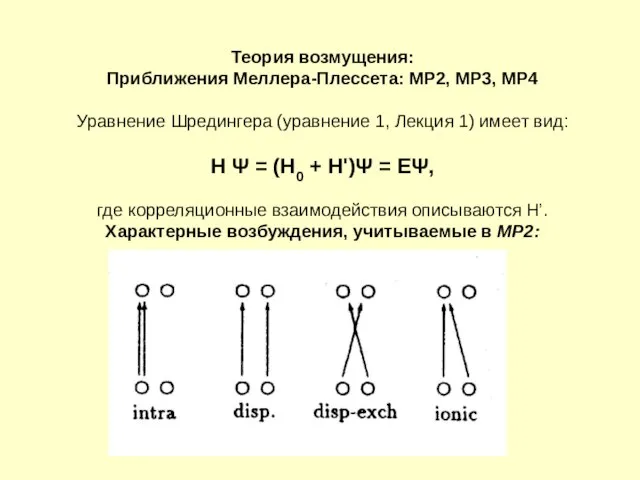
- 12. Теория возмущения: Приближения Меллера-Плессета: MP2, MP3, MP4 Уравнение Шредингера (уравнение 1, Лекция 1) имеет вид: Н
- 13. Конфигурационное взаимодействие Волновая функция (Ψкв) ищется вариационным методом в виде линейной комбинации молекулярных орбиталей Ψк, которые
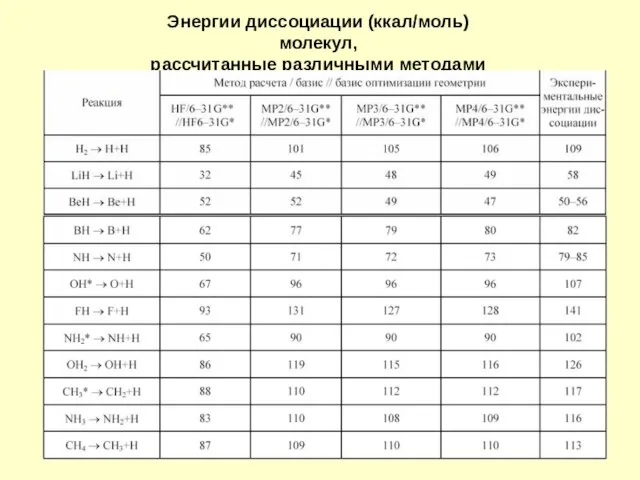
- 14. Энергии диссоциации (ккал/моль) молекул, рассчитанные различными методами
- 15. Канонические и локализованные молекулярные орбитали Молекулярные орбитали ϕi определяются как собственные функции некоторого одноэлектронного гамильтониана F
- 16. В качестве примера – молекула метана: CH4 ( точечная симметрия Td) Канонические МО: ϕ1 = a(2sC)
- 17. Указанные канонические МО можно преобразовать в локализованные МО : fi = c(hiC) + d(1sHi) + (a-c)(2sC)
- 18. Теория метода Молекулярных Орбиталей исходит из предположения, что первоначально сближаются только ядра вместе с внутренними оболочками.
- 19. Примеры: метод ВС метод ЛКАО МО e1 e2 атомы H A B Ψ1 = ΨA(e1) *
- 20. Метод ВС предполагает, что атомы в молекулах сохраняют во многом свою индивидуальность, а эффект химической связи
- 21. Какой метод лучше? Метод ВС дает более наглядное представление о химических связях Метод МО не требует
- 23. Скачать презентацию

















 Сказкотерапия в работе с детьми раннего возраста с нарушением слуха
Сказкотерапия в работе с детьми раннего возраста с нарушением слуха Мебель. Стул
Мебель. Стул Уроки «Введение в православную отечественную культуру» в начальной школе
Уроки «Введение в православную отечественную культуру» в начальной школе Экономические основы налогоообложения. Принципы и методы налогообложения
Экономические основы налогоообложения. Принципы и методы налогообложения Каналы рекламной коммуникации и средства рекламы
Каналы рекламной коммуникации и средства рекламы  Моя цветочная полянка
Моя цветочная полянка Презентация к уроку математики в 1 классе по УМК «Школа России»
Презентация к уроку математики в 1 классе по УМК «Школа России» Сущность и методологические основы управления организацией
Сущность и методологические основы управления организацией День Земли
День Земли СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО «
СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО « Школьный бизнес-стартап
Школьный бизнес-стартап Рынок ценных бумаг
Рынок ценных бумаг Презентация по английскому языку _Oscar Wilde_
Презентация по английскому языку _Oscar Wilde_ The 25 th of December is Christmas
The 25 th of December is Christmas Остановись, мгновение! (к истории возникновения и развития фотографии)
Остановись, мгновение! (к истории возникновения и развития фотографии) Веб-аналитика в 2011 году
Веб-аналитика в 2011 году Организационная структура вооруженных сил РФ
Организационная структура вооруженных сил РФ Плавание и его воздействие на развитие системы опорно-двигательного аппарата
Плавание и его воздействие на развитие системы опорно-двигательного аппарата Лечение и профилактика синдрома смежного уровня
Лечение и профилактика синдрома смежного уровня Строительный рынок в Росиии. Алексеев Дмитрий гр.ПИ-07
Строительный рынок в Росиии. Алексеев Дмитрий гр.ПИ-07 Основные положения Таможенного кодекса таможенного союзаТаможенная служба Республики КазахстанБрюссель, 25 января 2010 года
Основные положения Таможенного кодекса таможенного союзаТаможенная служба Республики КазахстанБрюссель, 25 января 2010 года Курс S60 days for result
Курс S60 days for result Половое размножение растений
Половое размножение растений Вредные привычки – нам не друзья
Вредные привычки – нам не друзья Presentation Title
Presentation Title  Практика работы на компьютере 3 класс
Практика работы на компьютере 3 класс Психологическая теория возникновения права
Психологическая теория возникновения права Электробалластер ЭЛБ-4
Электробалластер ЭЛБ-4