Содержание
- 2. опухоли
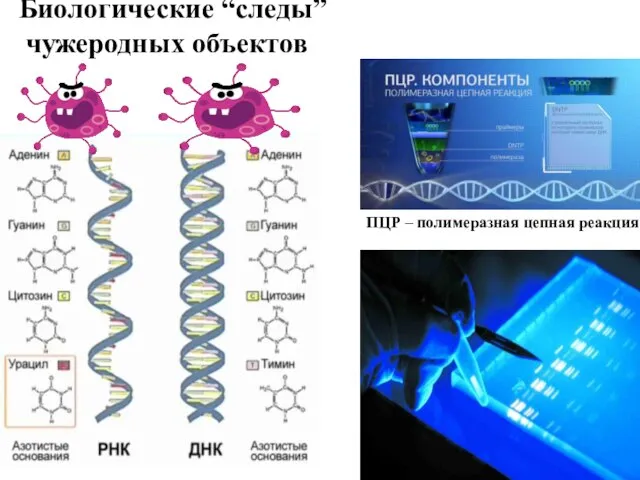
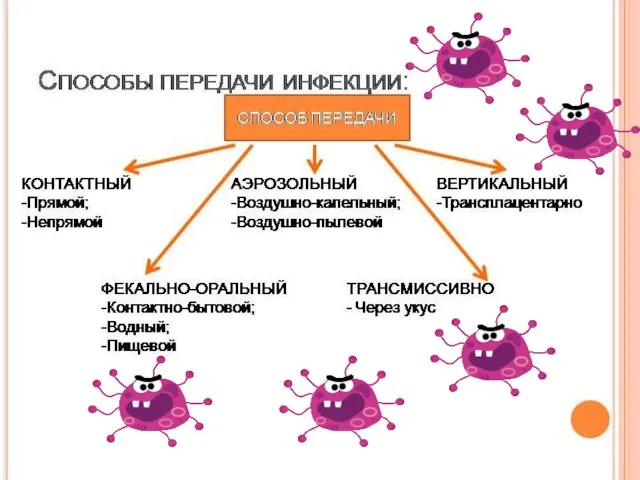
- 3. Биологические “следы” чужеродных объектов ПЦР – полимеразная цепная реакция
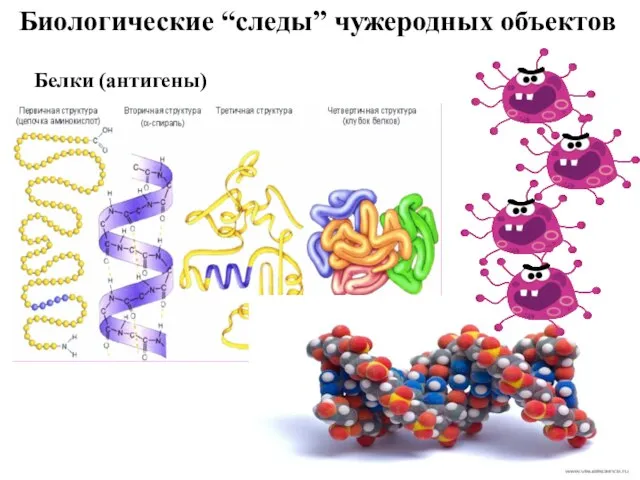
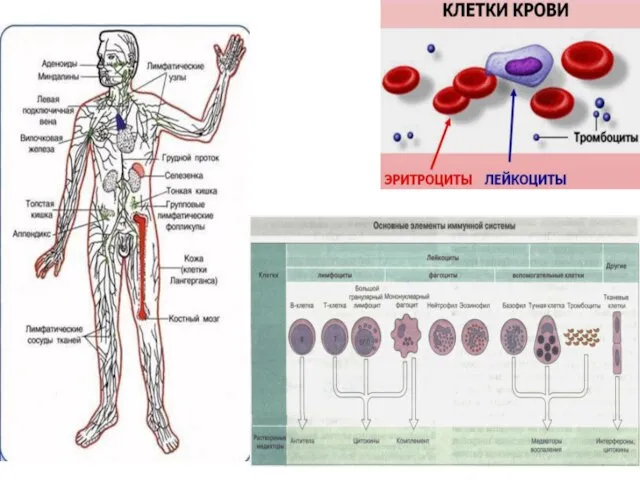
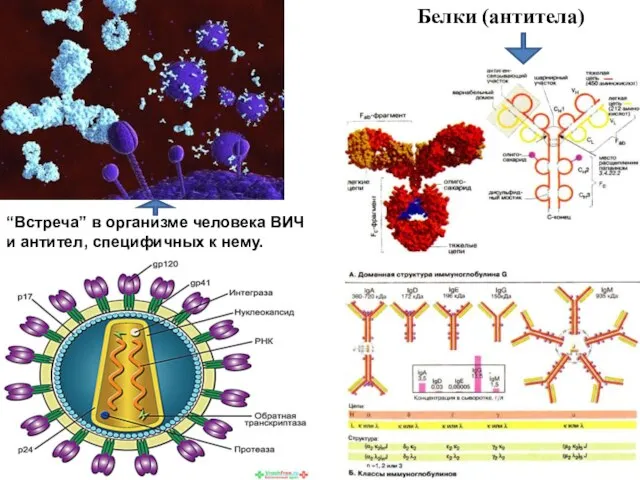
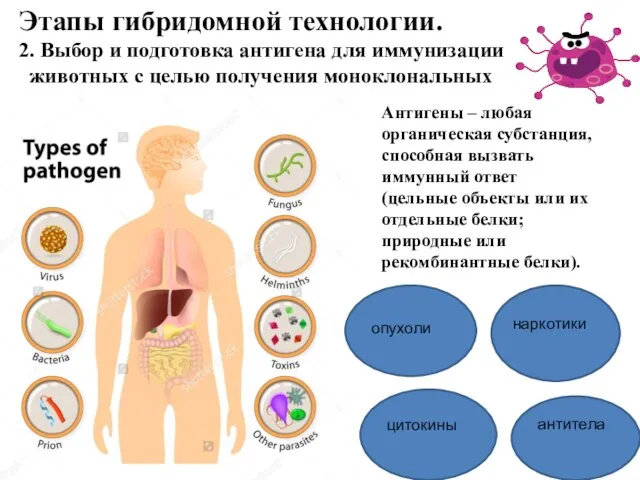
- 4. Биологические “следы” чужеродных объектов Белки (антигены)
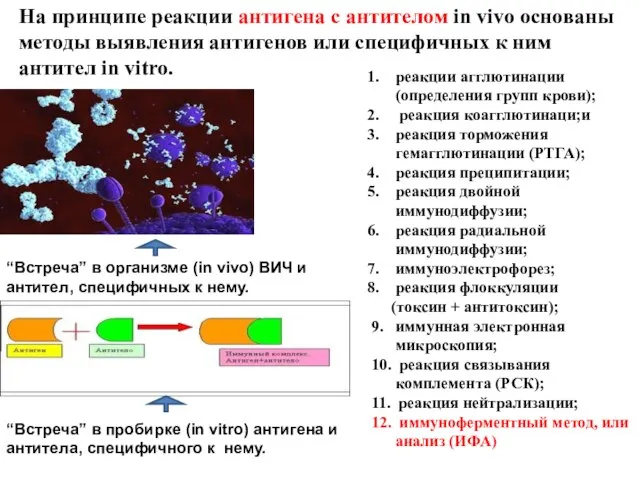
- 8. Белки (антитела) “Встреча” в организме человека ВИЧ и антител, специфичных к нему.
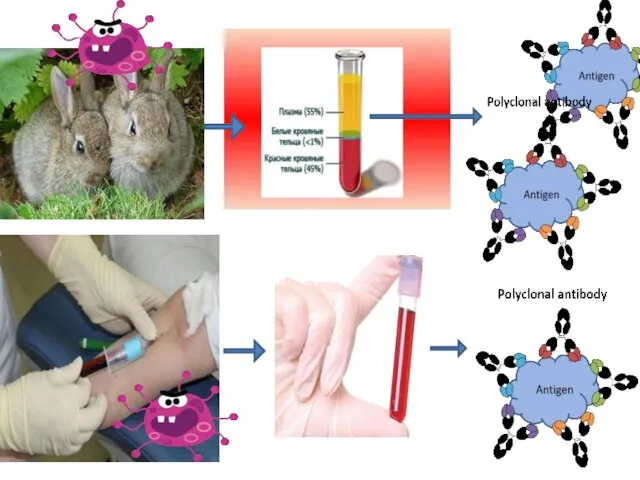
- 9. реакции агглютинации (определения групп крови); реакция коагглютинаци;и реакция торможения гемагглютинации (РТГА); реакция преципитации; реакция двойной иммунодиффузии;
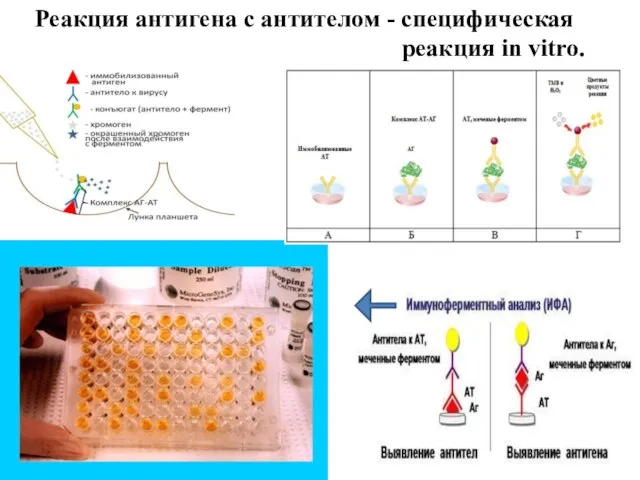
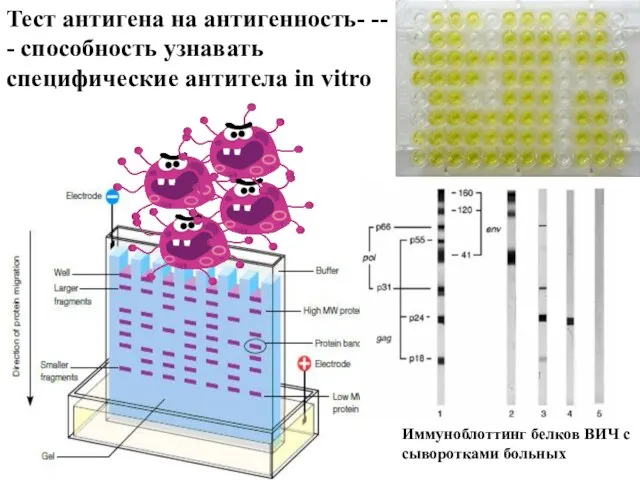
- 10. Реакция антигена с антителом - специфическая реакция in vitro.
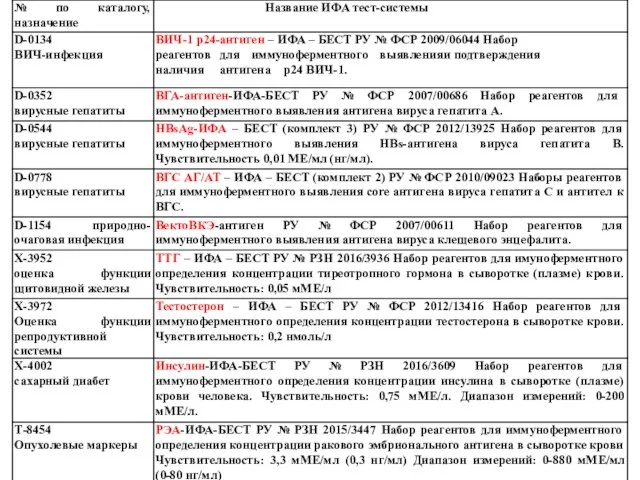
- 11. ИФА тест-системы производства ЗАО “Вектор-Бест”: ** - ИФА –тесты на выявление антител (IgG и IgM) и
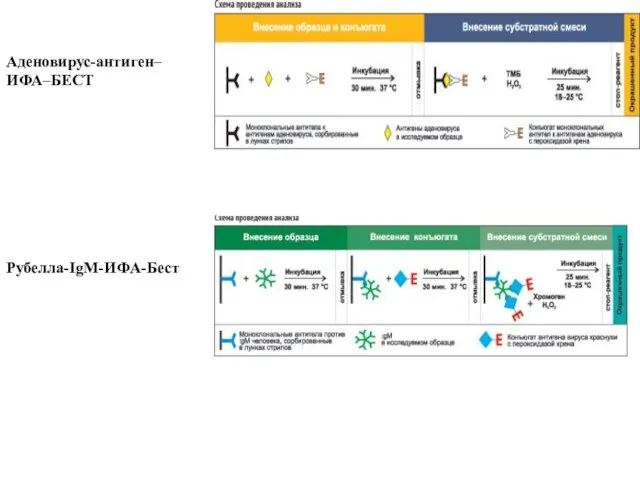
- 13. Аденовирус-антиген–ИФА–БЕСТ Рубелла-IgM-ИФА-Бест
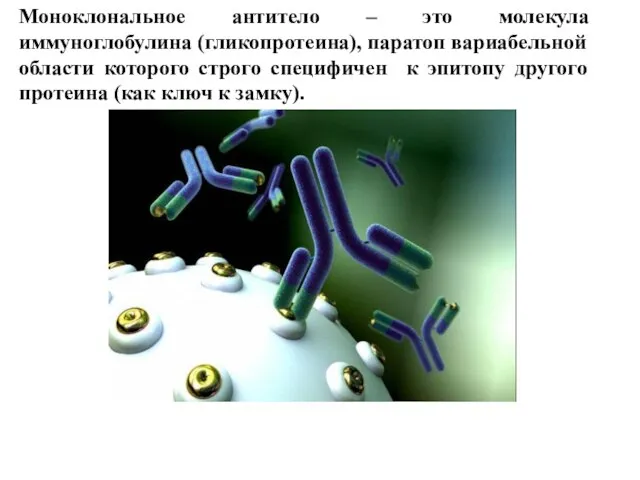
- 15. Моноклональное антитело – это молекула иммуноглобулина (гликопротеина), паратоп вариабельной области которого строго специфичен к эпитопу другого
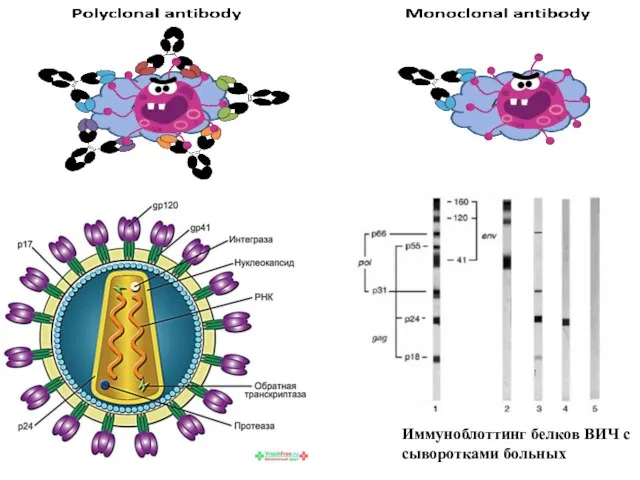
- 17. Иммуноблоттинг белков ВИЧ с сыворотками больных
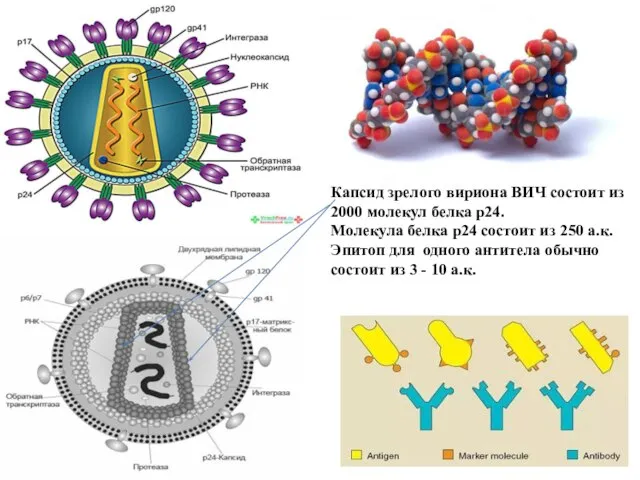
- 18. Капсид зрелого вириона ВИЧ состоит из 2000 молекул белка р24. Молекула белка р24 состоит из 250
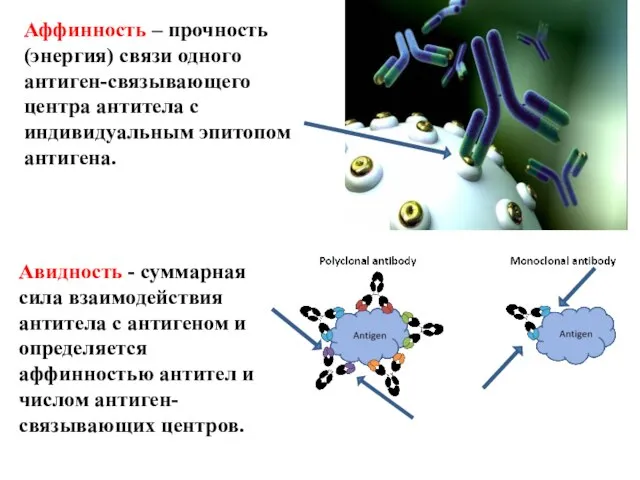
- 19. Аффинность – прочность (энергия) связи одного антиген-связывающего центра антитела с индивидуальным эпитопом антигена. Авидность - суммарная
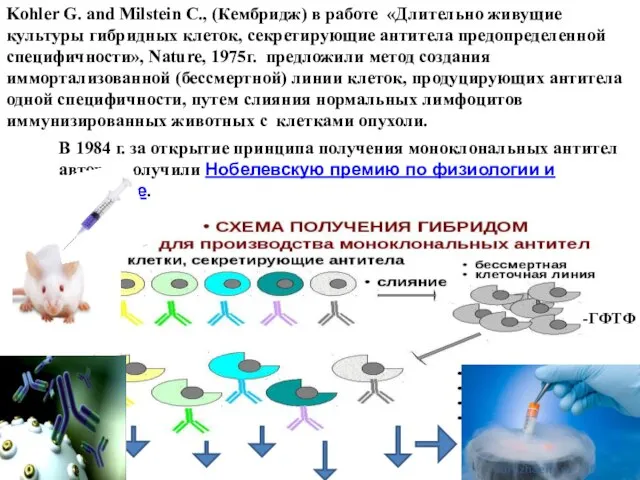
- 20. Kohler G. and Milstein C., (Кембридж) в работе «Длительно живущие культуры гибридных клеток, секретирующие антитела предопределенной
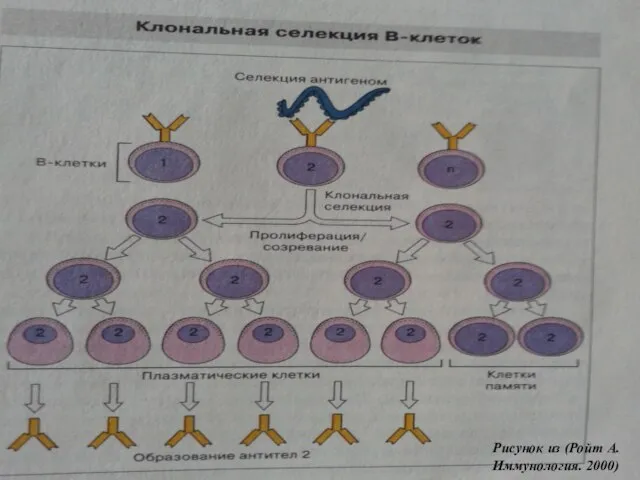
- 21. Рисунок из (Ройт А. Иммунология. 2000)
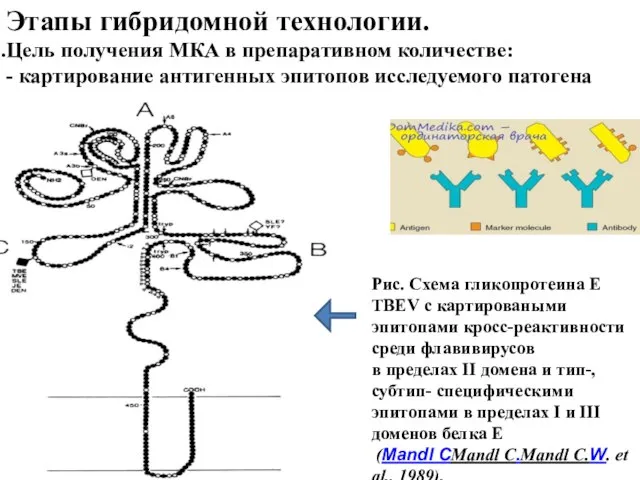
- 22. Этапы гибридомной технологии. Цель получения МКА в препаративном количестве: - картирование антигенных эпитопов исследуемого патогена Рис.
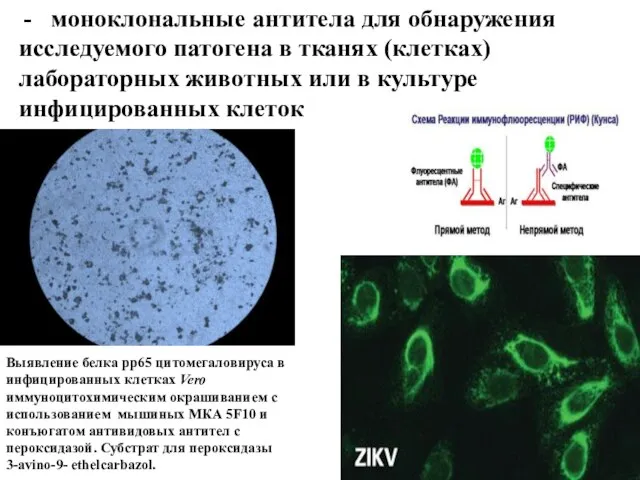
- 23. моноклональные антитела для обнаружения исследуемого патогена в тканях (клетках) лабораторных животных или в культуре инфицированных клеток
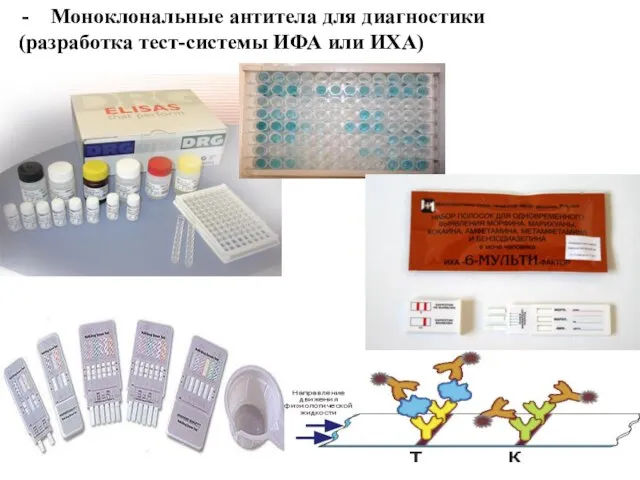
- 24. Моноклональные антитела для диагностики (разработка тест-системы ИФА или ИХА)
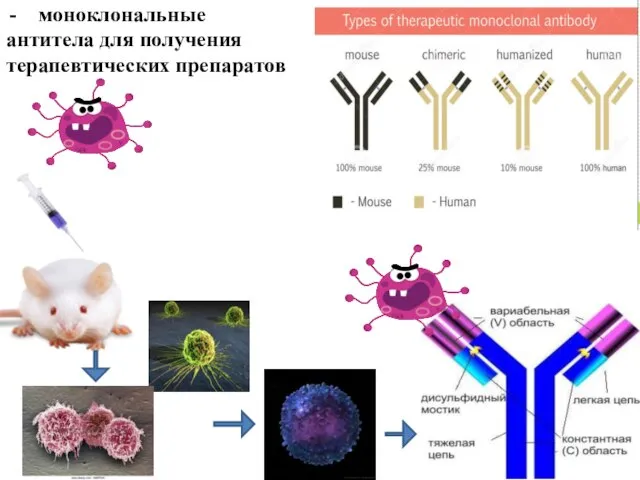
- 25. моноклональные антитела для получения терапевтических препаратов
- 26. Этапы гибридомной технологии. 2. Выбор и подготовка антигена для иммунизации животных с целью получения моноклональных антител.
- 27. Подготовка антигена для иммунизации
- 28. Иммуноблоттинг белков ВИЧ с сыворотками больных Тест антигена на антигенность- -- - способность узнавать специфические антитела
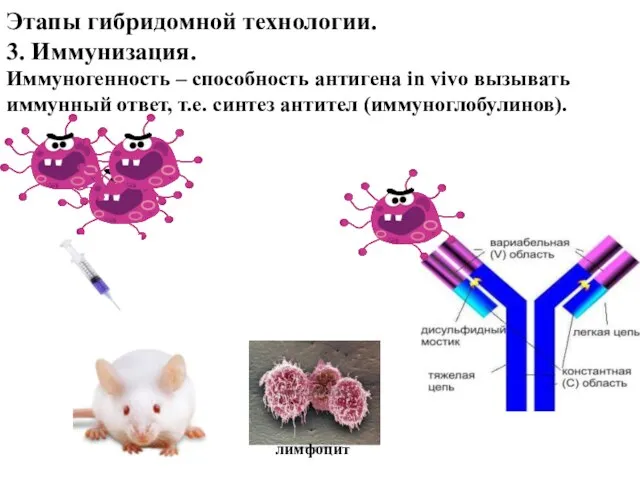
- 29. Этапы гибридомной технологии. 3. Иммунизация. Иммуногенность – способность антигена in vivo вызывать иммунный ответ, т.е. синтез
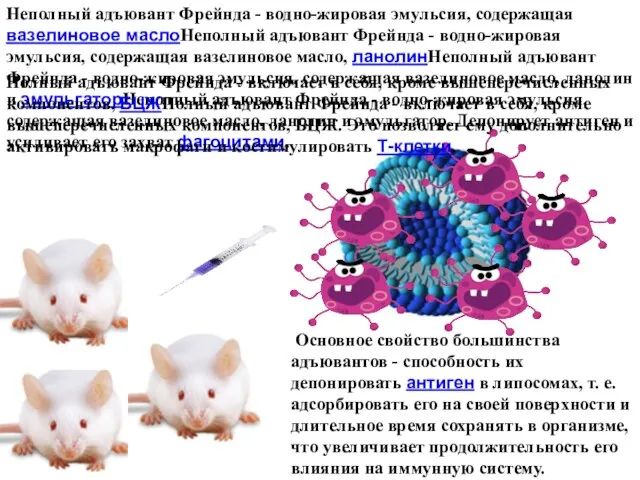
- 30. Основное свойство большинства адъювантов - способность их депонировать антиген в липосомах, т. е. адсорбировать его на
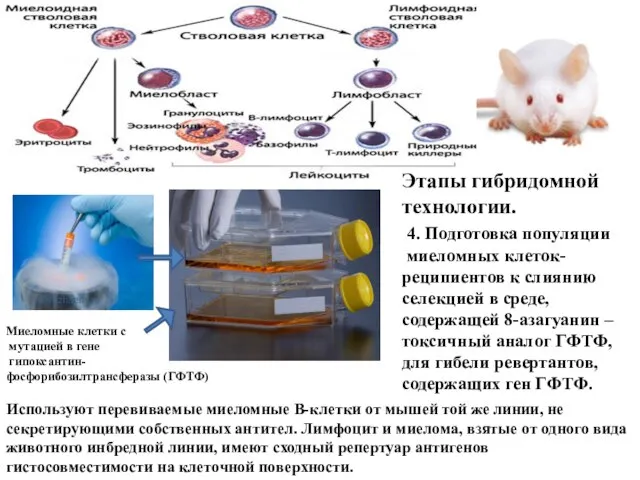
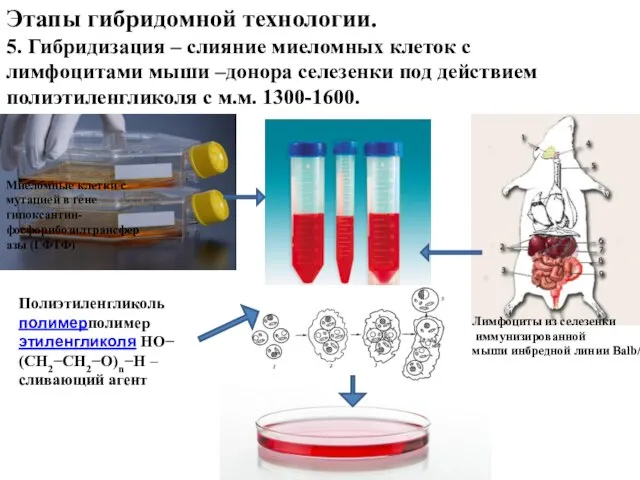
- 31. Миеломные клетки с мутацией в гене гипоксантин- фосфорибозилтрансферазы (ГФТФ) Этапы гибридомной технологии. 4. Подготовка популяции миеломных
- 32. Миеломные клетки с мутацией в гене гипоксантин-фосфорибозилтрансферазы (ГФТФ) Лимфоциты из селезенки иммунизированной мыши инбредной линии Balb/c
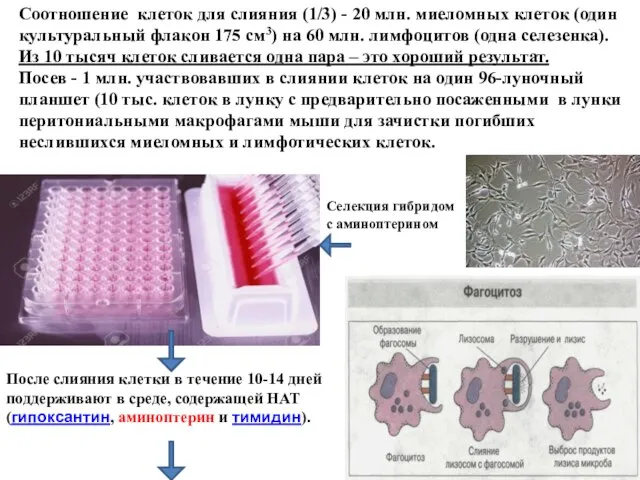
- 33. Соотношение клеток для слияния (1/3) - 20 млн. миеломных клеток (один культуральный флакон 175 см3) на
- 34. Этапы гибридомной технологии. 6. Клонирование слившихся клеток - - - посев одной гибридной клетки в одну
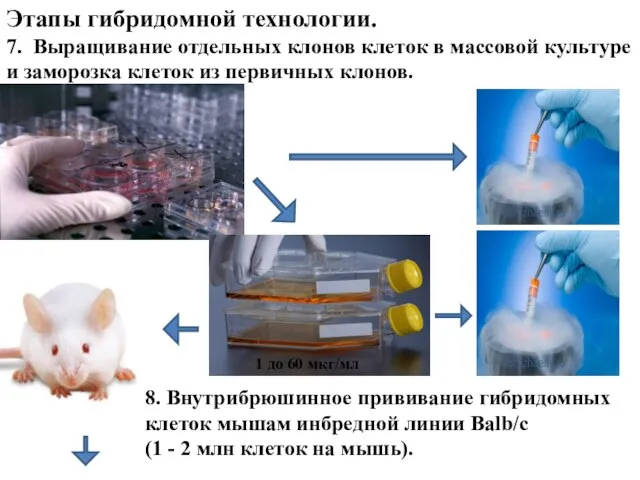
- 35. Этапы гибридомной технологии. 7. Выращивание отдельных клонов клеток в массовой культуре и заморозка клеток из первичных
- 36. Этапы гибридомной технологии. 9. Очистка моноклональных антител из асцитической жидкости мышей. Асцитная жидкость содержит гомогенные моноклональные
- 38. Стерильный бокс для работ по получению гибридных клеточных линий СО2-инкубатор 370С ламинар
- 39. Камера для электрофореза с источником тока Камера для переноса белков с геля на нитроцеллюлозную мембрану Автоматические
- 41. Планшетный анализатор для ИФА Световой микроскоп
- 42. Бокс биологической безопасности III класса “крокодил” для работы с особо опасными патогенами.
- 43. 2 часть. Моноклональные антитела как инструмент исследования антигенной структуры вирусов Марбург и Эбола (семейство Filoviridae -
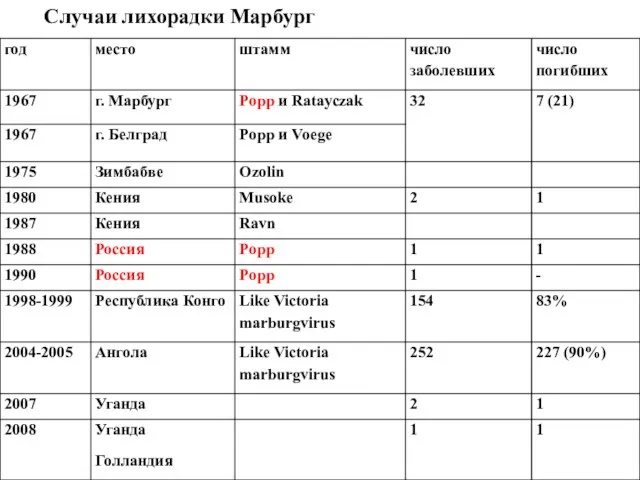
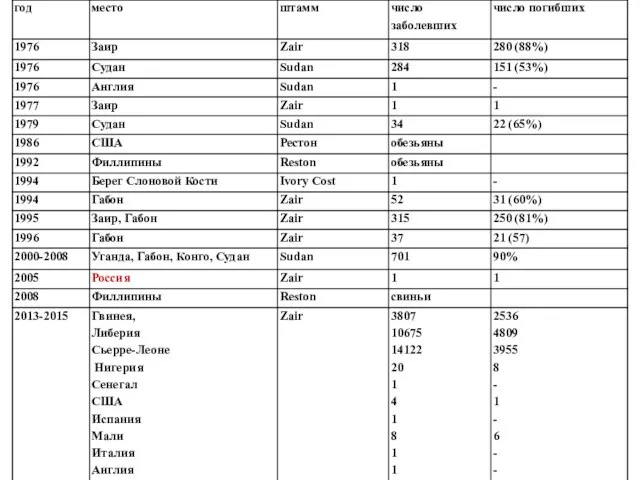
- 44. Случаи лихорадки Марбург
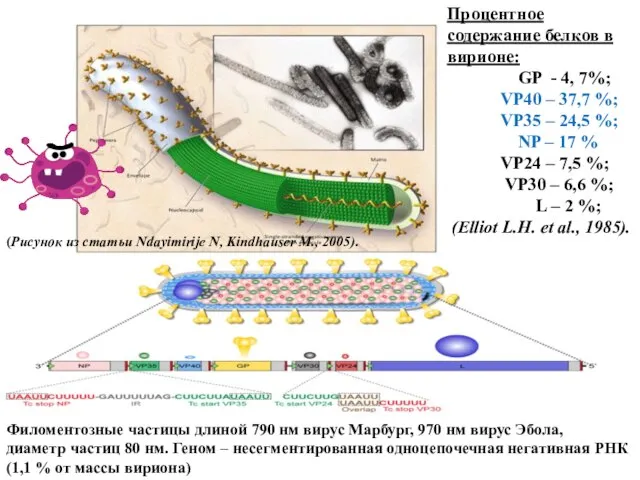
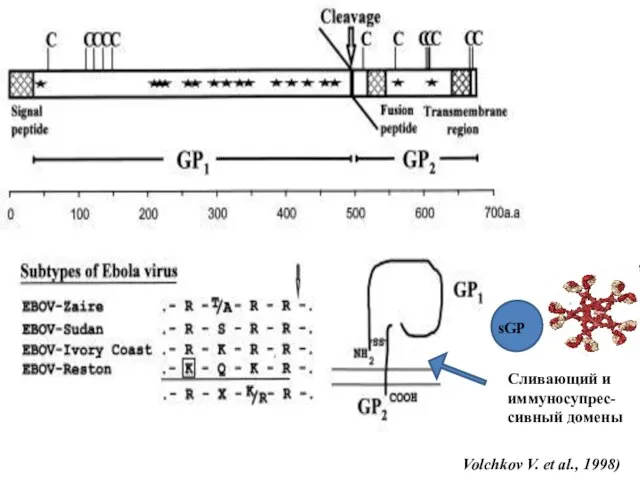
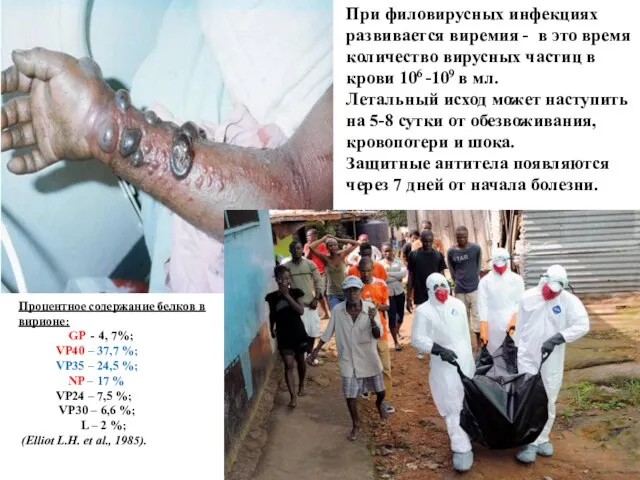
- 47. Процентное содержание белков в вирионе: GP - 4, 7%; VP40 – 37,7 %; VP35 – 24,5
- 48. Volchkov V. et al., 1998) Сливающий и иммуносупрес-сивный домены sGP
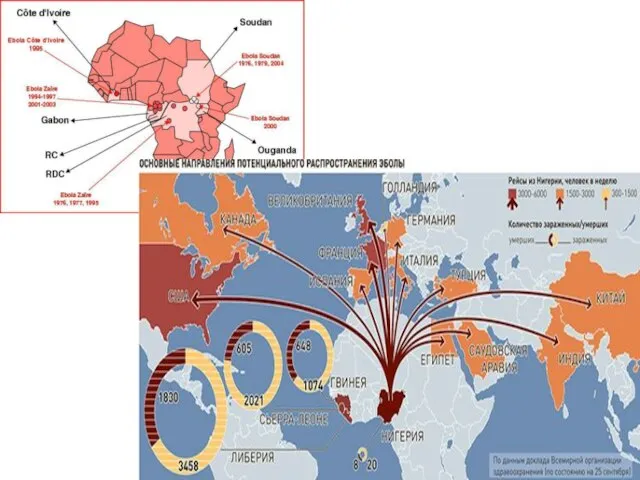
- 49. При филовирусных инфекциях развивается виремия - в это время количество вирусных частиц в крови 106 -109
- 50. Название: Эпидемия Оригинальное название: Outbreak Страна: США Год выпуска: 1995 Жанр: триллер, боевик Режиссер: Вольфганг Пeтерсен
- 51. Пущинский научный центр РАН. Серпуховской район Московской области ФБУН ГНЦ ВБ “Вектор” Наукоград Кольцово, Новосибирская область
- 52. Иммуноблоттинг. Выявление белков вируса Марбург (ВМ-3) антителами сыворотки крови реконвалесцента (1990 г.). 1 – нормальная сыворотка
- 53. Определение специфичности взаимодействия инактивированных антигенов вируса Марбург с сывороткой крови реконвалесцента. Концентрация антигенов 200 нг/лунка. Инактивация
- 54. Инактивация вируса Эбола: кипячение 2 мин в растворе, Содержащем 5 % меркаптоэтанола и 1% SDS, с
- 55. Иммуноблоттинг. Выявление белков вируса Марбург для перекрестного взаимодействия антител, специфичных к вирусу Эбола. 1, 2 –
- 56. Таблица 1. Исследование спектра белков-иммуногенов вируса Марбург Примечание: инакт. – инактивированный вирусный препарат; инф. – инфекционный
- 57. Таблица 2. Исследование спектра белков-иммуногенов вируса Эбола Примечание: инакт. – инактивированный вирусный препарат; инф. – инфекционный
- 58. Для наработки филовирусных антигенов необходим 4 уровень биозащиты, так как они относятся к I группе патогенности.
- 59. Схематическое изображение рекомбинантной плазмиды pQE30-VP40ВЭ Электрофореграмма: экспрессия гена VP40 вируса Эбола в клетках E.coli
- 60. Характеристики рекомбинантных белков вируса Марбург. Примечание: a рекомбинантные белки были очищены, используя Ni-NTA хроматографию (QIAGEN), разделены
- 61. Таблица 3. Использование рекомбинантных белков в качестве антигена в ТИФА для выявления IgG, специфичных к вирусу
- 62. Электрофореграмма очищенных вирусов Марбург, Эбола и рекомбинантных филовирусных белков 1. рекомбинантный белок VP35 вируса Марбург (5
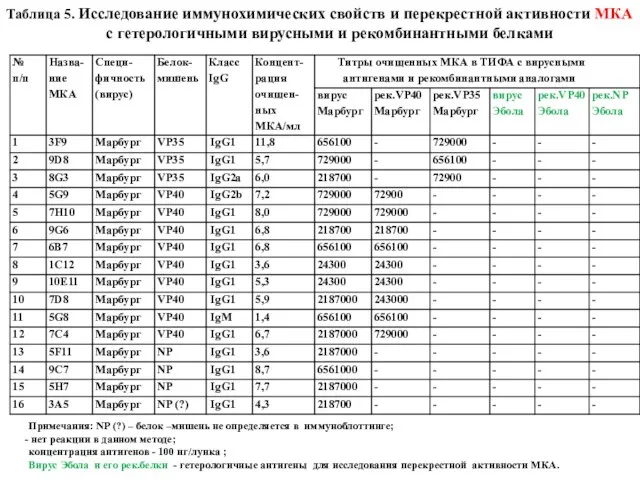
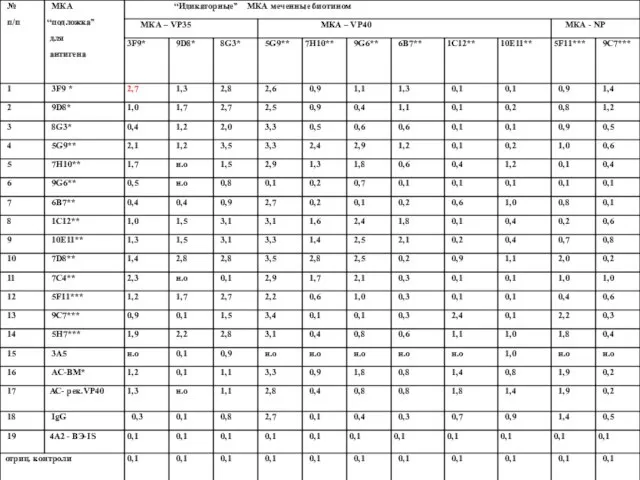
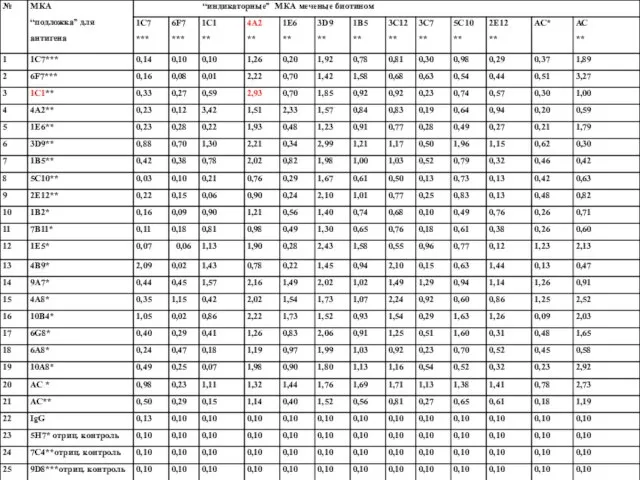
- 63. Таблица 5. Исследование иммунохимических свойств и перекрестной активности МКА с гетерологичными вирусными и рекомбинантными белками Примечания:
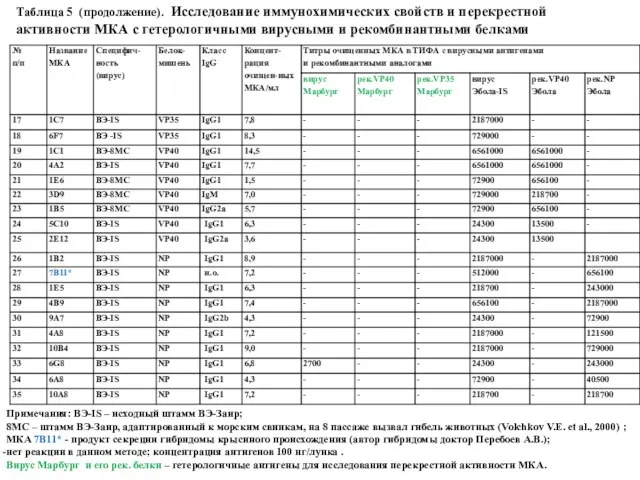
- 64. Таблица 5 (продолжение). Исследование иммунохимических свойств и перекрестной активности МКА с гетерологичными вирусными и рекомбинантными белками
- 65. Иммуноблоттинг нативных и рекомбинантных белков вирусов Марбург и Эбола с моноклональными антителами а. 1 2 3
- 66. c. 1 2 3 4 5 6 7 8 d. 1 2 3 4 5 6
- 67. Эпитопное картирование белков на основе результатов конкурентного ИФА и биологических свойств МКА с инфекционным вирусом Марбург
- 68. Схема получения фрагментов рекомбинантного белка VP35 вируса Марбург. Взаимодействие МКА с фрагментами рек.VP35 ВМ в иммуноблоте.
- 69. Электрофореграмма моноклональных антител, очищенных каприловой кислотой с последующим высаливанием сульфатом аммония по методу (Bazin H. et
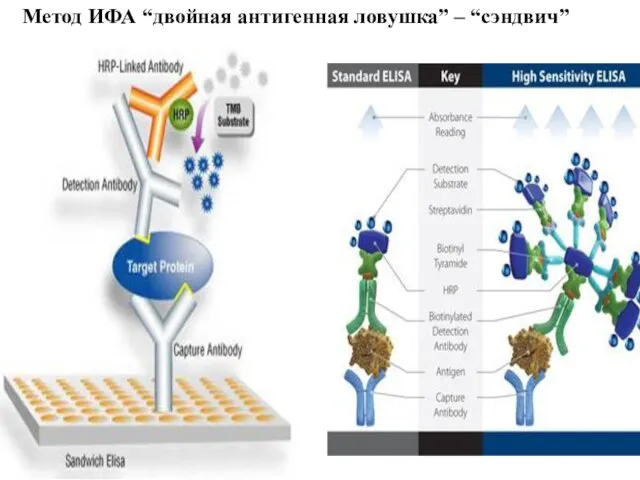
- 70. Метод ИФА “двойная антигенная ловушка” – “сэндвич”
- 71. Таблица 6. Данные по количеству пар МКА, исследованных в двухцентровом ИФА формата “сэндвич” для выявления антигенов
- 74. Титрование антигена вируса Марбург и рекомбинантного белка VP40 парой МКА 7D8 и 7H10* в двухцентровом ИФА
- 76. Титрование антигена вируса Марбург и рекомбинантного белка VP35 парой МКА 3F9 и 3F9* в двухцентровом ИФА
- 78. Титрование антигена вируса Эбола и рекомбинантного нуклеопротеина парой МКА 1B2 и 7B11* в двухцентровом ИФА “сэндвич”
- 80. Титрование антигена вируса Эбола и рекомбинантного белка VP40 парой МКА 4А2 и 1С1* в двухцентровом ИФА
- 82. Пара МКА, специфичных к белку VP40 вируса Эбола, “захватывает” вирусный антиген
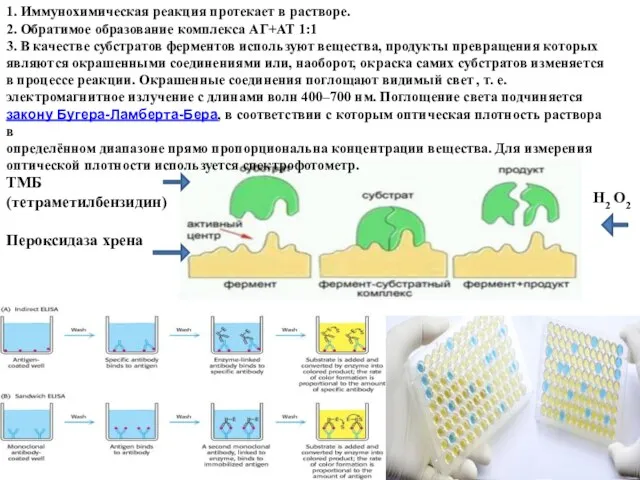
- 87. 1. Иммунохимическая реакция протекает в растворе. 2. Обратимое образование комплекса АГ+АТ 1:1 3. В качестве субстратов
- 89. Скачать презентацию























 РАЗВИТИЕУНИВЕРСАЛЬНЫХ УЧЕБНЫХ ДЕЙСТВИЙ В СТАНДАРАХ ВТОРОГО ПОКОЛЕНИЯ
РАЗВИТИЕУНИВЕРСАЛЬНЫХ УЧЕБНЫХ ДЕЙСТВИЙ В СТАНДАРАХ ВТОРОГО ПОКОЛЕНИЯ Испарение. Поглощение энергии при испарении жидкости и выделение ее при конденсации пара
Испарение. Поглощение энергии при испарении жидкости и выделение ее при конденсации пара ЧЕЛОВЕК И МИР ЛЮДЕЙ
ЧЕЛОВЕК И МИР ЛЮДЕЙ Общие и отличительные свойства ОБЪЕКТА
Общие и отличительные свойства ОБЪЕКТА Презентация на тему Наши домашние питомцы
Презентация на тему Наши домашние питомцы  Пищевая промышленность Хабаровского края и города Комсомольска-на-Амуре
Пищевая промышленность Хабаровского края и города Комсомольска-на-Амуре Аяулы жас келін
Аяулы жас келін Математический КВН«Мы пока не Архимеды…»
Математический КВН«Мы пока не Архимеды…» Создание безопасного пешеходного маршрута города Микунь
Создание безопасного пешеходного маршрута города Микунь Баскетбол
Баскетбол Исторический обзор садово-паркового искусства
Исторический обзор садово-паркового искусства Золотая пропорция в архитектуре г.Лангепас
Золотая пропорция в архитектуре г.Лангепас Информация об объекте. Краснодарский край, г. Краснодар, ул. Красная, д. 52
Информация об объекте. Краснодарский край, г. Краснодар, ул. Красная, д. 52 Презентация по обществознанию на тему: Современное искусство
Презентация по обществознанию на тему: Современное искусство Алгоритмы
Алгоритмы Старт карьеры-2009
Старт карьеры-2009 Презентация на тему Уинстон Леонард Спенсер Черчилль Английский государственный деятель
Презентация на тему Уинстон Леонард Спенсер Черчилль Английский государственный деятель гоу детский сад комбинированного вида № 1565ЗОУО ДО г. МосквыЗаведующая Тищенко Т. Р.
гоу детский сад комбинированного вида № 1565ЗОУО ДО г. МосквыЗаведующая Тищенко Т. Р. ?
? Конфликты в деловом общении
Конфликты в деловом общении Рисование карманов, кокеток, складок различной формы
Рисование карманов, кокеток, складок различной формы Краснов
Краснов Новое в системе обязательного медицинского страхования как часть реформы здравоохранения в России
Новое в системе обязательного медицинского страхования как часть реформы здравоохранения в России Яблочный пирог
Яблочный пирог БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТФАКУЛЬТЕТ МЕЖДУНАРОДНЫХ ОТНОШЕНИЙ
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТФАКУЛЬТЕТ МЕЖДУНАРОДНЫХ ОТНОШЕНИЙ Основы Конституционного строя РФ
Основы Конституционного строя РФ Эффективность продукта
Эффективность продукта Мохнатая азбука
Мохнатая азбука