Содержание
- 2. Изменение цвета различных индикаторов при действии растворов кислот и щелочей
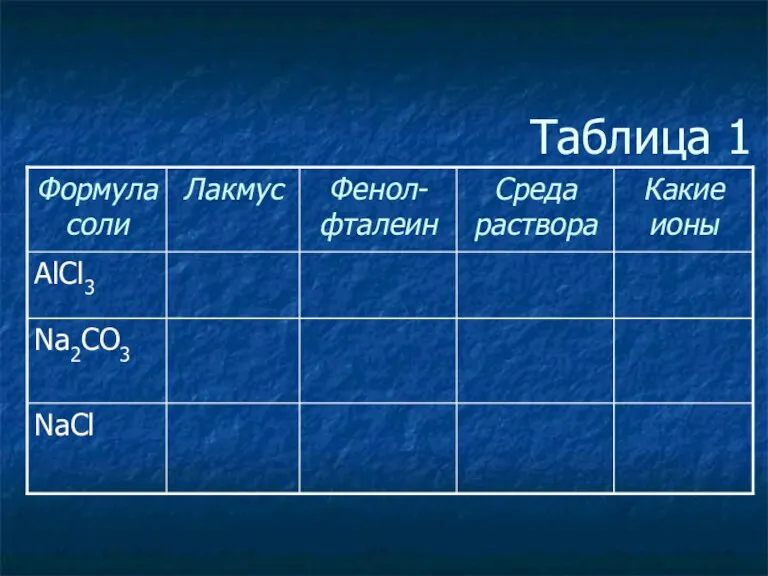
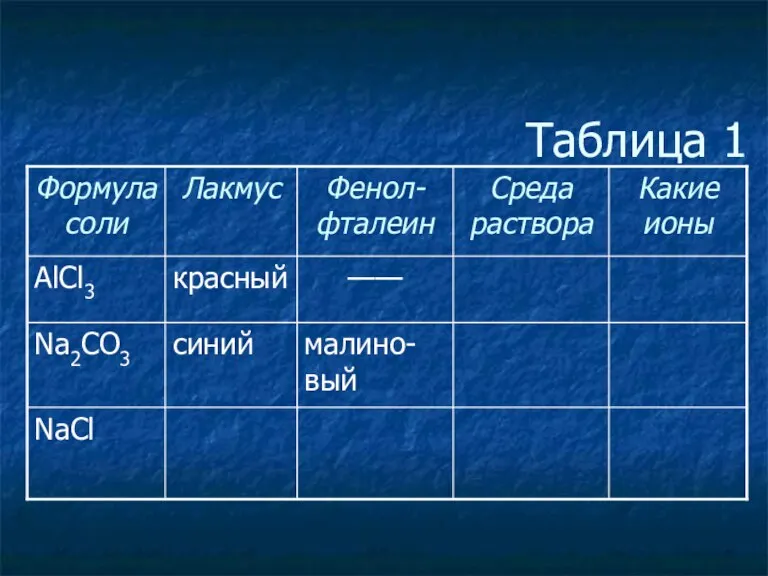
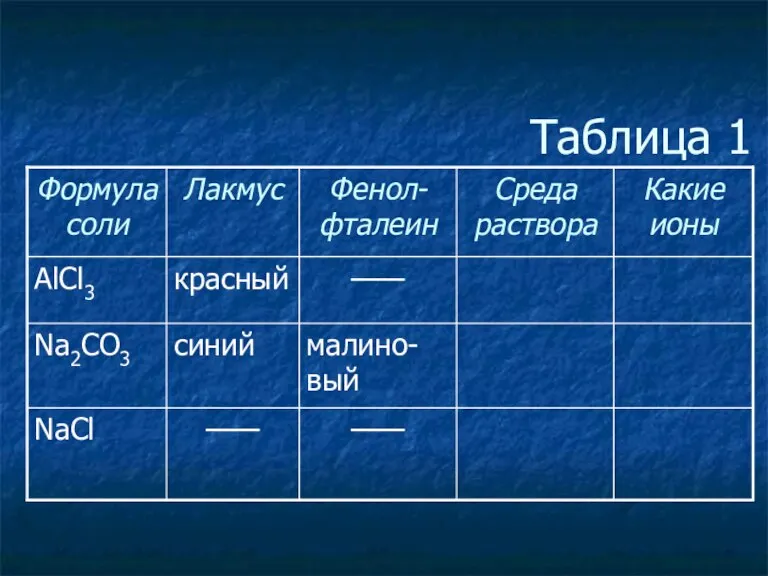
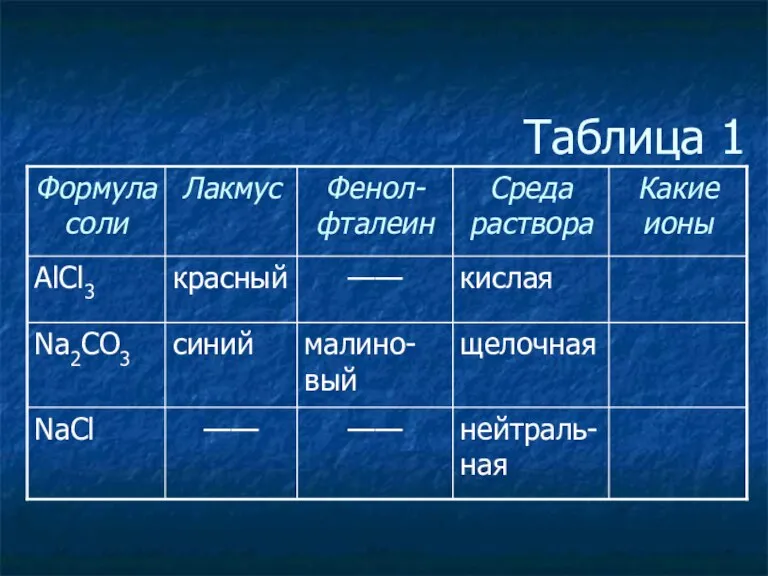
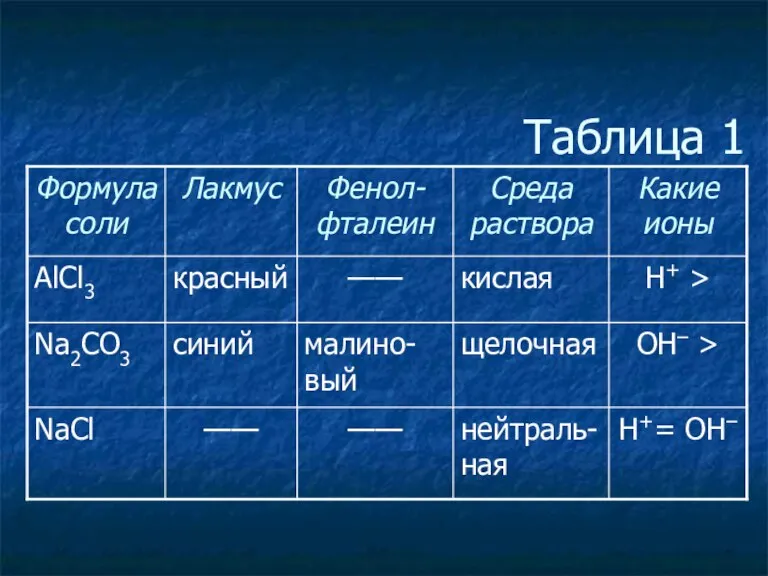
- 3. Таблица 1
- 4. Таблица 1
- 5. Таблица 1
- 6. Таблица 1
- 7. Таблица 1
- 8. Таблица 1
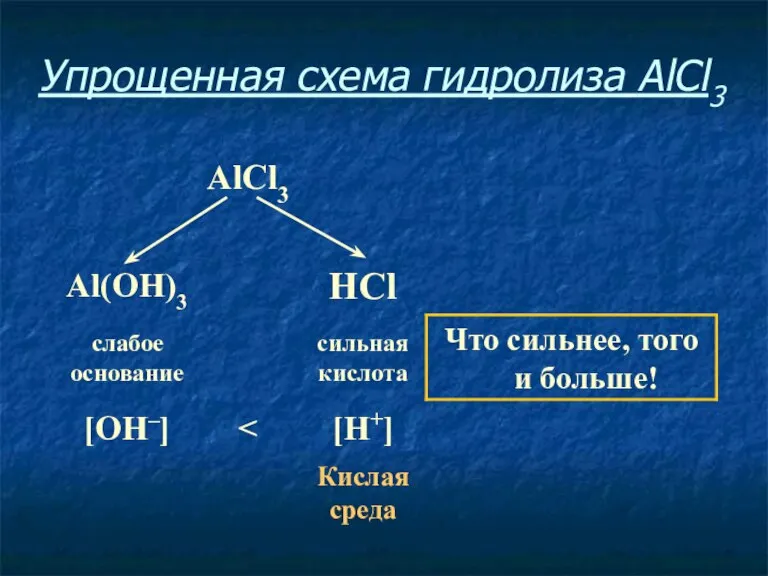
- 9. Упрощенная схема гидролиза AlCl3
- 10. Соль, образованная слабым основанием и сильной кислотой, имеет кислую среду, так как в растворе избыток ионов
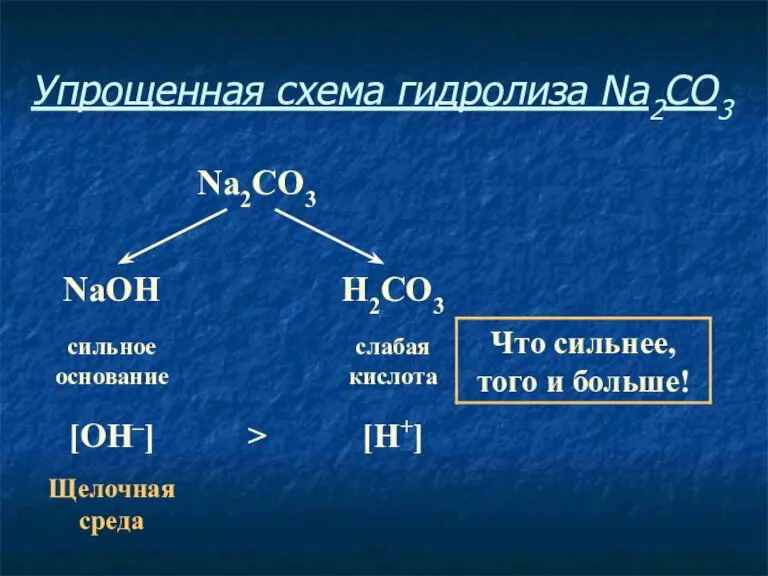
- 11. Упрощенная схема гидролиза Na2CO3
- 12. Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
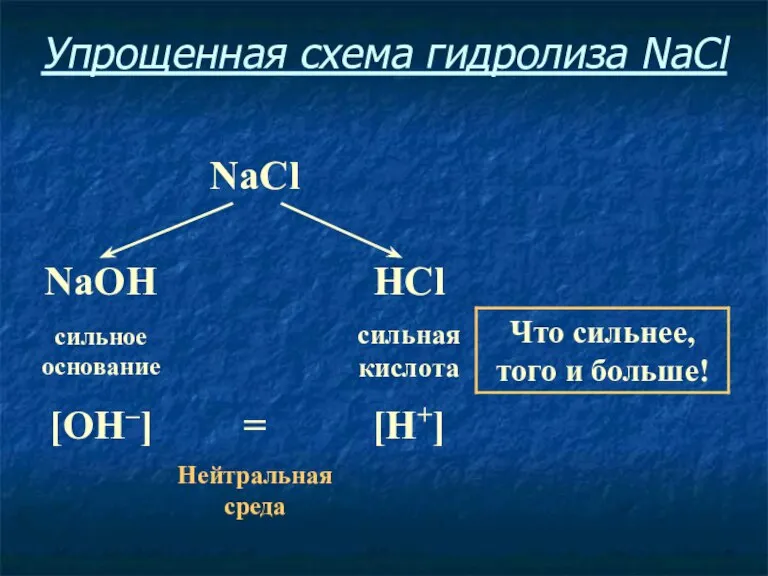
- 13. Упрощенная схема гидролиза NaCl
- 14. Соль, образованная сильным основанием и сильной кислотой, имеет нейтральную среду, так как в растворе одинаковое количество
- 15. Гидролиз — это реакция обмена между некоторыми солями и водой («гидро» — вода, «лизис» — разложение)
- 16. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl–
- 17. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН–
- 18. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________
- 19. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ +
- 20. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ +
- 21. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– ___________________________________________________________________ Al3+ +
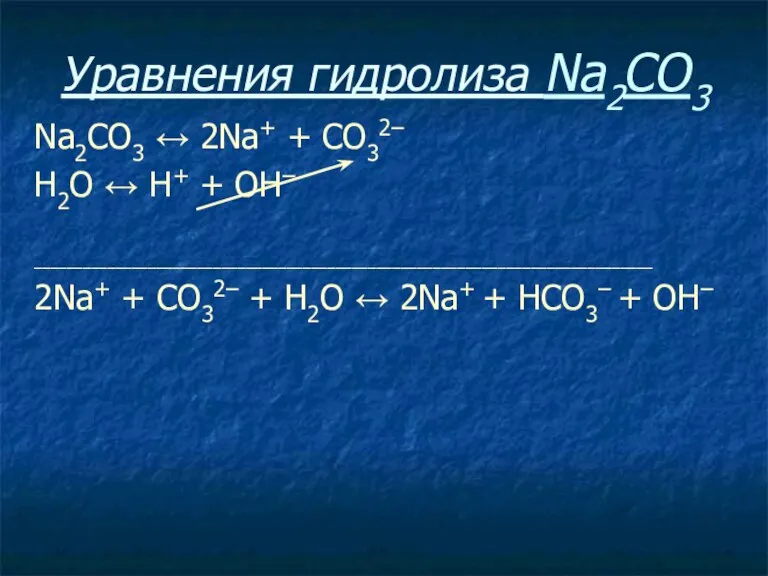
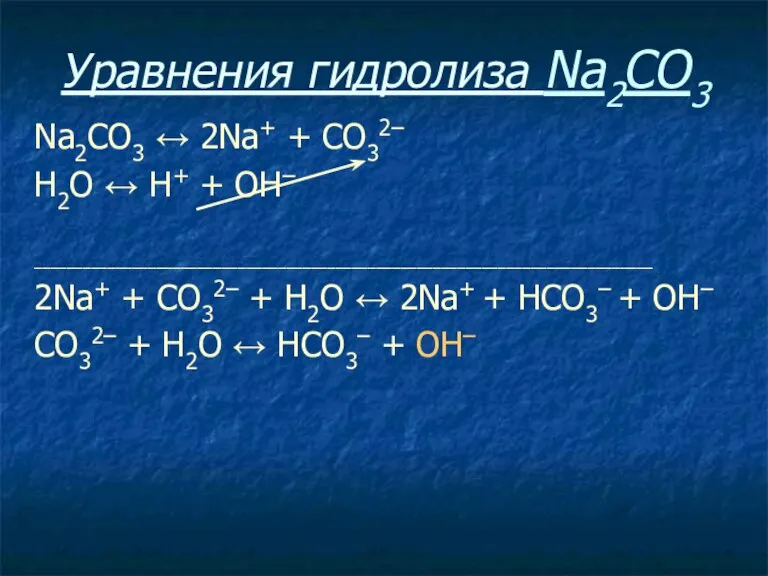
- 22. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32–
- 23. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН–
- 24. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________
- 25. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ +
- 26. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ +
- 27. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ +
- 28. Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ +
- 29. Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант а) нитрата цинка (II)
- 30. Ответы
- 31. Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+ + 2NO3– +
- 32. K2SO4 ↔ 2K+ + SO42– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2K+ + SO42– +
- 33. Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + S2– +
- 34. О значении и применении гидролиза... Под действием биологических катализаторов — ферментов в организме человека происходит гидролиз
- 35. Домашнее задание. Пользуясь таблицей «Сильные и слабые электролиты», приведите свои примеры солей, которые будут иметь кислую,
- 36. Урок окончен
- 38. Скачать презентацию

























 Tesla
Tesla Оригами новогодняя ёлка
Оригами новогодняя ёлка Презентация на тему Решение задач по теме Колебания и волны
Презентация на тему Решение задач по теме Колебания и волны  Budowa roślin
Budowa roślin Презентация на тему Россия при Петре I
Презентация на тему Россия при Петре I  Пакетные предложения. Разработан для хоккея спроектирован для детей. Окно №2
Пакетные предложения. Разработан для хоккея спроектирован для детей. Окно №2 Презентация на тему Как сочинить волшебную сказку
Презентация на тему Как сочинить волшебную сказку  Развитие магистральных сетей: задачи энергостроительного комплекса
Развитие магистральных сетей: задачи энергостроительного комплекса Решение задач. Идеальный газ
Решение задач. Идеальный газ Непривычная динамика ценна рынке жилья:впервые за 20 летАналитический центр w w w . I R N . r u Март 2011 г.
Непривычная динамика ценна рынке жилья:впервые за 20 летАналитический центр w w w . I R N . r u Март 2011 г. o Центр корпоративного обучения « Оксфорд Класс » создан в 2007 г. в партнерстве с языковой школой Оксфорд Класс, г. Киев,Украина, год о
o Центр корпоративного обучения « Оксфорд Класс » создан в 2007 г. в партнерстве с языковой школой Оксфорд Класс, г. Киев,Украина, год о Скульптура АНТИЧНОСТИ
Скульптура АНТИЧНОСТИ Сервировка сладкого стола. Праздничный этикет
Сервировка сладкого стола. Праздничный этикет Чтобы зубы были здоровыми
Чтобы зубы были здоровыми Тема занятия: «Учет кассовых операций»
Тема занятия: «Учет кассовых операций» Требования к современному уроку
Требования к современному уроку Научно-методическое обеспечение деятельности школьных библиотекарей
Научно-методическое обеспечение деятельности школьных библиотекарей Муниципальное бюджетное общеобразовательное учреждение гимназия № 52 Октябрьского района города Росто
Муниципальное бюджетное общеобразовательное учреждение гимназия № 52 Октябрьского района города Росто России первая любовь
России первая любовь Графические интерфейсыпакет Tkinter
Графические интерфейсыпакет Tkinter Презентация на тему Мир
Презентация на тему Мир Операции с грузами по прибытию на станцию назначения
Операции с грузами по прибытию на станцию назначения Презентация на тему Познавательные процессы 8 класс
Презентация на тему Познавательные процессы 8 класс Русская народная музыка
Русская народная музыка Портрет первоклассника
Портрет первоклассника Организация структуры базы данных
Организация структуры базы данных Теория обучения в информационном обществе
Теория обучения в информационном обществе Особенности правового режима использования олимпийской и паралимпийской символики
Особенности правового режима использования олимпийской и паралимпийской символики