Содержание
- 2. Зачем нужны металлы?
- 3. Что вы узнаете (план изучения темы) Физические свойства металлов. Химические свойства металлов. Mеталлы в нашей жизни.
- 4. Общие физические свойства металлов Пластичность – способность изменять свою форму при ударе, прокатываться в тонкие листы,
- 5. Общие химические свойства металлов Сильные восстановители С простыми веществами С кислородом (оксиды, пероксиды, надпероксиды) С галогенами
- 6. Электролиз Электролизом называется окислительно- восстановительный процесс, протекающий на электродах при похождении постоянного электрического тока через растворы
- 8. Скачать презентацию





 Центр гидравлики трубопроводного транспорта Академии наук Республики Башкортостан
Центр гидравлики трубопроводного транспорта Академии наук Республики Башкортостан Конкурс презентаций
Конкурс презентаций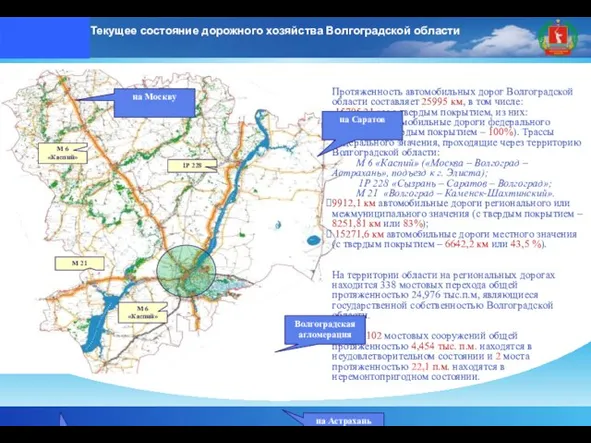 Текущее состояние дорожного хозяйства Волгоградской области
Текущее состояние дорожного хозяйства Волгоградской области Особенности экономического районирования России Подготовила: Клеутина С.А. Группа МЭ-092
Особенности экономического районирования России Подготовила: Клеутина С.А. Группа МЭ-092 TPG
TPG Глава 2
Глава 2 Джонатан Свифт. Слово о писателе. «Путешествие Гулливера» как сатира на государственное устройство общества. Образ Гулливера (час
Джонатан Свифт. Слово о писателе. «Путешествие Гулливера» как сатира на государственное устройство общества. Образ Гулливера (час Теория целей Локка
Теория целей Локка Как подобрать телефон для учебы работы игр
Как подобрать телефон для учебы работы игр Учителя русского языка
Учителя русского языка Правонарушения и юридическая ответственность
Правонарушения и юридическая ответственность В объятьях двух морей новый
В объятьях двух морей новый МОДЕЛЬ И АЛГОРИТМ ДЕЯТЕЛЬНОСТИ МОУ СОШ № 13 В УСЛОВИЯХ ВВЕДЕНИЯ Федерального государственного образовательного стандарта начал
МОДЕЛЬ И АЛГОРИТМ ДЕЯТЕЛЬНОСТИ МОУ СОШ № 13 В УСЛОВИЯХ ВВЕДЕНИЯ Федерального государственного образовательного стандарта начал Профилактикa и защита детей от насилия в школе
Профилактикa и защита детей от насилия в школе Шлифовальные станки, используемые в производстве фанеры
Шлифовальные станки, используемые в производстве фанеры Бухобслуживание
Бухобслуживание Портфель здоровья
Портфель здоровья Правило "ЕСЛИ-ТО"
Правило "ЕСЛИ-ТО" Русские народные праздники
Русские народные праздники О работе информационной системы «Единое окно доступа к образовательным ресурсам»
О работе информационной системы «Единое окно доступа к образовательным ресурсам» Русский язык и культура речи. Виртуальная выставка
Русский язык и культура речи. Виртуальная выставка Деловые документы (автобиография, заявление, резюме )
Деловые документы (автобиография, заявление, резюме ) 1 классМБОУ Великовская СОШ2011/2012 учебный год
1 классМБОУ Великовская СОШ2011/2012 учебный год Эквадор
Эквадор Презентация на тему Былины
Презентация на тему Былины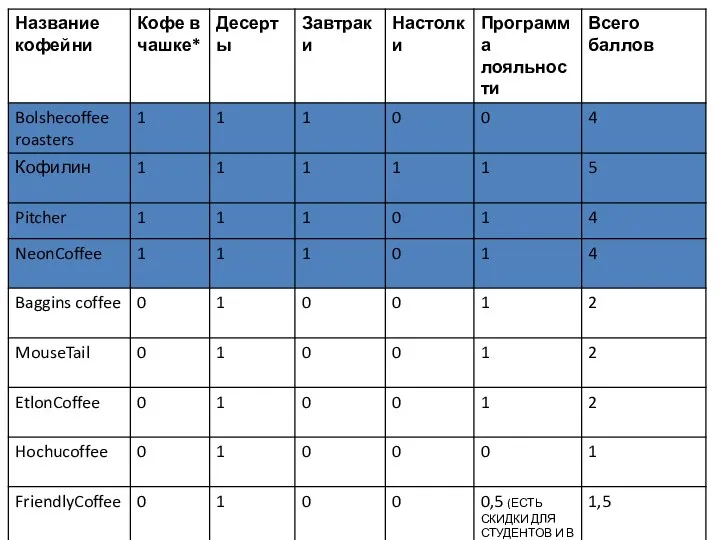 4. карта позиционирования, конкуренты_Шашина_3ГИВ13
4. карта позиционирования, конкуренты_Шашина_3ГИВ13 Нитяная графика
Нитяная графика Афанасий Фет и Фёдор Тютчев – певцы русской природы
Афанасий Фет и Фёдор Тютчев – певцы русской природы