Слайд 2Цели:
Обобщить и систематизировать знания о щелочноземельных металлах
Уметь характеризовать элементы по положению в

периодической таблице
Знать физические и химические свойства
применение соединений щелочноземельных металлов
Слайд 3Положение в периодической таблице.
Строение атома
В периодической системе находятся в главной подгруппе

II группы.
Являются сильными восстановителями, отдают 2 ē, во всех
соединениях проявляют степень окисления +2.
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Слайд 4Физические свойства
цвет пламени þ t плавления
1,74г/см3 651 С0
1,54г/см3
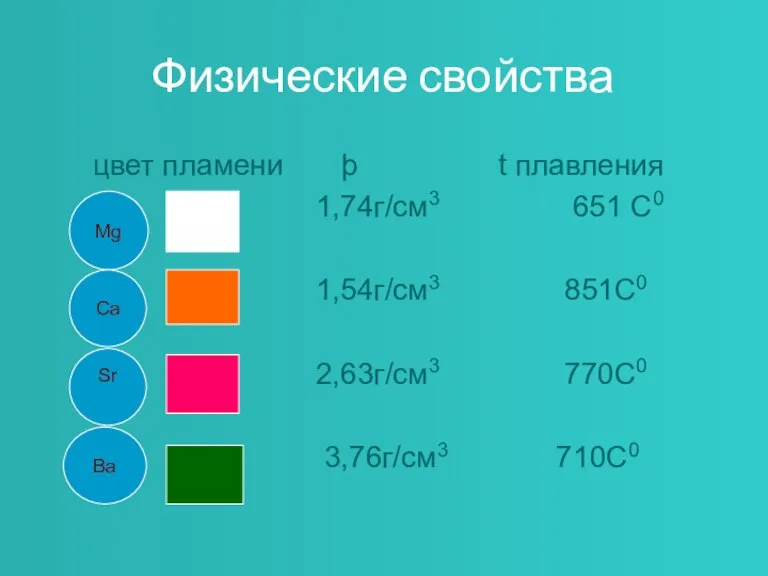
851С0
2,63г/см3 770С0
3,76г/см3 710С0
Mg
Ca
Sr
Ba
Слайд 5Химические свойства
2Me0 +O2 → 2Me+2O-2
Me0 +H2 → Me+2H2
Me0 +Cl02 → Me+2Cl2
Me0 +S0
→ Me+2S-2
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Слайд 6Соединения щелочноземельных
металлов
Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием

соответствующих солей.
Слайд 7BaSO4
Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике –
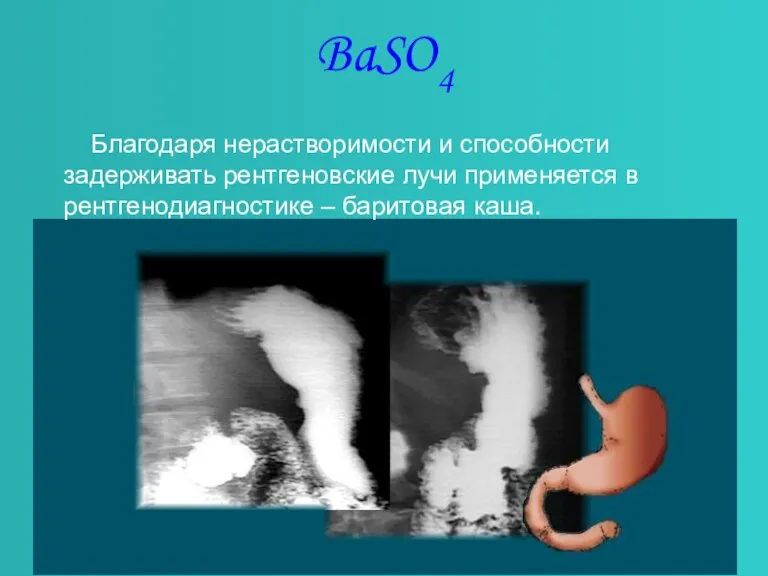
баритовая каша.
Слайд 8Ca3(PO4)2
Входит в состав фосфоритов и апатитов, а также в состав
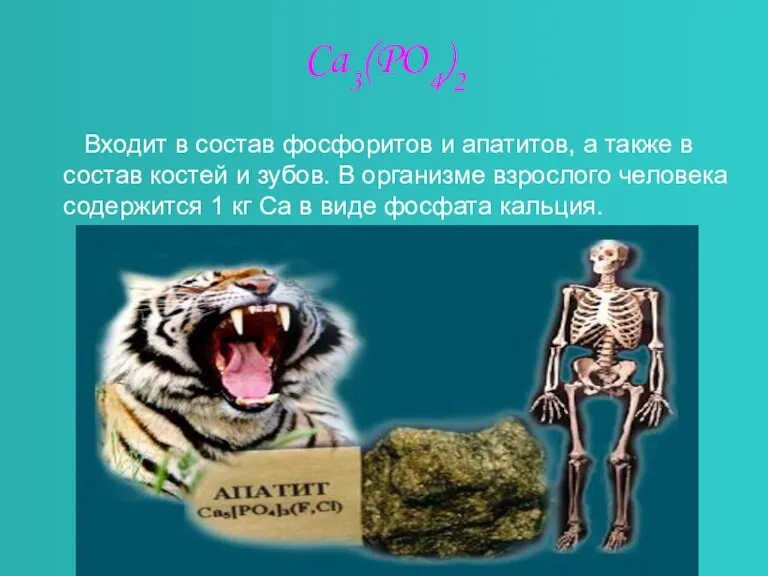
костей и зубов. В организме взрослого человека содержится 1 кг Са в виде фосфата кальция.
Слайд 9CaCO3
Карбонат кальция – одно из самых распространённых на Земле соединений. Его

содержат горные породы – мел, мрамор, известняк.
Слайд 10CaSO4∙ 2H2O
Встречается в природе в виде минерала гипса, представляющего собой

кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.
Слайд 11MgCO3
Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии

для перевода пустой породы в шлак.
Слайд 12Са(ОН)2
Гидроксид кальция или гашёная известь с песком и водой называется известковым

раствором и широко используется в строительстве. При нагревании разлагается на оксид и воду.
Слайд 13Проверка знаний
Сравните атомы элементов, поставив знаки <, > или = вместо

*:
а) заряд ядра: Mg * Ca, Na *Mg, Ca * К;
б) число электронных слоев: Mg * Ca, Na * Mg,
Ca * К;
в) число электронов на внешнем уровне: Mg * Ca, Na *Mg, Ca * К;
г) радиус атома: Mg * Ca, Na * Mg, Ca * K;
д) восстановительные свойства: Mg * Ca, Na * Mg,
Ca * K.
Слайд 14 Проверь себя
(самостоятельная работа )
Дополните схемы взаимодействия щелочноземельных металлов

с неметаллами общими формулами и названиями продуктов реакции.
Запишите конкретные уравнения реакции, расставив коэффициенты в них методом электронного баланса:
а) М+ S ____________ б) М+ N2 ____________________________
в) М+ Н 2 _____________ г) М+ С12 ___________________
Пример: ___________________ Пример: _________________________
Допишите уравнения реакций:
а) Са + H2O→ ……………………….
б) Mg + НСl→……………………….
в) Ва + О2→………………………..
Осуществить превращения по схеме:
Ме → МеО → Ме(ОН)2 → МеSО4
Слайд 15Домашнее задание:
§ 12. упр. № 5, 8
Написать уравнения реакций с помощью которых

можно осуществить два любых превращения из составленных учащимися на уроке.














 Методика ServQual
Методика ServQual Катя Царева представляет картины
Катя Царева представляет картины Общение и коммуникация
Общение и коммуникация PROTsEDURNYE_I_PROTsESSUAL_NYE_PRAVOOTNOShENIYa
PROTsEDURNYE_I_PROTsESSUAL_NYE_PRAVOOTNOShENIYa RAZREZY
RAZREZY Концепт-дизайн салонов маникюра LAKMODA
Концепт-дизайн салонов маникюра LAKMODA Презентация на тему Научно-практическая конференция
Презентация на тему Научно-практическая конференция Мы работаем на периметре незнания
Мы работаем на периметре незнания Об авторе Установка Ремонт камина Акции Каталог Галерея работ Отзывы Контакты
Об авторе Установка Ремонт камина Акции Каталог Галерея работ Отзывы Контакты Логистика - основные рабочие статусы
Логистика - основные рабочие статусы Презентация на тему Викторина ПДД
Презентация на тему Викторина ПДД  Создание и ведение блогов и сайтов по учебным предметам
Создание и ведение блогов и сайтов по учебным предметам ПАПКА ИНДИВИДУАЛЬНОЙ РАБОТЫ СЛУШАТЕЛЯ КУРСОВ ПОВЫШЕНИЯ КВАЛИФИКАЦИИ УЧИТЕЛЕЙ РУССКОГО ЯЗЫКА В ШКОЛАХ С УЗБЕКСКИМ ЯЗЫКОМ ОБУЧЕН
ПАПКА ИНДИВИДУАЛЬНОЙ РАБОТЫ СЛУШАТЕЛЯ КУРСОВ ПОВЫШЕНИЯ КВАЛИФИКАЦИИ УЧИТЕЛЕЙ РУССКОГО ЯЗЫКА В ШКОЛАХ С УЗБЕКСКИМ ЯЗЫКОМ ОБУЧЕН Социальная психология практическое. Задание №8
Социальная психология практическое. Задание №8 Кадетский корпус МВД МЧС УГ №3 им. О.Г. Макарова. Проведение мероприятий, акций
Кадетский корпус МВД МЧС УГ №3 им. О.Г. Макарова. Проведение мероприятий, акций Былина как жанр. Герои былин
Былина как жанр. Герои былин Электронная почта. E-mail
Электронная почта. E-mail Осень. Магнитогорский педагогический колледж
Осень. Магнитогорский педагогический колледж Проект «мой Пушкин»
Проект «мой Пушкин» Sport in Britain
Sport in Britain Службы сопровождения в коррекционно-развивающем образовании
Службы сопровождения в коррекционно-развивающем образовании МГД-возмущениямагнитосферной плазмыУНЧ-диапазона
МГД-возмущениямагнитосферной плазмыУНЧ-диапазона Добро и зло. Понятие греха, раскаяния и воздаяния
Добро и зло. Понятие греха, раскаяния и воздаяния Презентация на тему Изделия из теста
Презентация на тему Изделия из теста Презентация на тему Игра как метод экологического воспитания
Презентация на тему Игра как метод экологического воспитания Презентация к уроку математики в 1 классе по УМК «Школа России»
Презентация к уроку математики в 1 классе по УМК «Школа России» Получение выкройки швейного изделия из журналов мод
Получение выкройки швейного изделия из журналов мод At the restaurant
At the restaurant