Интерактивный online урок по химии для учащихся 10-11 классов Алтаева Гульнар Саматовна, учитель химии Назарбаев Интеллектуальной шко
Содержание
- 2. Квантовые числа электрона
- 3. *сформировать представления о квантовых числах, характеризующих энергию электрона в атоме, формы орбиталей, их количество и расположение
- 4. 1.Знать и понимать современные представления о строении атома, основополагающие идеи квантовой механики: дискретность или квантование; корпускулярно-волновой
- 5. Микрообъекты, макрообъекты; микрочастицы; квантовый характер энергетических изменений; атомный спектр; вероятность нахождения электрона; первый постулат Бора; второй
- 6. Фронтальный опрос по следующим вопросам: 1.Перечислите все открытия физики конца XIX- начала XX века, подтверждающие сложность
- 7. Атомно-молекулярное учение и вытекающие из него стехиометрические законы и представление о валентности дают косвенное указание на
- 8. Современная теория строения атома основана на законах, описывающих поведение микрообъектов – микрочастиц, фундаментальных частиц, электронов в
- 9. Под микрообъектами будем подразумевать электроны и изолированные атомы. Микрообъекты поглощают и испускают энергию отдельными, строго определенными
- 10. Энергия кванта связана с частотой излучения: чем меньше длина волны или больше частота колебаний, тем выше
- 11. Каждому элементу отвечает свой спектр, т. е. каждый вид атомов имеет свой (характеризующий его) прерывистый (дискретный)
- 12. Изложенные выше свойства атома – дискретность значений его энергии и поглощение и испускание энергии (света) квантами
- 13. Постулаты Бора были сформулированы для модели вращающегося электрона, или планетарной модели атома, от которой сейчас отказались.
- 14. Корпускула – очень маленькая частица вещества. Одно из свойств материи – ее двойственность, или дуализм: материя
- 15. Раньше считалось (так считал и Бор), что электроны вращаются вокруг ядра, подобно планетам вокруг Солнца. Но
- 16. Принцип неопределенности применим ко всем без исключения объектам, однако у окружающих нас макротел неопределенности в положениях
- 17. Точно так же получить информацию о скорости микрообъекта можно, воздействуя на него квантом света (фотоном), но
- 18. Можно утверждать, что в микромире вообще нельзя точно определить положение и скорость частицы. Отсюда следует важный
- 19. К концу XIX в. были накоплены сведения, подтверждающие сложное строение атома. В тот период был выдвинут
- 20. Модель Томсона Модели строения атома
- 21. В жизни часто случается, что ученики продолжают путь, начатый учителями, и идут в этом направлении дальше.
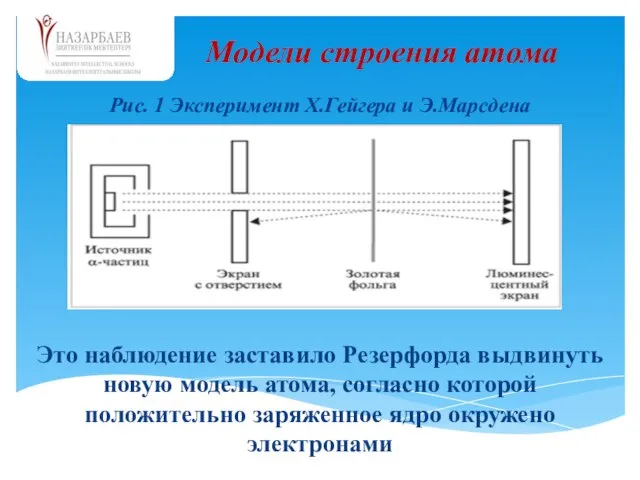
- 22. Ханс Гейгер и Эрнест Марсден были студентами Резерфорда. В 1910 г. они проводили эксперименты, в которых
- 23. Рис. 1 Эксперимент Х.Гейгера и Э.Марсдена Модели строения атома Это наблюдение заставило Резерфорда выдвинуть новую модель
- 24. Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. (А.Беккерель, 1896
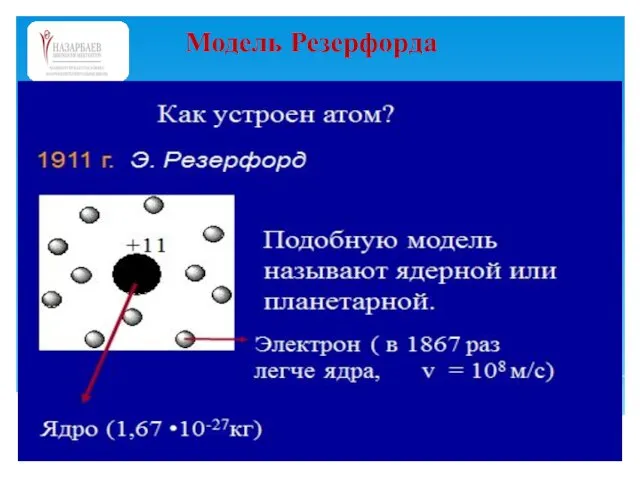
- 25. Модель Резерфорда
- 26. Суть планетарной модели строения атома (Э.Резерфорд, 1911 г.) можно свести к следующим утверждениям: 1. В центре
- 27. Эта модель оказалась очень наглядной и полезной для объяснения многих экспериментальных данных, но она сразу обнаружила
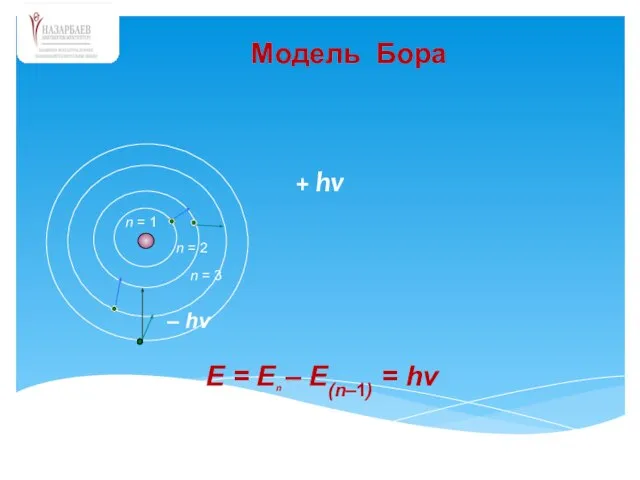
- 28. Теория Бора
- 29. + hv – hv n = 3 n = 2 E = En – E(n–1) =
- 30. Дж.Франк и Г.Герц (1912 г.) доказали дискретность энергии электрона в атоме и это позволило Бору положить
- 31. Бор предположил, что электрон в атоме не подчиняется законам классической физики. Согласно Бору, излучение или поглощение
- 32. В последующие годы некоторые положения теории Бора были переосмыслены и дополнены. Наиболее существенным нововведением явилось понятие
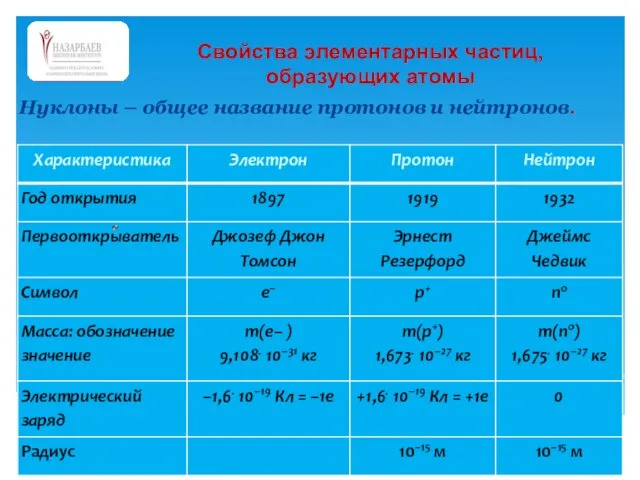
- 33. Нуклоны – общее название протонов и нейтронов. Свойства элементарных частиц, образующих атомы
- 34. Свойства элементарных частиц, образующих атомы Так как электрон "легче" любого из нуклонов почти в 2000 раз,
- 35. Свойства элементарных частиц, образующих атомы • Название " электрон" происходит от греческого слова, означающего " янтарь"
- 36. В основе современной теории строения атома лежат следующие основные положения: 1.Электрон имеет двойственную (корпускулярно-волновую) природу. Он
- 37. 2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем
- 38. 3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около
- 39. Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех
- 40. "Задайте значения квантовых чисел, и я полностью опишу свойства атома" - так может современный физик и
- 41. Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l),
- 42. Необычные свойства электрона, его двойственная природа, особый характер движения не укладываются в рамки классической механики. Поведение
- 43. Квантовые числа электрона
- 44. Точное решение уравнения Шрёдингера возможно только для системы из двух частиц, например, для атома водорода. Для
- 45. Чтобы избежать громоздких приближенных вычислений, часто применяют упрощенную модель атома, которая называется "одноэлектронное приближение ". В
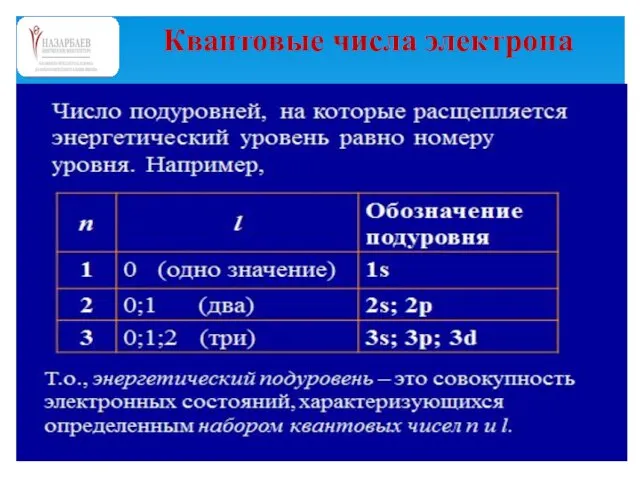
- 46. Составив уравнение Шрёдингера для какого-нибудь атома и решив его, можно определить, какие состояния возможны для электрона
- 47. Чтобы найти возможные состояния электрона в атоме, нам не обязательно составлять и решать уравнение Шрёдингера. Эта
- 48. Главное квантовое число (n) может принимать любые целочисленные положительные значения: n = 1, 2, 3, …,
- 49. Главное квантовое число (n)
- 50. Пусть главное квантовое число n = 1, тогда орбитальное квантовое число l = 0 и магнитное
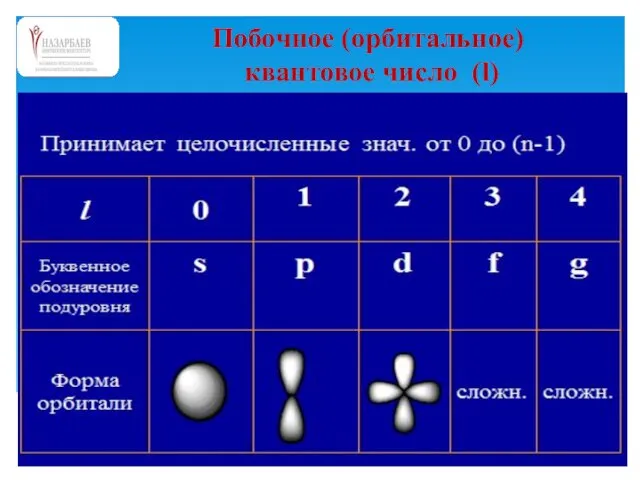
- 51. Побочное (орбитальное) квантовое число (l)
- 52. Квантовые числа электрона
- 53. Магнитное квантовое число (ml )
- 54. Магнитное квантовое число (ml )
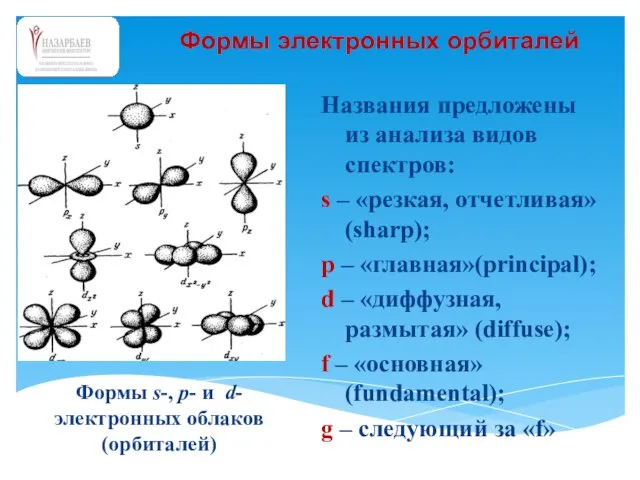
- 55. Формы электронных орбиталей Названия предложены из анализа видов спектров: s – «резкая, отчетливая» (sharp); p –
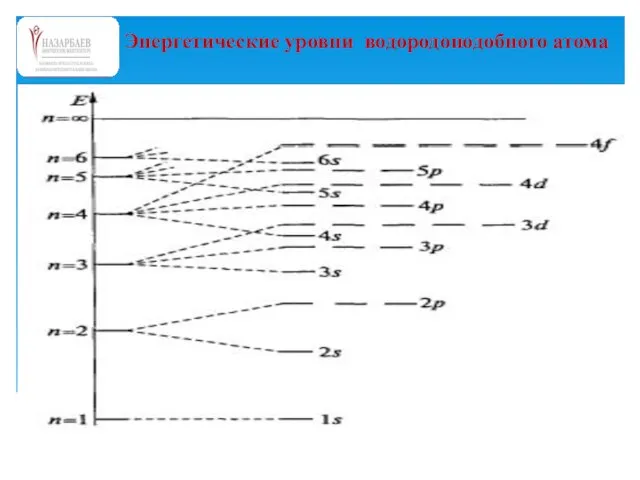
- 56. Энергетические уровни водородоподобного атома
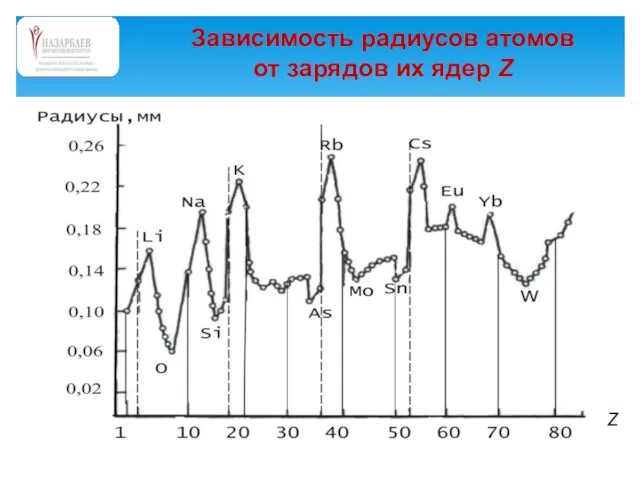
- 57. Зависимость радиусов атомов от зарядов их ядер Z
- 58. Зависимость радиусов атомов от зарядов их ядер Z Зависящие от радиусов атомов энергии атомных орбиталей, точнее,
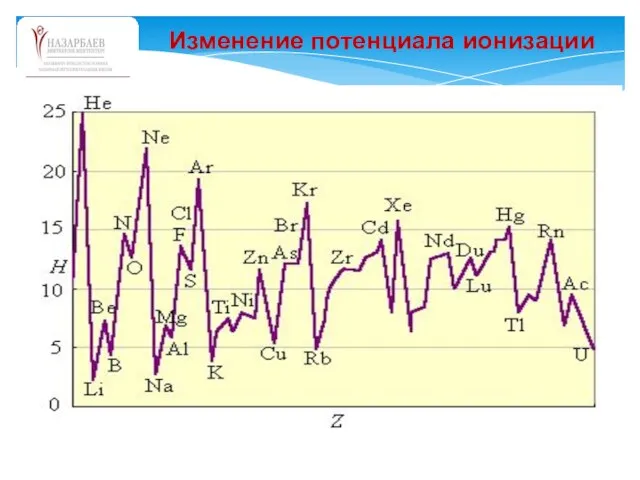
- 59. Изменение потенциала ионизации
- 60. Различают первую, вторую, третью и т. д. энергии ионизации атома. Первая энергия ионизации – это минимальная
- 61. Рассмотрим первые энергии ионизации для некоторых элементов периодической системы Д.И.Менделеева. Анализ первых энергий ионизации атомов показывает,
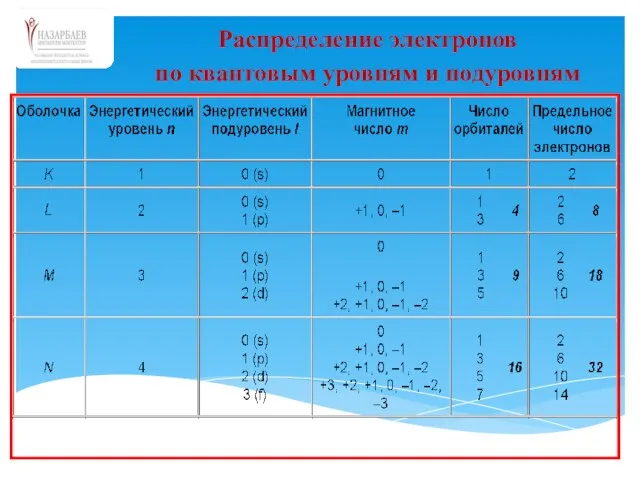
- 62. Распределение электронов по квантовым уровням и подуровням
- 63. 1.Энергия какого из электронов одного и того же атома, 1s или 2s, больше? Какой из них
- 64. 6. Какие электронные облака образуют второй электронный слой? 7.Чем отличаются друг от друга электронные облака орбиталей
- 65. Закрепление материала Переведите на русский язык. The word «ray» is used somewhat indiscriminately to describe both
- 66. Закрепление материала Переведите на русский язык. So far, the electron has been regarded as a tiny,
- 67. 1. Какие значения может принимать главное квантовое число n? Объясните смысл значений. 2. При каких значениях
- 68. 3. Переведите на русский язык. When Rutherford propounded the nuclear theory of the atom in 1912,
- 69. Эту задачу психологи иногда предлагают учащимся и взрослым людям для оценки их творческих способностей: Шар опоясали
- 70. А.Темирбулатова, Н.Нурахметов, Р.Жумадилова, С.Алимжанова. Химия 11, Учебник для 11 классов естественно-математического направления общеобразовательных школ. «Мектеп», 2007
- 71. http://school-collection.edu.ru http://festival http://xumuk.ru . http://alhimik.ru http://chemistry.narod.ru http://www.hob-inf.narod.ru . http://experiment.edu.ru http://ege.ru . http://www.alleng.ru/edu/chem3.htm . Ресурсы
- 72. ОЦЕНИВАНИЕ УЧЕБНЫХ ДОСТИЖЕНИЙ Критерии для оценивания контрольной работы: Критерий А. Единый мир Критерий С. Научное знание
- 73. ОЦЕНИВАНИЕ УЧЕБНЫХ ДОСТИЖЕНИЙ Критерий А. Единый мир: Должен «демонстрировать ясное понимание вклада науки в жизнь общества,
- 74. ОЦЕНИВАНИЕ УЧЕБНЫХ ДОСТИЖЕНИЙ Критерий С. Научное знание и понимание Продемонстрировать способность «применять и интерпретировать широкий спектр
- 75. ОЦЕНИВАНИЕ УЧЕБНЫХ ДОСТИЖЕНИЙ Критерий E. Обработка информации «Уметь представлять данные в законченной и логичной форме, производить
- 76. Общий критериальный уровень переводится в отметку по следующей шкале:
- 77. Прием “Кластер” для рефлексии Разбивка на кластеры очень проста и легко запоминается: 1. Напишите ключевое слово
- 79. Скачать презентацию

































































 Игровые моменты на уроках химии
Игровые моменты на уроках химии Зошто го идеализираме хактивизмот и зошто ни е потребен
Зошто го идеализираме хактивизмот и зошто ни е потребен В старшем дошкольном возрасте он уже избирателен в выборе красивого, имеет на этот счет собственные суждения и сам, исходя из своих
В старшем дошкольном возрасте он уже избирателен в выборе красивого, имеет на этот счет собственные суждения и сам, исходя из своих Искусство ХХ века в Третьяковке В будущее возьмут не всех
Искусство ХХ века в Третьяковке В будущее возьмут не всех СММ ведущего
СММ ведущего Презентация на тему Политика и литература 20-30-х годов XX века
Презентация на тему Политика и литература 20-30-х годов XX века Вероятность события
Вероятность события Интеграция как необходимое условие развития единой корпоративной информационной системы предприятия
Интеграция как необходимое условие развития единой корпоративной информационной системы предприятия Легкая атлетика
Легкая атлетика ФИЗИОЛОГИЯ НЕРВОВ И МЫШЦ
ФИЗИОЛОГИЯ НЕРВОВ И МЫШЦ Узкие места внутренней среды ООО Мясной гурман. Анализ ресурсов по Портеру
Узкие места внутренней среды ООО Мясной гурман. Анализ ресурсов по Портеру Терминал. Планирование продаж
Терминал. Планирование продаж Расчет деревянных элементов сплошного сечения
Расчет деревянных элементов сплошного сечения Таможенные органы Российской Федерации: их структура, функции, обязанности, права, ответственность
Таможенные органы Российской Федерации: их структура, функции, обязанности, права, ответственность Раннее представление о путях воздействия на преступления
Раннее представление о путях воздействия на преступления Иллюстрации мультипликационных фильмов, раскрывающих особенности развития личности детей дошкольного возраста
Иллюстрации мультипликационных фильмов, раскрывающих особенности развития личности детей дошкольного возраста Основные понятия современной физической культуры. Тема 3
Основные понятия современной физической культуры. Тема 3 СИСТЕМА ЦЕНООБРАЗОВАНИЯ НА СЖИЖЕННЫЕ УГЛЕВОДОРОДНЫЕ ГАЗЫ КАК ОСНОВА РАЗВИТИЯ РЫНКА. ОПЫТ СИБУРА
СИСТЕМА ЦЕНООБРАЗОВАНИЯ НА СЖИЖЕННЫЕ УГЛЕВОДОРОДНЫЕ ГАЗЫ КАК ОСНОВА РАЗВИТИЯ РЫНКА. ОПЫТ СИБУРА Жостово. Техника росписи подносов
Жостово. Техника росписи подносов Современная скульптура. Новые материалы
Современная скульптура. Новые материалы Добро и зло в мире и человеке
Добро и зло в мире и человеке Моё хобби
Моё хобби Все народы воспевают материнство
Все народы воспевают материнство М.Е.Салтыков-Щедрин "История одного города"
М.Е.Салтыков-Щедрин "История одного города" Админ
Админ The Fat of the Land
The Fat of the Land  Разобщение пластов. Крепление скважин
Разобщение пластов. Крепление скважин Ядовитые растения Среднего Урала
Ядовитые растения Среднего Урала