Слайд 2Теломераза и старение
Проблемы концевой недорепликации ДНК
Эффект Хейфлика

Слайд 3 Эффект Хейфлика
Монослой – нормальные соматические клетки прикрепленные ко дну сосуда, инкубируемые

в термостате
Контактное ингибирование- важнейшее свойство неопухолевых клеток.
Пересев при увеличении числа клеток монослоя в 2 раза.
Слайд 4Эффект Хейфлика
Нормальные фибробласты, взятые от человеческого эмбриона, не могут делиться сколь угодно

долго.
Многочисленные проверки показали, что деления прекращаются примерно после 50 пересевов (клеточных удвоений).
В итоге жизненный цикл клеточной популяции разбивался на 3 фазы. Из них последняя (фаза III) знаменовалась тем, что у клеток замедлялась скорость деления, и они в конце концов погибали.
Слайд 5Эффект Хейфлика
Линия делящихся соматических клеток вовсе не бессмертна; старение — это свойство

самих клеток (его проявлением служит фаза III), причем оно даже запрограммировано в геноме клеток, поскольку наступает после определенного числа делений.
Это критическое число делений получило название лимита Хейфлика.
Слайд 6Эффект Хейфлика
В экспериментах клетки отделяли друг от друга с помощью трипсина, а

потом инкубировали в присутствии сыворотки. Но оба эти агента не так уж безобидны. В случае сперматогенных клеток трипсин и сывороточные белки существенно влияют на стабильность плазмолеммы и ядерной оболочки.
Трипсин влияет и на фибробласты: вызывает деградацию мембранных белков, полисом (в цитоплазме) и негистоновых белков (в ядре).
Можно представить, что не внутренние часы, а именно 50-кратная обработка клеток трипсином приводит культуру к гибели.
Слайд 7Эффект Хейфлика
а) В первоначальных опытах исходные клетки (фибробласты) получали из человеческого эмбриона

- и они делились около 50 раз.
Но если получать фибробласты от взрослого человека. то число делений клеток до гибели популяции оказывается меньше 50. Причем имеется явная зависимость от возраста донора: чем старше донор, тем меньше число делений.
Подобная закономерность установлена для самых разных клеток, в т. ч. эпителиоцитов, гладких миоцитов и лимфоцитов.
Следовательно, in vivo в клетках тоже функционирует некий счетчик, фиксирующий количество делений.
Слайд 8Эффект Хейфлика
И при переносе клеток in vitro он продолжает счет, а не

начинает его сначала.
Выяснена и конкретная количественная связь: с увеличением возраста человека (донора) на один год количество возможных делений фибробластов в культуре уменьшается в среднем на 0,2.
Отсюда следует интереснейший вывод. За 100 лет жизни человека репликативный потенциал фибробластов снижается всего на 20 делений. А весь этот потенциал израсходуется (при сохранении тех же темпов) только за 250 лет.
Слайд 9Эффект Хейфлика
б) Клетки «запоминают» количество прошедших делений. «Память» об этом сохраняется и

в том случае, если клетки на длительный срок (вплоть до нескольких десятков лет) подвергнуть глубокому замораживанию.
После размораживания клетки возобновляют деления и делятся именно столько раз, сколько им оставалось делиться до замораживания.
в) Еще одна показательная корреляция — между видовой продолжительностью жизни животного и количеством делений его клеток в культуре.
Слайд 10Эффект Хейфлика
г) Важным аргументом служит изучение клеток, вошедших в фазу III.
Еще за

несколько делений до остановки размножения рост популяции плавно замедляется и меняется морфология клеток: они становятся более крупными (из-за увеличения промежутков времени между делениями) и распластываются по стеклу (из-за снижения тургора).
Меняются многие биохимические показатели - активность ферментов, интенсивность макромолекулярных синтезов и т. д. Часто аналогичные изменения обнаруживают и in vivo - при старении целостного организма.
Слайд 11Эффект Хейфлика
Фаза III — старение клеток in vitro.
Делящимся клеткам человека и животных

соответствует некий генетически детерминированный лимит делений, при приближении к которому в клетках наступают глубокие изменения, вызывающие в конечном счете прекращение делений и гибель клеток
Слайд 12Теломерная теория старения
Теломерная теория старения (теория маргинотомии).
Гипотеза «билетиков» для объяснения функционирования

молекул мРНК. Последние имеют с одного из концов участок (полиА-фрагмент), не содержащий генетическую информацию.
При каждом «прочтении» мРНК на рибосоме полиА-фрагмент укорачивается на 10-15 нуклеотидов (как бы отрывается один «билетик»). Когда же длина полиА-фрагмента достигает критически короткой величины (50 нуклеотидов), мРНК становится доступной для РНКазы и разрушается.
Теория маргинотомии, призванная объяснить старение, являлась полным аналогом гипотезы «билетиков», только отнесенной не к мРНК, а к ДНК.
Слайд 16Теломерная теория старения
При каждом делении нормальных клеток в культуре длина теломерных последовательностей

сокращается на 50-100 н. п. За все же 50 делений человеческих фибробластов укорочение составляет 2-3 тысячи н. п.
По сравнению с общей длиной теломерной ДНК – 10-15 тысяч н. п. - это не так уж и много: примерно одна пятая часть.
Слайд 17Теломерная теория старения
Укорочение теломер для клеток in vivo.
В лимфоцитах по мере увеличения

возраста человека теломеры оказываются все короче и короче — в среднем на 40 н. п. за один год.
У больных же синдромом Дауна, отличающихся преждевременным иммунным старением лимфоцитов, соответственно оказывается выше и скорость укорочения теломер в лимфоцитах - по 133 н. п. в год.
Исследованы также половые клетки. В них теломеры оказались длиннее, чем в соматических клетках того же индивидуума. Причем с возрастом человека теломеры в зрелых половых клетках остаются стабильными.
Слайд 18Теломерная теория старения
В культивируемые клетки был введен (методами генной инженерии) ген TERT,

кодирующий каталитическую субъединицу теломеразы. После чего в своих делениях клетки намного (на 20 делений) превысили лимит Хейфлика.
Поддержание длины теломер предупредило остановку делений и гибель культуры.
Слайд 19Теломерная теория старения
Обычно рассматривают два взаимно противоположных варианта:
в одном случае «негатив» состоит

в активации «плохих» генов - т. н. генов AGE, отвечающих за старение;
в других случаях происходит инактивация «хороших» генов, необходимых для полноценного функционирования клетки.
а) Первый вариант обычно исходит из эффекта положения, который экспериментально выявлен у некоторых организмов: достаточно длинные теломеры вызывают сайленсинг (репрессию активности) прилежащих генов. При укорочении теломер эти гены активируются.
Слайд 20Теломерная теория старения
б) Второй возможный вариант влияния длины теломер на состояние клетки

(предполагающий инактивацию «хороших» генов).
Он возник из исходного представления, что процесс укорочения хромосом при клеточных делениях в конечном счете достигает структурных генов.
В местах прикрепления теломер к внутренней ядерной мембране имеются Са²+-каналы, и поток ионов через них создает своего рода «душ», необходимый для функционирования генов. При значительном же укорочении теломер теряется связь хромосом с мембраной, отчего гены оказываются дальше от ионного «душа» - с соответствующими негагивными последствиями.
Слайд 21Теломерная теория старения
Теоретические предсказания А. М. Оловникова нашли экспериментальное подтверждение.
а) Предсказание о том,

что должен существовать специальный механизм поддержания длины теломер. Подтверждено открытием теломеразы и альтернативного механизма (ALT).
б) Предсказание об укорочении теломер в соматических клетках. Подтверждено для многих делящихся клеток - в культуре и in vivo.
в) Предсказание о том, что в зрелых половых клетках длина теломер не должна зависеть от возраста. Подтверждено.
г) Предсказание о том, что именно укорочение теломер
приводит к прекращению делений клеток в культуре. Подтверждено экспериментом, в котором лимит Хейфлика преодолен путем введения в клетки гена теломеразы.
д) Сделаны и подтвердились также еще несколько смежных предсказаний - например, о наличии теломеразы в опухолевых клетках (чем и объясняется их способность к неограниченным делениям).
Слайд 22Критика теломерной теории старения
а) В большинстве клеток мышей - довольно высокая активность теломеразы,

отчего теломерные последовательности очень
длинные и весьма мало укорачиваются при делениях клеток. Тем не менее, лимит Хейфлика составляет здесь всего 20 делений.
б) Кроме того, клетки человека, зараженные вирусом SV40, совершают 20-60 делений сверх лимита Хейфлика. И все это время у них отсутствует теломераза и продолжается укорочение теломер. Значит, к моменту совершения определенных лимитом 50 делений теломеры еще не достигли критически короткой длины, и прекращение делений вызвано каким-то иным обстоятельством.
Слайд 23Критика теломерной теории старения
в) В ряде случаев (кератиноциты, клетки молочной железы) введение в

клетки гена теломеразы (TERT) вызывает удлинение теломер, но не увеличивает лимит Хейфлика.
Тем не менее, если не во всех, то, по крайней мере, в каких-то клеточных культурах теломеры выполняют роль счетчиков (репликометров), «отсчитывающих» количество прошедших и количество еще возможных делений
Слайд 24Критика теломерной теории старения
Но можно ли утверждать, что старение и смерть целостного

организма определяются именно этим обстоятельством? На этот счет имеются большие сомнения.
а) Во-первых, в организме, кроме делящихся, имеется немало неделящихся клеток. Причем последние тоже стареют и, по многим данным, не медленней, а даже быстрей делящихся клеток.
Клетки мозга, печени, мышечные волокна и т. д.: с одной стороны, они существуют, не делясь, десятки лет - и эффективно функционируют; с другой стороны, во всех них обнаружены и описаны те или иные возрастные изменения.
Слайд 25Критика теломерной теории старения
б) Во-вторых, возьмем обновляющиеся ткани - например, эпидермис.
В культуре эффект

Хейфлика проявляется как бы скачкообразно: на протяжении нескольких десятков делений нет никаких изменений, и лишь в самом конце состояние клеток резко ухудшается.
In vivo старение эпидермиса (и подлежащей дермы) происходит совершенно иначе - не скачкообразно, а постепенно. Не случайно по состоянию кожи можно достаточно определенно судить о возрасте человека.
Значит, и здесь старение обусловлено вовсе не приближением к критическому пределу, а иными - постоянно действующими - причинами.
Слайд 26Критика теломерной теории старения
в) О том же свидетельствуют экспериментальные данные, согласно которым даже

у пожилых людей репликативный потенциал делящихся клеток далеко не исчерпан.
Фибробласты, выделенные у 90-летних доноров, делились в культуре всего на 20 раз меньше, чем фибробласты плодов человека. Тогда как лимит, по Хейфлику, равен 50 делениям.
Следовательно, «старыми» делящиеся клетки становятся у стариков не потому, что слишком много делились.
Слайд 27Критика теломерной теории старения
г) Не все ясно и с самим лимитом Хейфлика.
Положение о

том, что in vivo тоже (как и in vitro) деления соматических клеток ограничены неким пределом, кажется достаточно естественным и обоснованным. Но действительно ли этот предел примерно равен 50?
В только что упоминавшихся экспериментах исследовались фибробласты.
Произведем приблизительные расчеты для клеток эритропоэтического ряда.
Слайд 28Критика теломерной теории старения
Начнем с того, что в организме новорожденного ребенка -

порядка 10¹² всевозможных клеток. Из соотношения 2×10¹² находим, что для их образования из зиготы должно было произойти около 40 циклов митотических делений.
Но это лишь при условии, что все вновь образующиеся клетки тоже непременно делятся. На самом деле какие-то клетки в эмбриогенезе погибают, а еще часть клеток вступает в дифференцировку и не делится. Так что фактически в «предыстории» многих клеток новорожденного (в т. ч. эритропоэтических) не 40, а больше делений.
Слайд 29Критика теломерной теории старения
Теперь обратимся к гемопоэтическим клеткам. Среди них содержится некое

количество стволовых клеток. Всю жизнь человека их популяция должна самоподдерживаться, для чего необходимы редкие деления по типу:
1 клетка, идентичная исходной + 1 дифференцирующаяся клетка.
По некоторым данным, можно полагать, что у взрослого человека:
а) в красном костном мозга - примерно 10¹³ гемопоэтических клеток,
б) доля стволовых клеток среди них близка к 10³,
в) для обеспечения нормальной скорости эритропоэза в деления вышеуказанного типа ежесуточно должно вступать около 2х108 стволовых клеток.
Слайд 30Критика теломерной теории старения
При гомопластическом эритропоэзе основным источником эритроцитов являются деления эритробластов.

Однако для поддержания системы в стационарном состоянии необходимо, чтобы пул несамоподдерживающихся эритробластов все время пополнялся со стороны стволовых клеток.
Каждая из стволовых клеток делится в среднем один раз в 50 суток. Это весьма редко и вполне соответствует имеющимся представлениям.
Слайд 31Критика теломерной теории старения
Но это же означает, что, например, за 60 лет

жизни человека стволовые клетки делятся более чем по 7x60 = 400 раз!
Наконец, еще следует добавить примерно 10 делений в ходе собственно эритропоэза (большая часть этих делений приходится на эритробласты).
Итого, общая сумма делений, предшествующих образованию эритроцитов у 60-летнего человека, составляет примерно:
450, если начинать считать от зиготы, и
400, если считать от рождения.
Слайд 32Критика теломерной теории старения
Это приблизительные оценки, но они намного больше лимита Хейфлика,

установленного для эмбриональных фибробластов человека (при том, что у прочих клеток способность к размножению in. vitro еще меньше, чем у фибробластов).
Обычно в качестве доказательства, что 50-60 делений вполне достаточно, приводят простейший расчет типа: 2 60 = 1018, результат которого на несколько порядков превосходит количество всех клеток взрослого человека (1014).
Но на примере эритропоэза мы видим, что механически возводить 2 в ту или иную степень нельзя: надо еще хотя бы приближенно учитывать реальные особенности целостного организма.
В итоге, остается совершенно неясным, каково же на самом деле предельно допустимое количество делений in vivo для клеток человека.
Слайд 33Критика теломерной теории старения
Этот предел (если он, действительно, существует) для разных клеток

может быть совершенно различным.
Действительно, многие делящиеся клетки обладают теломеразной активностью и, в зависимости от ее уровня, в одних случаях критическое укорочение теломер наступит после меньшего, а в других случаях - после гораздо большего числа делений.
Слайд 34Критика теломерной теории старения
а) лимит делений in vivo для различных клеток неизвестен;
б) старение in

vivo, скорее всего, не связано с приближением делящихся клеток к этому лимиту.
Показательно, что второй из сделанных выводов полностью поддерживается и самим Хейфликом. Вот его собственные слова:
«...я не верю в то, что старение и смерть людей наступают вследствие прекращения деления их клеток ».
Слайд 35Укорочение теломер – причина старения
Укорочение теломер может происходить не только в
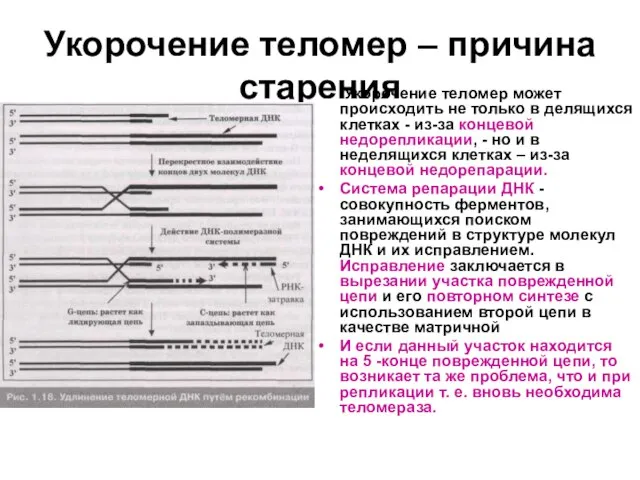
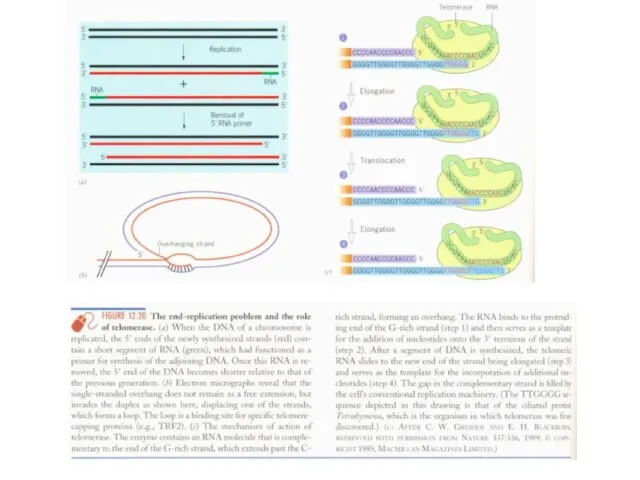
делящихся клетках - из-за концевой недорепликации, - но и в неделящихся клетках – из-за концевой недорепарации.
Система репарации ДНК -совокупность ферментов, занимающихся поиском повреждений в структуре молекул ДНК и их исправлением. Исправление заключается в вырезании участка поврежденной цепи и его повторном синтезе с использованием второй цепи в качестве матричной
И если данный участок находится на 5 -конце поврежденной цепи, то возникает та же проблема, что и при репликации т. е. вновь необходима теломераза.
Слайд 36Причины старения
С возрастом происходит не только укорочение теломер, но и другие

изменения:
увеличение числа разрывов в цепях ДНК, а также накопление прочих дефектов структуры;
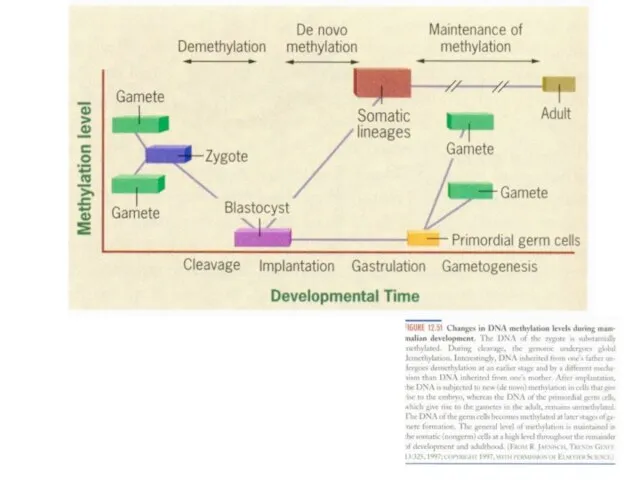
уменьшение содержания 5-метилцитозина
в ДНК;
усиление прочности связывания белков с ДНК;
снижение активности ферментов, функционирующих на хромосомах (в т. ч. ферментов репарации ДНК).
Слайд 37Теории старения
Выдвинуто 2 группы теорий старения.
Старение - это результат изнашивания

или повреждения каких-то структур под влиянием различных ; стохастических (случайных) факторов - внешнего облучения, свободных радикалов, локальных всплесков температуры и т. д.
Старение - запрограммировано: все дело в некоей генетической программе, определяющей продолжительность жизни.
Теломерная теория - типичный пример такого типа: здесь программа состоит в выключении теломеразы в соматических клетках. Но это не может объяснить других возрастных изменений хромосом, не говоря о бесконечном числе прочих возрастных явлений
Слайд 38Теории старения
В организме имеется целая совокупность различных защитных систем. На внутриклеточном уровне

это:
система репарации ДНК,
система теломер и теломераза,
антиоксидантная система (обезвреживающая свободные радикалы),
система шаперонов (белков теплового шока), восстанавливающая третичную структуру белков при ее нарушении вследствие, например, локального всплеска температуры.
Система метилирования ДНК.
Если старение действительно запрограммировано, то программа, скорее всего, состоит в постепенном ослаблении деятельности вышеперечисленных защитных систем.
Слайд 39Теории старения
Тогда становится понятно, почему, несмотря на эффективную систему репарации, в структуре

ДНК с возрастом накапливаются разрывы и другие дефекты.
Или почему в культуре фибробластов по мере делений белки теплового шока индуцируются все хуже и хуже.
Или почему уменьшается количество 5-метилцитозина в ДНК.
И в этом же ряду - снижение активности теломеразы в делящихся клетках.
Т. е. это всего один из элементов единого и гораздо более сложного процесса.
Слайд 40Теории старения
В линии половых клеток старение отсутствует
Теломерная теория его полностью воспроизводит,

утверждая, что в линии половых клеток всегда эффективно функционирует теломераза и потому теломеры имеют постоянную длину
Что следует понимать под линией половых клеток?
Например, линия мужских половых клеток, то ее полный жизненный цикл («от зиготы до зиготы») включает следующие этапы:
Слайд 41Теории старения
Первые недели эмбрионального развития, в зародыше обособляются первичные половые клетки (гоноциты);
Половую

дифференциацию этих клеток и несколько периодов деления, сменяемых фазами покоя; в итоге образуется пул изолированных сперматогоний -стволовых клеток;
Длительное (в течение нескольких десятилетий) существование изолированных сперматогоний в семенных канальцах яичек; в это время, видимо, регулярно происходят деления самоподдержания и так же регулярно (после полового созревания организма) какая-то часть сперматогоний вступает в дифференцировку;
Сперматогенез, продолжающийся у человека 75 суток, включает митотическое размножение сперматогоний, мейотическое деление сперматоцитов и преобразование сперматид в сперматозоиды
Слайд 42Теории старения
В 1978- 1980 гг были обнаружены достоверные биохимические различия между одноименными

сперматогенными клетками, полученными из мышей разного возраста.
Предполагается, что в линии половых клеток, несмотря на митотические деления и действие защитных систем, постепенно накапливаются возрастные изменения. Особенно важны изменения структуры хромосом.
Но на одной из стадий цикла происходит «капитальный ремонт», или «омоложение», клеток. В первую очередь, «ремонтные работы» должны касаться, разумеется, хромосом.
Слайд 43Теории старения
Наиболее вероятной стадией, используемой для этого, является весьма продолжительная профаза мейоза.

В это время происходят сложные преобразования хромосом (конъюгация, кроссинговер), в процессе которых может совершаться полное восстановление нормальной структуры генома.
О подобной роли мейоза свидетельствуют такие факты:
Некоторые простейшие (инфузории) размножаются и половым, и бесполым путем. При этом половое деление ядер (мейоз) и последующий половой процесс (слияние гаплоидных ядер) резко активизируют культуру: клетки начинают чаще делиться, в них интенсифицируется обмен веществ.
Другой широко известный факт - с клонированием. Знаменитая овечка Долли получила хромосомы соматической клетки, т. е. не прошедшие мейоз. В результате у нее развилось преждевременное старение.
Слайд 44Теории старения
Принципиально возможные варианты:
G - это биологический возраст клетки, т. е.
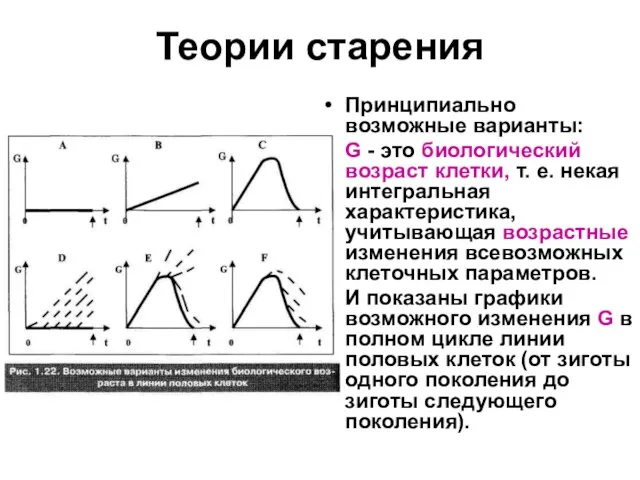
некая интегральная характеристика, учитывающая возрастные изменения всевозможных клеточных параметров.
И показаны графики возможного изменения G в полном цикле линии половых клеток (от зиготы одного поколения до зиготы следующего поколения).
Слайд 45Теории старения
Постулат Вейсмана отражается графиком А, а в модифицированном (и более вероятном)
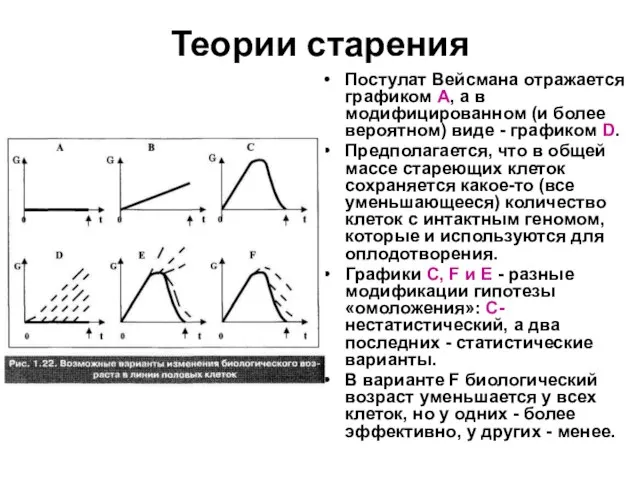
виде - графиком D.
Предполагается, что в общей массе стареющих клеток сохраняется какое-то (все уменьшающееся) количество клеток с интактным геномом, которые и используются для оплодотворения.
Графики С, F и Е - разные модификации гипотезы «омоложения»: С- нестатистический, а два последних - статистические варианты.
В варианте F биологический возраст уменьшается у всех клеток, но у одних - более эффективно, у других - менее.
Слайд 46Теории старения
Вариант же Е допускает, что «омоложение» одних клеток может происходить за
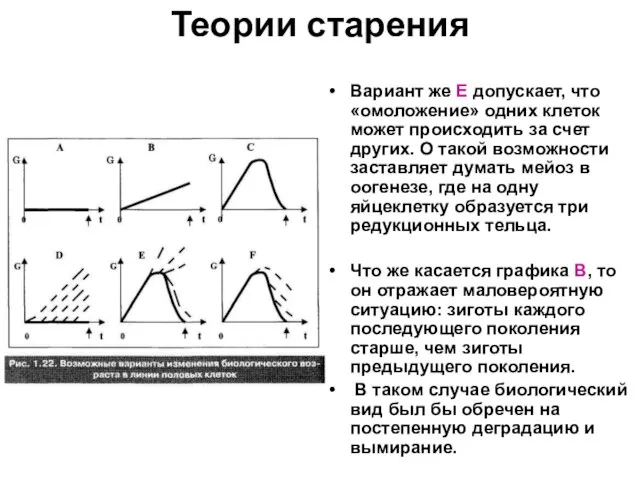
счет других. О такой возможности заставляет думать мейоз в оогенезе, где на одну яйцеклетку образуется три редукционных тельца.
Что же касается графика В, то он отражает маловероятную ситуацию: зиготы каждого последующего поколения старше, чем зиготы предыдущего поколения.
В таком случае биологический вид был бы обречен на постепенную деградацию и вымирание.
Слайд 47Теломераза и онкогенез
Кроме старения, теломеры и теломераза связаны с другой важнейшей биологической

проблемой - проблемой опухолевого роста (онкогенезом).
Слайд 48Теломераза и онкогенез
Получение линий опухолевых клеток
Нормальные соматические клетки делятся в культуре

ограниченное количество раз.
Опухолевые клетки в своих делениях не имеют какого-либо предела: их популяция может удваиваться бесконечно. Чтобы подчеркнуть данную особенность таких клеток, их часто называют иммортализованными («бессмертными»).
Получить «бессмертные» линии можно двумя способами:
либо трансформировать нормальные клетки in vitro,
либо выделить клетки из опухоли, растущей in vivo.
Слайд 49Теломераза и онкогенез
В обоих случаях культивировать иммортализованную линию можно опять-таки двумя способами:
in

vitro, т. е. путем пересева клеток в новые флаконы после каждого удвоения популяции,
in vivo - путем регулярного пересева клеток здоровым
животным.
Трансформированные in vitro клетки нередко вводят в организм животного, где они вызывают опухоль.
И наоборот: выделенные из первичной опухоли клетки десятилетиями культивируют in vitro.
Наиболее известной из таких длительно поддерживаемых культур является линия HeLa. Ее клетки получены в 1952 г. из опухоли шейки матки женщины и названы по инициалам пациентки.
Слайд 50Теломераза и онкогенез
Иммортпализация in vitro
Иммортализация in vitro бывает спонтанной и индуцированной.
В

случае мышиных фибробластов спонтанная трансформация происходит следующим образом:
Эмбриональные фибробласты мышей делятся в культуре примерно 20 раз. При этом последние деления совершаются все реже, а размер клеток увеличивается. Но и после завершающего удвоения клетки еще длительно (в течение нескольких месяцев) остаются живыми.
В такой неделящейся культуре через 2-3 месяца могут возникать отдельные фокусы роста. Количество клеток в фокусе начинает увеличиваться в геометрической прогрессии. Это и означает, что произощла спонтанная трансформация какой-то переживающей «старой» клетки, дающая начало новому клону.
Слайд 51Теломераза и онкогенез
Клоны трансформантов бывают двух видов:
Одни клоны имеют ограниченный пролиферативный

потенциал: совершают еще 20-30 удвоений популяции и подвергаются повторному старению.
Другая часть трансформированных клонов оказывается иммортализованной: удваивается неограниченное число раз.
В отличие от клеток мышей, нормальные клетки человека крайне редко претерпевают спонтанную трансформацию in vitro.
Однако трансформацию можно надежно вызвать онкогенными ДНК-содержащими вирусами - например, вирусом SV40.
Слайд 52Теломераза и онкогенез
В этом процессе различают две стадии:
Первая стадия - временное

удлинение жизни культуры, после заражения вирусом клетки меняют свою морфологию и совершают на 20-60 делений больше, чем нормальные клетки. Эта стадия кончается кризисом - прекращением роста популяции. Большая часть клеток после этого погибает.
Но единичные клетки (их доля варьирует от 109 до 105) проходят вторую стадию, в ходе которой становятся иммортализованными.
Таким образом, у клеток мышей временное удлинение жизни культуры и иммортализация - два независимых варианта трансформации.
А у клеток человека временное удлинение жизни и иммортализация - две последовательные стадии трансформации, которая в подавляющем большинстве случаев ограничивается только первой стадией.
Слайд 53Теломераза и онкогенез
Теломеры и теломераза в трансформированных клетках
Иммортализация обусловлена индукцией теломеразы -

восстановление теломер и постоянное поддержание их длины после очередных делений.
Опухолевые клетки, как и клетки половой линии, должны содержать высокую активность теломеразы.
Слайд 54Теломераза и онкогенез
Клеточные линии:
а) При вирусной трансформации клеток человека на первой стадии

(до кризиса) продолжается укорочение теломер по мере деления клеток.
Это обстоятельство свидетельствует против того, что остановка делений на лимите Хейфлика вызвана недостаточной длиной теломер. Ведь при трансформации деления продолжаются и при большем укорочении теломер.
Но последующий кризис обусловлен предельным укорочением теломер. Об этом говорят как прямые определения их длины, так и наблюдаемое в это время слияние концов хромосом во многих клетках.
Одной из функций теломер является стабилизация концов хромосом; недостаточность этой функции и приводит к объединению хромосом.
Слайд 55Теломераза и онкогенез
В клетках, преодолевших кризис, наблюдается увеличение длины теломер.
б) Длина

теломер стабилизируется за счет появления теломеразной активности. Последняя обнаружена
в подавляющем большинстве иммортализованных линий, в то время как в докризисных клетках теломеразы нет.
А что будет при воздействии на иммортализованные клетки ингибиторами теломеразы?
В качестве такого ингибитора успешно выступает З'-азидо-З'-дезокситимидин - ингибитор всех обратных транскриптаз (лечение СПИДа). Теломераза тоже относится к этой группе ферментов, ингибитор подавляет ее активность.
Свойство иммортализации пропадает: клетки, в конце концов, перестают делиться и демонстрируют все признаки старения в культуре.
Обязательным условием иммортализации является поддержание длины теломер.
Слайд 56Теломераза и онкогенез
Появляется новое направление в лекарственной терапии опухолей. Следует использовать не

тотальные нгибиторы синтеза ДНК, а более специализированные ингибиторы теломеразы: в этом случае будет меньше побочного влияния на нормальные клетки.
в) Еще один интересный экспериментальный подход - получение гибрида нормальной и иммортализованной клеток.
Теломеразная активность в гибриде отсутствует. В нормальной клетке имеются некие репрессоры генов теломеразы, а при иммортализации эти репрессоры утрачиваются. В гибридной же клетке репрессоры подавляют активность теломеразных генов из обеих исходных клеток.
Слайд 57Теломераза и онкогенез
г) Однако не всегда в иммортализованных клетках обнаруживается теломеразная активность.
Примерно

в 25 % случаев длина теломер в таких клетках стабилизируется (иногда даже на уровне, превышающем нормальный), а активность теломеразы -отсутствует.
Очевидно, здесь действует один из альтернативных механизмов удлинения теломер (ALT).
Слайд 58Теломераза и онкогенез
д) В то же время иммортализацию ни в коем случае

нельзя сводить только к восстановлению теломер.
Для иммортализации же должны произойти и другие события - снижение или полное исчезновение активности определенных белков: например, р53 и pRb (участвующих в регуляции клеточного цикла в нормальных клетках), прохибитина (супрессора роста), ферментов репарации ДНК и т. д.
Причем в совокупности эти события не возвращают клетку к исходному («молодому») состоянию, а делают ее во многом иной. Поэтому нельзя считать их следствием удлинения теломер.
Слайд 59Теломераза и онкогенез
Удлинение теломер - лишь одно из ключевых событий иммортализации, необходимое:

без него иммортализация невозможна.
Но это не инициирующее событие, и тем более не достаточное.
Инициирующие события совсем иные: они придают клетке качества, еще не присущие ей в прежней истории.
Слайд 60Теломераза и онкогенез
Первичные опухоли
Были протестированы на теломеразную активность несколько тысяч образцов

опухолей человека.
В подавляющем большинстве (85 %) злокачественных новообразований обнаружена теломеразная активность. Некоторым исключением оказался ряд злокачественных опухолей головы, где фермент был выявлен лишь в 40-60 % случаев.
В доброкачественных опухолях частота обнаружения фермента в целом такая же, как в нормальных тканях (27%).
На этом основании теломеразу считают биохимическим маркером злокачественных опухолей человека.
Слайд 61Метилирование ДНК
Метилирование цитозина в ДНК эукариот
В ядрах (и митохондриях) эукариот существуют
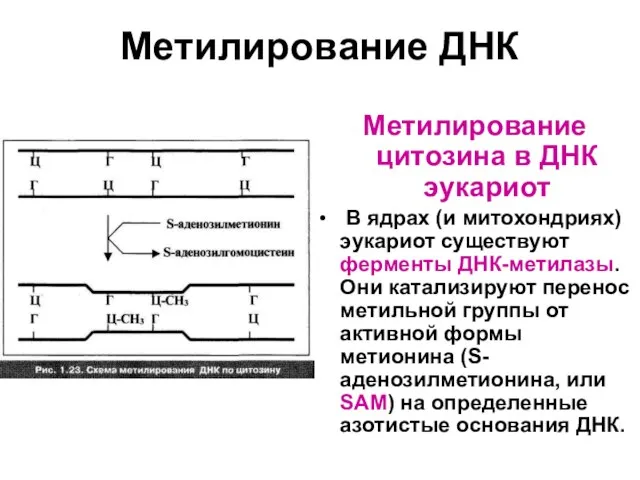
ферменты ДНК-метилазы. Они катализируют перенос метильной группы от активной формы метионина (S-аденозилметионина, или SAM) на определенные азотистые основания ДНК.
Слайд 62Метилирование ДНК
Долгое время у эукариот была известна лишь одна ДНК-метилаза; она метилирует
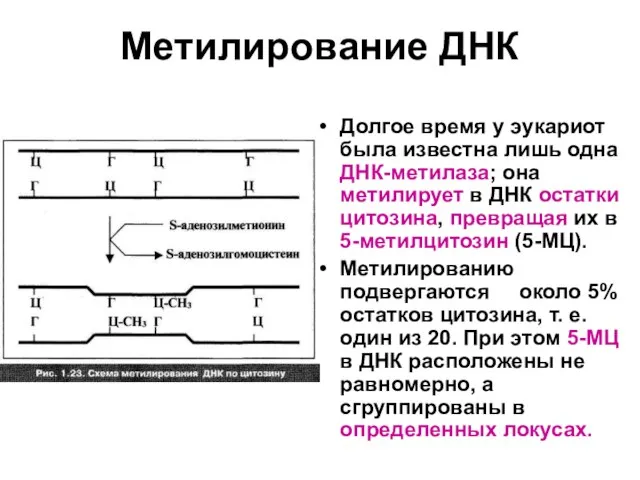
в ДНК остатки цитозина, превращая их в 5-метилцитозин (5-МЦ).
Метилированию подвергаются около 5% остатков цитозина, т. е. один из 20. При этом 5-МЦ в ДНК расположены не равномерно, а сгруппированы в определенных локусах.
Слайд 63Метилирование ДНК
К ним относятся центромерные отделы ДНК и промоторные последовательности отдельных генов
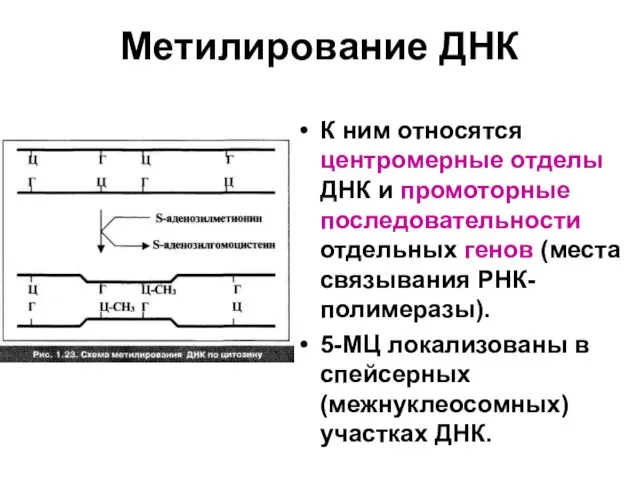
(места связывания РНК-полимеразы).
5-МЦ локализованы в спейсерных (межнуклеосомных) участках ДНК.
Слайд 64Метилирование ДНК
Другая аналогичная пара- урацил, тимин. Тимин комплементарно взаимодействует сильнее, чем урацил.
Цитозин
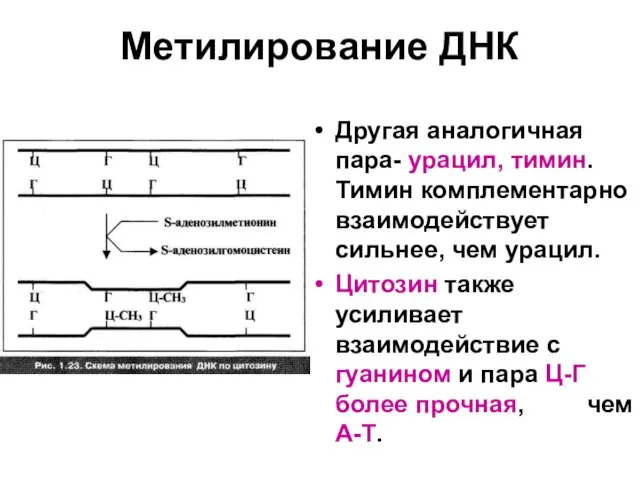
также усиливает взаимодействие с гуанином и пара Ц-Г более прочная, чем А-Т.
Слайд 67Метилирование ДНК
Активность ДНК-метилазы и содержание 5-МЦ в ДНК зависят от ряда

обстоятельств:
а) В культуре фибробластов по мере деления клеток, уровень 5-МЦ в ДНК и активность ДНК-метилазы снижаются. Одновременно уменьшается длина теломер.
б) С возрастом у животных и человека содержание 5-МЦ в ДНК снижается. Особенно это выражено в мозгу и сердце. Снижение 5-МЦ- одно из очень немногих прявлений старения на уровне ДНК.
Другое из таких проявлений - укорочение теломер в деляшихся клетках. На этом фоне падение уровня 5-МЦ представляется более универсальным возрастным событием.
Слайд 68Метилирование ДНК
в) Третья параллель касается опухолевой трансформации клеток. Эта трансформация сопровождается не

только появлением теломеразной активности, но и активацией ДНК-метилазы с возрастанием содержания 5-МЦ. Данный феномен наблюдается при иммортализации как in vitro, так и in vivo.
Но в случае трансформации in vitro вирусом SV40 между изменениями длины теломер и уровня 5-МЦ имеется различие.
Слайд 69Метилирование ДНК
Метилирование ДНК вовлечено в одно из начальных событий трансформации, которые

обеспечивают преодоление старения и лимита Хейфлика.
Метилирование ДНК, очевидно, не предупреждает развитие кризиса в культуре трансформированных клеток.
Восстановление уровня 5-МЦ - необходимое, но недостаточное условие опухолевого перерождения.
Но эти необходимые события совершаются на разных этапах трансформации: одно - на первом (при преодолении лимита Хейфлика), другое - на втором (при преодолении кризиса).
Слайд 70Функции метилирования ДНК
а) Участие в регуляции активности генов. Имеется положительная корреляция между

функциональной активностью клеток и содержанием 5-МЦ.
Наиболее метилированной является ДНК мозга и печени, в мозгу - ДНК больших полушарий и коры мозжечка. В процессе выработки условного рефлекса у крыс в ДНК коры и гиппокампа содержание 5-МЦ возрастает на 35-40 %. Гормональная стимуляция мозга дексаметазоном приводит к усилению синтеза РНК (рРНК) и увеличению степени метилированности ДНК.
Блокирование промоторных последовательностей, т. е. участков ДНК, которые предшествуют структурным генам и с которыми связываются молекулы РНК-полимеразы (осуществляющие синтез РНК). При связывании РНК-полимеразы должно происходить локальное расплетение ДНК, а метилирование затрудняет расхождение цепей.
Слайд 71Функции метилирования ДНК
Метилируются промоторы генов регуляторных белков ( р53), которые репрессируют
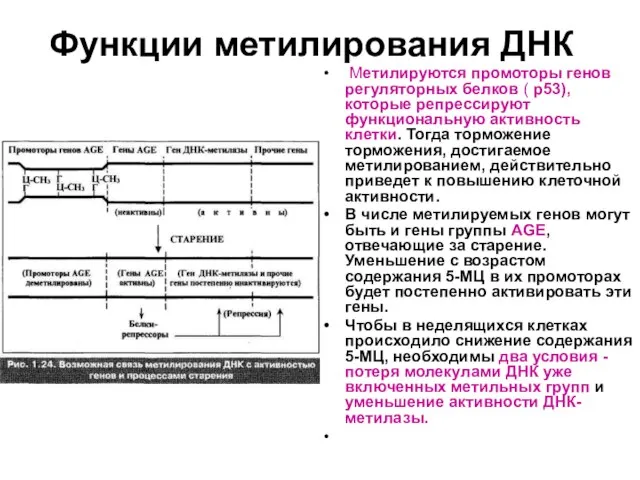
функциональную активность клетки. Тогда торможение торможения, достигаемое метилированием, действительно приведет к повышению клеточной активности.
В числе метилируемых генов могут быть и гены группы AGE, отвечающие за старение. Уменьшение с возрастом содержания 5-МЦ в их промоторах будет постепенно активировать эти гены.
Чтобы в неделящихся клетках происходило снижение содержания 5-МЦ, необходимы два условия - потеря молекулами ДНК уже включенных метильных групп и уменьшение активности ДНК-метилазы.
Слайд 72Функции метилирования ДНК
Исчезновение 5-МЦ осуществляется тремя способами:
истинное деметилирование, т. е. обратное превращение

5-МЦ в цитозин.
эксцизионное удаление 5-МЦ, т. е. вырезание из цепи ДНК небольшого фрагмента с 5-МЦ и замена его неметилированным участком -так, как это делает система репарации с повреждениями ДНК. Вариант этого способа - вырезание сразу двухцепочечного фрагмента - ферментом типа Са, Mg-зависимой эндонуклеазы.
гидролитическое дезаминирование 5-МЦ, которое может происходить неферментативным путем (спонтанно) и приводит к превращению 5-МЦ в обычное основание тимин. Комплементарная пара 5-МЦ-Г превращается в некомплементарную пару Т-Г.
Слайд 73Функции метилирования ДНК
Диметилирование приводит к активации генов супрессорных белков, то можно предположить,
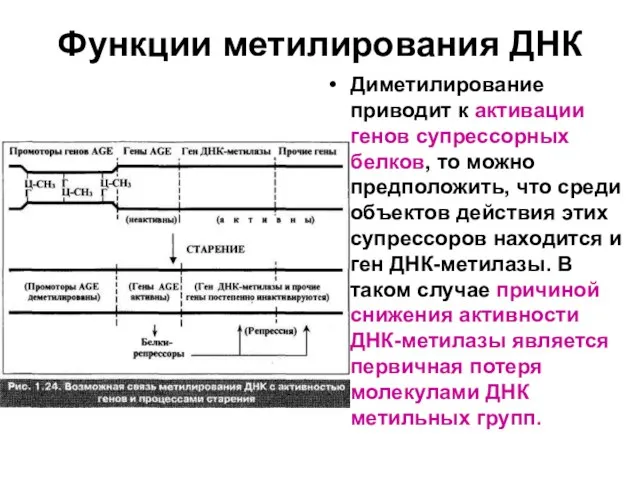
что среди объектов действия этих супрессоров находится и ген ДНК-метилазы. В таком случае причиной снижения активности ДНК-метилазы является первичная потеря молекулами ДНК метильных групп.
Слайд 74Функции метилирования ДНК
Образуется порочный круг: недометилированность ДНК снижает активность ДНК-метилазы.
Падение содержания
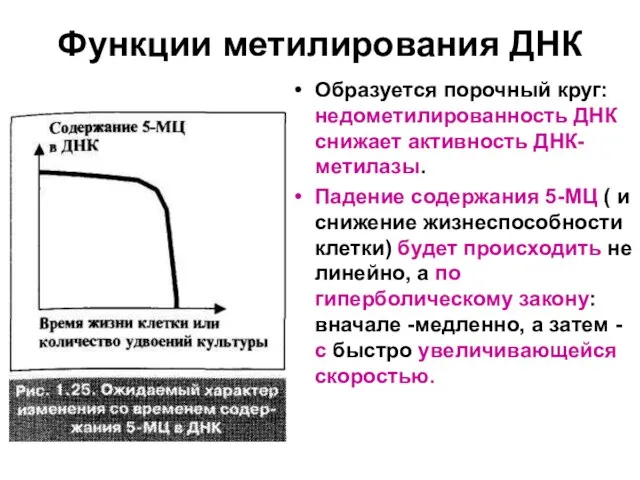
5-МЦ ( и снижение жизнеспособности клетки) будет происходить не линейно, а по гиперболическому закону: вначале -медленно, а затем - с быстро увеличивающейся скоростью.
Слайд 75Функции метилирования ДНК
В митотических клетках на баланс метильных групп влияет еще одно
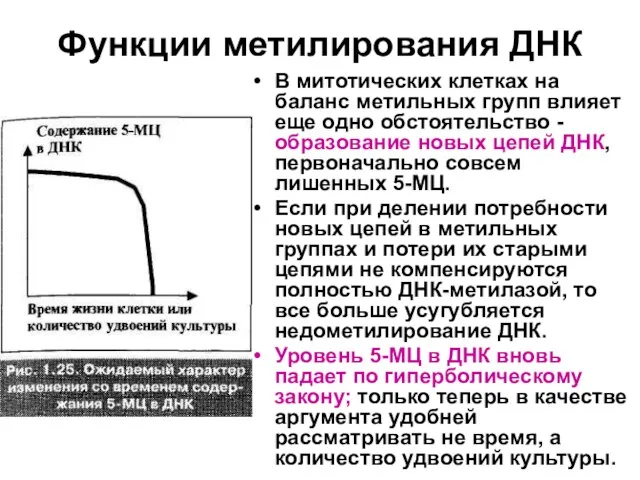
обстоятельство - образование новых цепей ДНК, первоначально совсем лишенных 5-МЦ.
Если при делении потребности новых цепей в метильных группах и потери их старыми цепями не компенсируются полностью ДНК-метилазой, то все больше усугубляется недометилирование ДНК.
Уровень 5-МЦ в ДНК вновь падает по гиперболическому закону; только теперь в качестве аргумента удобней рассматривать не время, а количество удвоений культуры.
Слайд 76Функции метилирования ДНК
При трансформации клеток ген ДНК-метилазы тем или иным способом необратимо

высвобождается из-под супрессорного действия генов AGE.
Поэтому уровень 5-МЦ в ДНК возрастает и стабилизируется - гены AGE блокируются, а функциональная активность клеток возрастает.
Клетки вновь оказываются способными к делению.
Но длина теломер продолжает укорачиваться. Требуется второе ключевое событие - активация теломеразы, которая происходит в незначительном числе клеток во время кризиса
Слайд 77Функции метилирования ДНК
б) Особенно богаты 5-метилцитозином центромерные отделы ДНК. Данные отделы

реплицируются не в S-фазе, а непосредственно перед расхождением хроматид - в начале анафазы митоза.
Можно предположить: метилирование центромерных областей предупреждает их преждевременную репликацию. Для репликации необходимо расплетение цепей ДНК, а высокая степень метилированности препятствует этому.
В начале же анафазы блок каким-то образом преодолевается - либо за счет включения более мощного расплетающего механизма, либо путем деметилирования.
Слайд 78Система рестрикции и модификации у бактерий
Функциональная роль метилирования ДНК у бактерий

была выяснена еще в 60-х годах XX века
Бактериальная ДНК-метилаза входит в систему рестрикции и модификации. Второй компонент этой системы - особый вид эндонуклеаз, рестриктазы.
Весной 1974 года, когда о генной инженерии еще мало кто думал, группа известных западных ученых опубликовала письмо-обращение. В нем указывалось на потенциальные опасности зарождающегося научного направления и содержался призыв наложить мораторий на соответствующие исследования. Письмо сыграло прямо противоположную роль: интерес к данной тематике резко увеличился, и количество работ по рестриктазам, другим эндонуклеазам, а также ДНК-метилазам стало расти.
Слайд 79Система рестрикции и модификации у бактерий
Принцип функционирования системы
Ключевая особенность бактериальных ДНК-метилаз

и эндонуклеаз (рестриктаз) состоит в том, что данные ферменты являются сайт-специфичными.
Они узнают в молекулах ДНК строго определенные сайты - последовательности из 4-6 нуклеотидных пар. И только при наличии таких сайтов осуществляют свое действие.
Слайд 80Система рестрикции и модификации у бактерий
При этом метилаза ДНК, узнав «свой» сайт,

метилирует в нем опять-таки строго определенный нуклеотид. Чаще всего метилированию подвергается аденин по аминогруппе, в результате чего образуется 6-N-метиладенин, или 6-N-метиламинопурин (6-МАП). Реже происходит превращение цитозина в 5-метилцитозин (5-МЦ). Донором метильной группы всегда является S-AM (S аденозил метионин).
Метилирование сайта предупреждает воздействие на ДНК рестриктазы с той же сайт-специфичностью. Поэтому собственная ДНК бактерии не подвергается разрушению рестриктазой.
Слайд 81Система рестрикции и модификации у бактерий
Проникшая в клетку чужеродная (вирусная) ДНК не

защищена в этих локусах. ДНК будет расщеплена на несколько фрагментов, что лишит ее биологической активности.
Система рестрикции и модификации служит для защиты бактерий от вирусов (бактериофагов). А роль метилирования - мечение своей ДНК в строго определенных местах.
Сайт-специфичность ДНК-метилазы и рестриктазы у каждого вида и даже штамма бактерий своя. Разные пары ферментов (ДНК-метилаза и рестриктаза) настроены на узнавание разных сайтов.
Некоторые бактерии имеют сразу несколько систем с разной сайт-специфичностью.
Слайд 82Действие ДНК-метилаз и рестриктаз
Сразу после репликации дочерние молекулы ДНК содержат метильные группы

лишь в «старых» (родительских) цепях. Этого достаточно, чтобы защитить соответствующие сайты от рестриктаз.
Вскоре метилируются сайты и новых цепей ДНК. Это обеспечивает целостность будущего «поколения» ДНК, которое образуется после репликации в дочерних клетках.
Слайд 83Система рестрикции и модификации у бактерий
У бактерий метилирование собственной ДНК происходит вскоре

после ее репликации и затрагивает лишь новообразованные цепи.
Рестриктаза наносит два одноцепочечных разрыва - в самом сайте или на определенном расстоянии от него. В результате линейная ДНК расщепляется на n+1 фрагментов, где n - количество в молекуле сайтов данного вида.
Различают два типа систем рестрикции и модификации:
Системы типа I. Функционирует единый ферментный комплекс, включающий три субъединицы - сайт-узнающую, метилирующую и рестриктирующую. Разрыв же чужеродной ДНК осуществляется на сравнительно большом расстоянии (порядка 1000 н. п.) от сайта узнавания (и метилирования) и в произвольном месте.
Слайд 84Система рестрикции и модификации у бактерий
Системы типа II .
сайты являются палиндромами,

т. е. читаются одинаково
с обеих сторон (с учетом полярности цепей);
метилаза и рестриктаза - отдельные ферменты;
гидролиз производится в области сайта узнавания (и метилирования), в строго определенном месте;
места гидролиза на обеих цепях ДНК не вполне
совпадают, отчего образующиеся фрагменты ДНК имеют т. н. «липкие» концы (небольшие одноцепочечные участки, способные к спариванию).
Слайд 85Система рестрикции и модификации у бактерий
Именно рестриктазы типа II стали незаменимым

инструментом в генно-инженерных работах.
Места их действия на ДНК строго определенны, с их помощью можно производить фрагментирование исследуемой ДНК с «хирургической» точностью.
Наличие же у образующихся фрагментов «липких» концов облегчает их «сшивание» с другими молекулами ДНК.
Слайд 86Система рестрикции и модификации у бактерий
Как же при наличии у бактерий

такой защитной системы бактериофаги все-таки сохраняются в природе?
Системы защиты (репарационная, антиоксидантная и пр.), и данная система тоже не является абсолютной.
При попадании в бактерии фаговая ДНК в большинстве случаев разрушается.
В 1 случае из 105 она успевает прометилироваться бактериальной ДНК-метилазой.
Она становится «своей» для рестриктазы и реплицируется в клетке. Фаговые ДНК несут на своих «старых» цепях метильные группы, защищены от рестрикции и поэтому вновь подвергаются метилированию.
Все потомки бактериофага становятся резистентными к рестриктазам данного штамма бактерий. Это позволяет им беспрепятственно размножаться в других клетках этого штамма.
Слайд 87Метилирование ДНК, связанное с репарацией ошибок репликации
Имеется еще один вид метилирования ДНК,

связанный сразу и с репликацией, и с репарацией ДНК.
Акцептором метильной группы в ДНК при этом является пуриновое основание: у бактерий - аденин, находящийся в последовательности ГАТЦ; у эукариот - гуанин. Образуются, соответственно, 6-N-метиладенин и 6-0-метилгуанин.
Эти основания служат «метками» родительской цепи при репарации ошибок репликации.
Второй уровень контроля - специальная система репарации.
Если в дочерней цепи все-таки оказывается «неправильный» (с точки зрения комплементарности) нуклеотид, то это вызывает нарушение структуры двойной спирали, что распознается указанной системой.
Слайд 88 Метилирование ДНК, связанное с репарацией ошибок репликации
Система должна распознать - какая

из цепей является родительской (правильной), а какая - дочерней.
Репарационный комплекс начинает перемещаться по дуплексу ДНК, пока не находит на одной из цепей неметилированную последовательность (5')ГАТЦ(3') (у бактерий). Отсюда следует, что данная цепь - новосинтезированная.
«Выяснив» это, репарационный комплекс разрывает здесь указанную цепь и начинает обратное движение к месту дефекта спиральной структуры, последовательно отщепляя от новой цепи нуклеотиды - за счет 3‘-5'-экзонуклеазной активности.
Слайд 89 Метилирование ДНК, связанное с репарацией ошибок репликации
После того как будет пройдено

место ошибки, ферментный комплекс останавливается, а в дочерней цепи оказывается большая брешь (порой в несколько тысяч нуклеотидов) - от места разрыва цепи до места ошибки.
Эта брешь застраивается за счет включения ДНК-полимеразной активности.
Ферментный комплекс (или только его ДНК-полимеразный компонент) перемещается теперь в противоположном направлении - от места исправленной ошибки к месту первоначального разрыва дочерней цепи.
Слайд 90Метилирование ДНК, связанное с репарацией ошибок репликации
Завершает репарацию ДНК-лигаза образующая межнуклеотидную связь

в месте разрыва.
Репарационный комплекс, исправляющий ошибки репликации, при обнаружении одной такой ошибки совершает по ДНК трехкратное перемещение:
от места дефекта к месту, позволяющему идентифицировать цепи,
назад к месту ошибки,
к идентификационному локусу.
Ключевую же роль в идентификации цепей играет наличие или отсутствие в соответствующем месте метильной группы.
Слайд 91Метилирование ДНК, связанное с репарацией ошибок репликации
Но после того, как репликация всей

ДНК и ее проверка репарационной системой будут завершены новые цепи ДНК также должны подвергаться данному виду метилирования. Тогда в очередной S-фазе они смогут распознаваться как «старые», а значит «правильные», цепи.
У эукариот наличие метилирования ДНК, связанного с репарацией ошибок репликации, выяснено достаточно определенно.
Слайд 92Репарация повреждений ДНК
В клетках происходит репарация разнообразных повреждений ДНК, постоянно появляющихся

под действием всевозможных факторов.
Возможные повреждения ДНК
Агенты, вызывающие повреждения ДНК разнообразны: внешние облучения (ультрафиолетовое, инфракрасное, радиоактивное и пр.), самопроизвольные локальные изменения температуры, свободные радикалы, химические мутагены и т. д.
Нередко есть связь между природой повреждающего воздействия и характером повреждений ДНК.
Повреждения можно подразделить на два основных типа: повреждения оснований и повреждения цепей.
Слайд 93Репарация повреждений ДНК
Повреждения оснований
а) Гидролитическое выщепление оснований: происходит
спонтанно, а также под действием

вышеперечисленных факторов. Особенно велика скорость выщепления пуриновых оснований. В среднем за сутки в диплоидной клетке молекулы ДНК теряют 5х104таких оснований.
Если бы эти потери не репарировались, то за 70 лет в каждой неделящейся клетке организма молекулы ДНК лишились бы примерно 25% своих пуриновых оснований. Клетки потеряли бы свою жизнеспособность задолго до этого срока.
Не менее драматичными были бы последствия и в делящихся клетках. Если бы сохранялся хотя бы один депуринизированный нуклеотид, то после репликации ДНК одна из дочерних цепей была бы лишена в данном месте уже целого нуклеотида. А после второй репликации появлялись бы молекулы ДНК, лишенные нуклеотидной пары. Что меняло бы весь смысл генетической информации за поврежденным местом.
Слайд 94Репарация повреждений ДНК
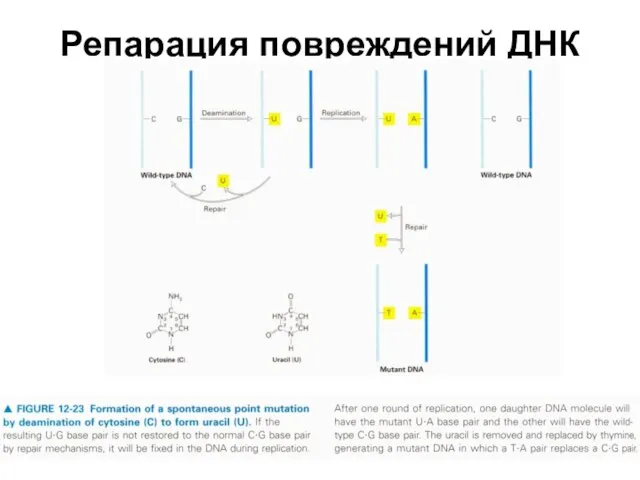
б) Гидролитическое дезаминирование оснований. В данном случае теряется не целое основание,

а только его аминогруппа. В ходе такого процесса происходит следующее:
цитозин превращается в урацил - основание, которое в нормальных условиях содержится только в РНК;
5-метилцитозин превращается в тимин - обычное основание ДНК;
аденин превращается в гипоксантин - основание,
не встречающееся в норме ни в ДНК, ни в РНК.
Такие переходы меняют генетический смысл локуса. В частности, урацил и тимин комплементарны уже не гуанину (как цитозин и 5-МЦ), а аденину. Это будет проявляться при синтезе РНК или ДНК.
Слайд 95Репарация повреждений ДНК
в) Образование димеров тимина. Инициируется ультрафиолетовым облучением и происходит там, где

два тимидиловых нуклеотида соседствуют в цепи ДНК.
При этом между их основаниями замыкаются две ковалентные связи. В результате в данном локусе ДНК нарушаются структура двойной спирали и способность последней участвовать в синтезе ДНК и РНК.
Слайд 96Репарация повреждений ДНК
Повреждения цепей ДНК
а) Одноцепочечные разрывы: между соседними нуклеотидами цепи ДНК

разрывается фосфодиэфирная связь (т. е. связь между фосфатной группой и дезоксирибозой). Особенно часто это происходит под влиянием рентгеновского и радиоактивного облучения. К такому же последствию может привести происшедшее до того выщепление азотистого основания из цепи ДНК.
При накоплении в ДНК большого количества разрывов нарушается структура хромосом - появляются т. н. хромосомные аберрации (видимые повреждения хромосом).
Слайд 97Репарация повреждений ДНК
б) Поперечные сшивки. Это ковалентные связи двух видов:
ДНК-ДНК, т. е.

между основаниями двух цепей ДНК;
ДНК-белок, т. е. между цепью ДНК и каким-либо белком хромосомы.
Такие сшивки блокируют в данном локусе синтез ДНК и РНК, поскольку в обоих этих процессах требуется расхождение цепей ДНК.
Даже локальные повреждения структуры ДНК могут приводить к очень серьезным последствиям. Этим и объясняется наличие в клетках разнообразных систем репарации ДНК, специализирующихся на устранении определенных повреждений.
Слайд 100Примеры репарации ДНК
Общий принцип репарации ДНК основан на том, что вероятность одновременного

повреждения в одном локусе сразу обеих цепей весьма мала. Поэтому одна из цепей (неповрежденная) может служить в качестве матрицы при восстановлении нормальной структуры поврежденной цепи.
Удаление тиминовых димеров: репарация с эксцизией участка цепи
У растений и бактерий тиминовые димеры могут удаляться с помощью прямой фоторепарации. Ее осуществляет фермент, который, используя энергию света, просто разрывает ковалентные связи между остатками тимина.
У бактерий существует и другой механизм; видимо, аналогичный способ используется у животных и человека. Его суть:
вырезание (эксцизия) из поврежденной цепи фрагмента,
содержащего тиминовый димер, и
ресинтез аналогичного фрагмента de novo.
Слайд 101Вырезание (эксцизия) из поврежденной цепи фрагмента
Фермент (эксцинуклеаза), находит место повреждения и
разрывает
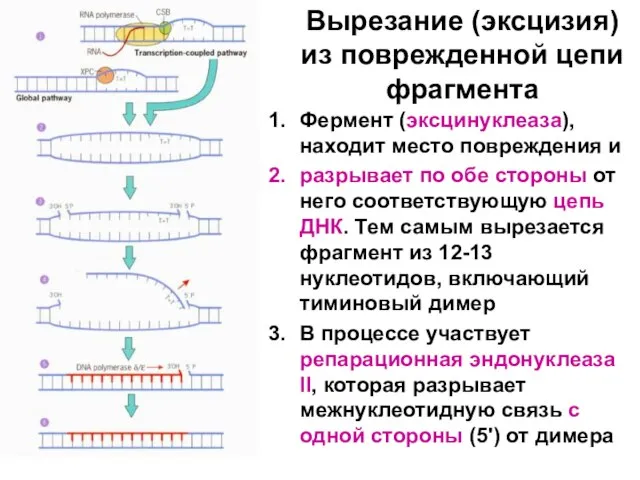
по обе стороны от него соответствующую цепь ДНК. Тем самым вырезается фрагмент из 12-13 нуклеотидов, включающий тиминовый димер
В процессе участвует репарационная эндонуклеаза II, которая разрывает межнуклеотидную связь с одной стороны (5') от димера
Слайд 1024. Затем специальная экзонуклеаза поочередно отщепляет до 100 нуклеотидов.
5. Ресинтез фрагмента осуществляется
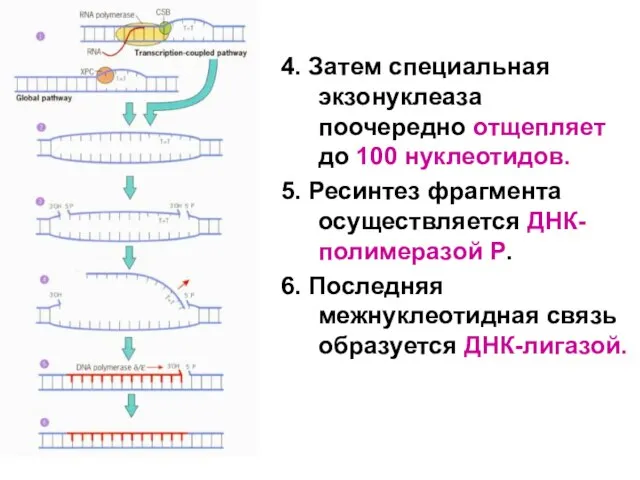
ДНК-полимеразой Р.
6. Последняя межнуклеотидная связь образуется ДНК-лигазой.
Слайд 103Примеры репарации ДНК
Иногда встречаются генетические дефекты данной репарационной системы. Одна из таких
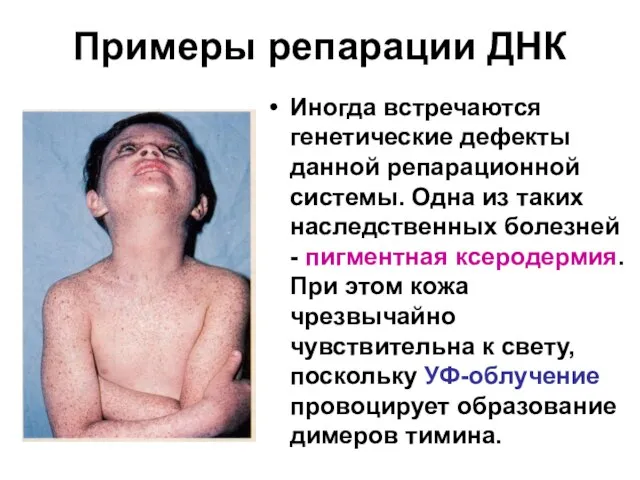
наследственных болезней - пигментная ксеродермия. При этом кожа чрезвычайно чувствительна к свету, поскольку УФ-облучение провоцирует образование димеров тимина.
Слайд 104Преждевременное старение
Другой вариант - синдром преждевременного старения;
Это подверждает предположение о том,

что и нормальное старение связано с ослаблением деятельности систем репарации ДНК (равно как и других защитных систем).
Слайд 105Примеры репарации ДНК
Удаление остатков урацила и репарация участков, лишенных основания
1. Остатки

урацила появляются в ДНК в результате гидролитического дезаминирования цитозина.
В репарации принимают участие 5 ферментов, из которых первый специфичен в отношении только данных нарушений.
2. Это урацил-ДНК-гликозидаза: обнаруживая урацил в ДНК, она выщепляет его путем разрыва связи с пентозо-фосфатным остовом цепи. Образуется апиримидиновый сайт. (Продолжается от 2 до 24 ч)
Слайд 106Примеры репарации ДНК
3. Репарационная эндонуклеаза I расщепляет остов по месту отсутствия основания.

По некоторым сведениям, апиримидиновые и апуриновые локусы узнаются разными эндонуклеазами.
4. Затем экзонуклеаза отщепляет оставшийся дезоксирибозофосфат и, возможно, еще 1-2 нуклеотида. Таким образом, в отличие от репарации тиминовых димеров, здесь размер выщепляемого участка поврежденной цепи очень мал.
Далее ДНК-полимераза β достраивает репарируемую цепь (т. е. включает 1-3 нуклеотида),
ДНК-лигаза сшивает ее.
По сравнению с предыдущим типом репарации (продолжающимся от 2 до 24 ч), данный процесс занимает гораздо меньше времени - от 5 мин до 2 ч.
Слайд 107Примеры репарации ДНК
Однако тот же механизм не может исправлять сходное повреждение -

дезаминирование 5-метилцитозина с образованием тимина. Действительно, тимин - нормальное основание ДНК, и не существует фермента, настроенного на его выщепление.
Репарация могла бы быть основана лишь на узнавании дефекта спаривания в паре Т-Г (заменившей пару 5-МЦ-Г) - примерно так же, как это происходит при репарации ошибок репликации. Но функционирует ли этот механизм вне S-фазы, неясно. Поэтому некоторые авторы считают, что дезаминирование 5-МЦ не репарируется.
Спонтанное дезаминирование 5-МЦ в половых клетках, как бы редко оно ни происходило, меняет генетический смысл соответствующих локусов ДНК, и это передается в генотип потомства.




































































































 Сервис Мечты
Сервис Мечты Основи формування і реєстраціi корисного сигналу в діапазоні
Основи формування і реєстраціi корисного сигналу в діапазоні Комплексная система автоматизации
Комплексная система автоматизации Телепорт
Телепорт Осторожно! Сосульки
Осторожно! Сосульки ПРЕОБРАЗОВАНИЕ ЭЛЕКТРОМАГНИТНЫХ ВОЛН В ПОЛЕ УСКОРЕНИЙ
ПРЕОБРАЗОВАНИЕ ЭЛЕКТРОМАГНИТНЫХ ВОЛН В ПОЛЕ УСКОРЕНИЙ Примеры комбинаторных задач (9 класс)
Примеры комбинаторных задач (9 класс) Решение логических задач из курса кибернетики
Решение логических задач из курса кибернетики Бедность
Бедность Nocturnal eczema: Review of sleep and circadian rhythms
Nocturnal eczema: Review of sleep and circadian rhythms Microsoft Office Word 2007
Microsoft Office Word 2007 Международное сотрудничество в освоении космического пространства
Международное сотрудничество в освоении космического пространства Золото
Золото Презентация на тему Загадки о диких животных
Презентация на тему Загадки о диких животных Королева оркестра
Королева оркестра Экологическое просвещение в творчествеВладимира Алексеевича Чивилихина
Экологическое просвещение в творчествеВладимира Алексеевича Чивилихина Ҳозирги замон ҳуқуқи ва унинг моҳияти ҳақидаги концепциялар
Ҳозирги замон ҳуқуқи ва унинг моҳияти ҳақидаги концепциялар Образ Чичикова в поэме "Мертвые души"
Образ Чичикова в поэме "Мертвые души" Табір "Світанок"
Табір "Світанок" Презентация на тему Уфа – столица Башкортостана
Презентация на тему Уфа – столица Башкортостана Онтология
Онтология  Источники загрязнения окружающей среды
Источники загрязнения окружающей среды Project_A
Project_A Типы связи слов в словосочетании
Типы связи слов в словосочетании Всероссийский флешмоб Голубь мира
Всероссийский флешмоб Голубь мира Работа головного мозга находится в прямой зависимости от качества нашего питания, чем оно лучше, тем выше наши интеллектуальные во
Работа головного мозга находится в прямой зависимости от качества нашего питания, чем оно лучше, тем выше наши интеллектуальные во БИОСИНТЕЗ
БИОСИНТЕЗ Сусымалы компоненттерді мөлшерлеу мен қоспалау желісі. Дарис 12
Сусымалы компоненттерді мөлшерлеу мен қоспалау желісі. Дарис 12