Слайд 2В настоящее время под изоморфизмом понимают несколько явлений:
1) сходство кристаллических форм;

2) способность изоструктурных (изотипных) веществ образовывать неограниченные (совершенный изоморфизм) или ограниченные (несовершенный изоморфизм) твердые растворы;
3) способность материальных частиц (атомов, ионов, молекул) замещаться другими материальными частицами в кристаллических структурах (изоморфное замещение);
4) способность веществ образовывать смешанные кристаллы с той или иной степенью упорядочения компонентов (твердые растворы, аномальный изоморфизм и пр.).
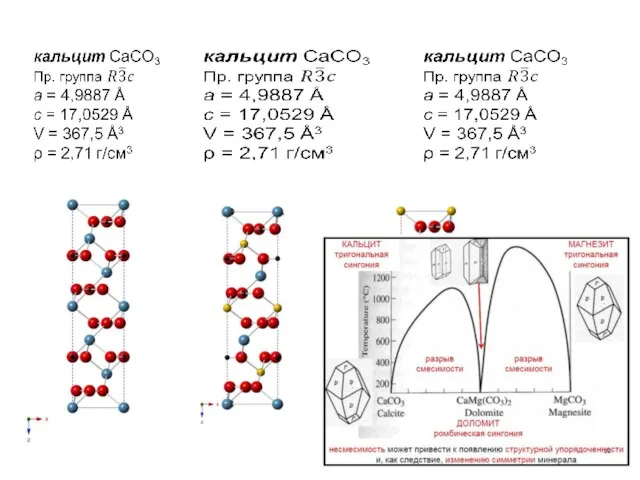
Слайд 3Изовалентный изоморфизм
Форстерит Mg2SiO4 Фаялит Fe2SiO4
Пр. группа Pbnm
a = 4.753 Å a =

4.818 Å
b = 10.190 Å b = 10.470 Å
c = 5.978 Å c = 6.086 Å
Z = 4
Vc = 289.53 Å3 Vc = 307.00 Å3
KCl KBr
a = 6.29 Å a = 6.60 Å
Слайд 7Всю совокупность гетеровалентных замещений можно разбить на два основных подтипа:
без изменения общего

числа атомов в э.я (собственно гетеровалентный изоморфизм);
с изменением числа атомов (гетеровалентный изодиморфизм).
– непрерывный ряд твердых растворов с изменением числа атомов в эквивалентных структурных позициях (по той же схеме его можно назвать гетеровалентным изопозиционным изоморфизмом с изменением состава);
– также с изменением числа атомов и изменением заселенности разных структурных позиций
Обязательное условие – баланс (или компенсация) валентности (заряда) при изоморфных замещениях
Слайд 8 При сохранении числа атомов возможны три вида компенсации валентности:
сопряженное замещение в катионной

и анионной подрешетках с одновременным изменением валентности катиона и аниона (примеры: Zn2+S2––Ga 3+ As3–, K2BeF4–K2SO4, KNbO3–KMgF3);
замещение двух атомов одного сорта в эквивалентных структурных позициях на два различных атома с той же суммарной валентностью (2SnO2–FeNbO4; Fe2O3–FeTiO3; 2PbS–AgBiS2);
замещение двух пар различных атомов в неэквивалентных структурных позициях с одинаковой суммарной валентностью (ряд плагиоклазов NaAlSi3O8–CaAl2Si2O8; пироксены CaMgSi2O6–NaFeSi2O6).
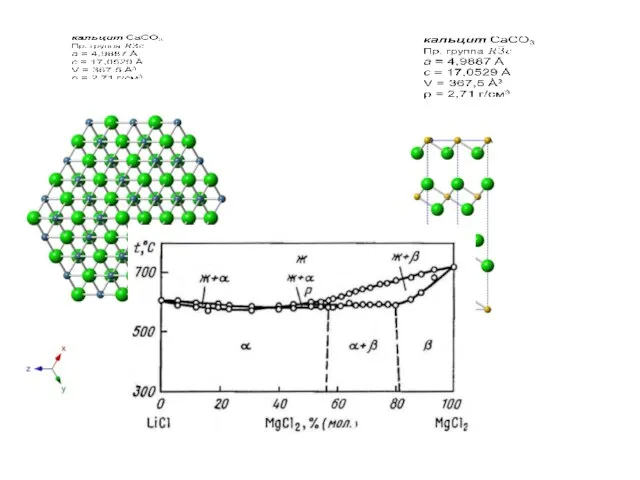
Слайд 9Замещения с изменением числа атомов в ячейке распадаются на два основных вида:

с вычитанием (образование вакансий);
с внедрением (заселением интерстиций) – по Гольдшмидту, «с заполнением пространства».
2Li+ – Mg2+ + v (LiCl – MgCl2),
3Mg2+ – 2Al3+ + v (в биотите)
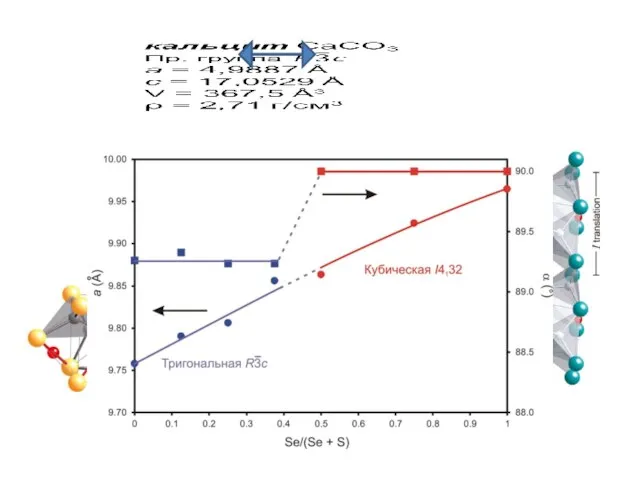
Слайд 11Эмпирические правила изоморфизма
Правило аддитивности размеров э.я. твердого раствора (Вегарда):
a = x1a1 +

x2a2,
где х1 и х2 – мольные доли, и а1 и а2 – параметры э.я. чистых компонентов.
Правило Ретгерса:
V = x1V1 + x2V2,
где V, V1 и V2 – мольные объемы твердого раствора и чистых компонентов.
a = x1a1 + x2a2 + x1x2δ,
где δ – некоторый параметр, который может иметь знак как плюс, так и минус.
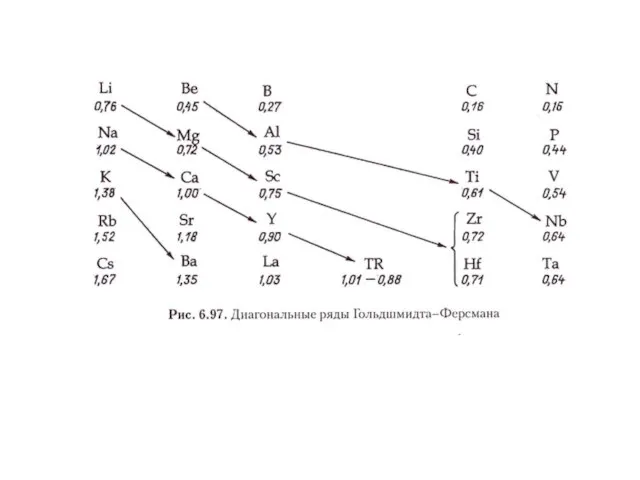
Слайд 12Основные правила изоморфизма (Гольдшмидта)
Изоморфные примеси образуются в широких пределах при температурах, лежащих

далеко от точки плавления, если ионные радиусы взаимозамещающичся структурных единиц различаются не более чем на 15% (от меньшего значения).
Ион с меньшим радиусом будет входить в общую кристаллическую структуру легче, чем ион с большим радиусом, занимающий ту же позицию (правило полярности).
Слайд 14Принцип Ле-Шателье - внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит

к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Слайд 15Нестехиометрические соединения
Нестехиометрическими называются промежуточные фазы переменного состава, образующиеся в двух-, трех- и
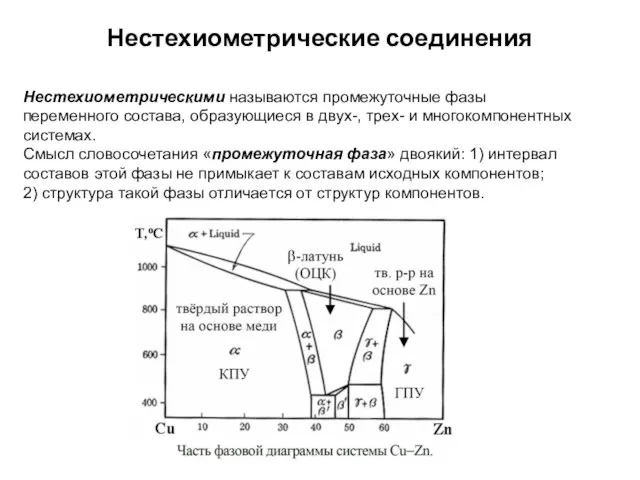
многокомпонентных системах.
Смысл словосочетания «промежуточная фаза» двоякий: 1) интервал составов этой фазы не примыкает к составам исходных компонентов;
2) структура такой фазы отличается от структур компонентов.
Слайд 16Соединения переменного состава можно разделить на два типа: дальтониды, интервалы гомогенности которых
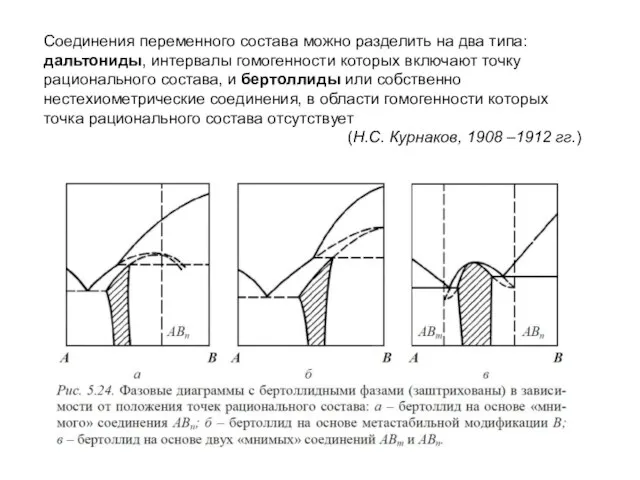
включают точку рационального состава, и бертоллиды или собственно нестехиометрические соединения, в области гомогенности которых точка рационального состава отсутствует
(Н.С. Курнаков, 1908 –1912 гг.)
Слайд 17Дефектные оксиды кобальта и железа со структурой NaCl:
Co1-xO (0 ≤ x
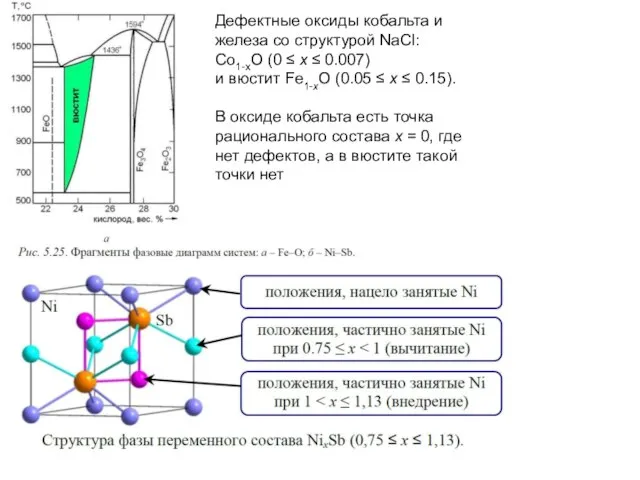
≤ 0.007)
и вюстит Fe1-xO (0.05 ≤ x ≤ 0.15).
В оксиде кобальта есть точка рационального состава x = 0, где нет дефектов, а в вюстите такой точки нет











 Вводный инструктаж по технике безопасности на уроках физической культуры
Вводный инструктаж по технике безопасности на уроках физической культуры ВПР по математике 5 класс
ВПР по математике 5 класс Философия мечты
Философия мечты Неформальные движения молодёжи
Неформальные движения молодёжи Чувство прекрасного
Чувство прекрасного Концептуальные основы корпоративной социальной ответственности
Концептуальные основы корпоративной социальной ответственности  Потолочная система охлаждения панельного типа Uponor Comfort
Потолочная система охлаждения панельного типа Uponor Comfort Тема 1.1.Организация производства как система научных знаний
Тема 1.1.Организация производства как система научных знаний Кафтан Урок №4
Кафтан Урок №4 Көксерек в театре
Көксерек в театре Моря Атлантического океана
Моря Атлантического океана Сходство и различие фразеологизмов и пословиц
Сходство и различие фразеологизмов и пословиц Кинесика как составной элемент невербальной коммуникации
Кинесика как составной элемент невербальной коммуникации Правовое регулирование оборота земель сельскохозяйственного назначения
Правовое регулирование оборота земель сельскохозяйственного назначения Гражданственность
Гражданственность Естественный ядерный реактор Окло
Естественный ядерный реактор Окло Презентация на тему Реки России
Презентация на тему Реки России План местности. Условные знаки
План местности. Условные знаки 10 години в 10 минути Христина Машкова “Четиринадесети рекламен форум”
10 години в 10 минути Христина Машкова “Четиринадесети рекламен форум” Моё блюдо: Яичница с овощами
Моё блюдо: Яичница с овощами Энде Михаэль Андреас Гельмут 1929-1995
Энде Михаэль Андреас Гельмут 1929-1995 Изменение состояния региональной гемодинамики у больных с ОАСНК с различной тяжестью ишемии нижних конечностей при лечении мето
Изменение состояния региональной гемодинамики у больных с ОАСНК с различной тяжестью ишемии нижних конечностей при лечении мето Русская кухня
Русская кухня Решение задач
Решение задач Исследование статической устойчивости асинхронной нагрузки при питании их от шин бесконечной мощности
Исследование статической устойчивости асинхронной нагрузки при питании их от шин бесконечной мощности Презентация на тему Инфаркт миокарда
Презентация на тему Инфаркт миокарда  Lecture 1
Lecture 1 Правда или ложь
Правда или ложь