Содержание
- 2. ПЛАН: 1. КАЛЬЦИЙ – КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ 2. НЕМНОГО ОБ ИСТОРИИ… 3. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. 4.
- 3. В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко обрабатываемые камни, в первую очередь
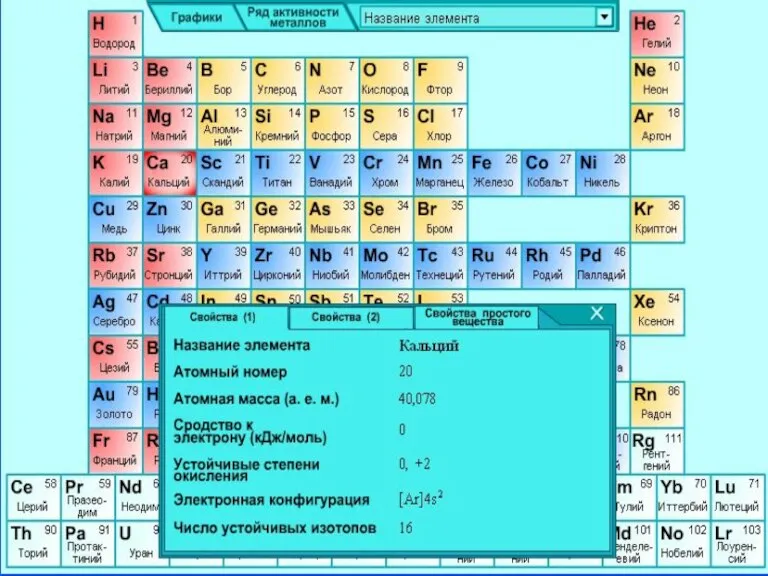
- 4. Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca 48Ca, из которых наиболее
- 6. Вильгельм Бунзен Немецкий химик. Разработал ряд методов исследования химических веществ. Получил посредством электролиза кальций, марганец, магний
- 7. В биосфере происходит исключительно резкая дифференциация Ca, связанная главным образом с "карбонатным равновесием": при взаимодействии углекислого
- 8. Эта реакция обратима и является основой перераспределения Ca. При высоком содержании CO2 в водах Ca находится
- 9. КАЛЬЦИЙ СОДЕРЖИТСЯ В ГОРНЫХ ПОРОДАХ .
- 10. В солончаках и соленых озерах часто накапливается гипс Ca SO4*2H2O
- 11. Реки приносят в океан много кальция (0,04%), который концентрируется в скелетах организмов.
- 12. Он присутствует во всех тканях и жидкостях живых организмов.
- 13. Залежи кальция - в соляных наплывах
- 14. СТАЛАГМИТ
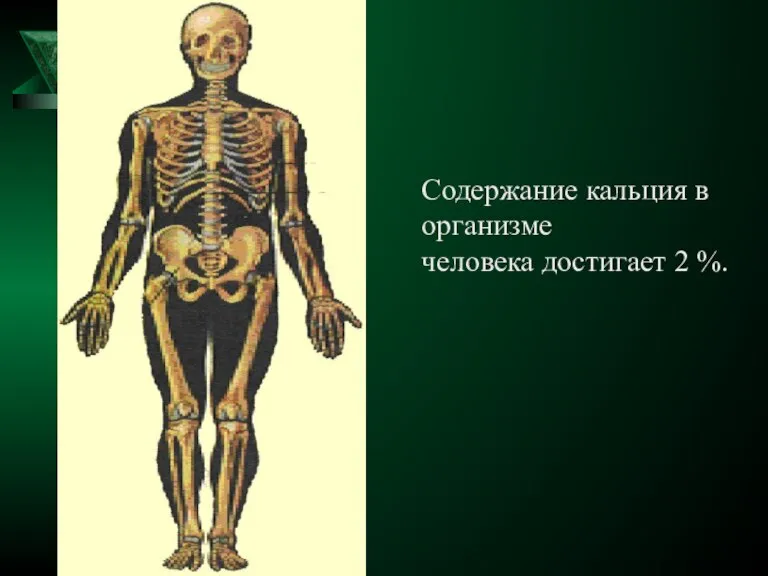
- 15. Содержание кальция в организме человека достигает 2 %.
- 16. СТАЛАГМИТ
- 17. Бетон – важнейший строительный материал наших дней, одной из составных частей которого является кальций.
- 18. ФИЗИЧЕСКИЕ СВОЙСТВА 1.Имеет металлическую кристаллическую решётку. 2.Атомный радиус - 1,97. 3.Ионный радиус Са2+- 1,04. 4.Плотность –
- 19. Химические свойства Кальций в результате реакции отдает 2 электрона, т.е. окисляется: Ca2+ – 2е → Caо
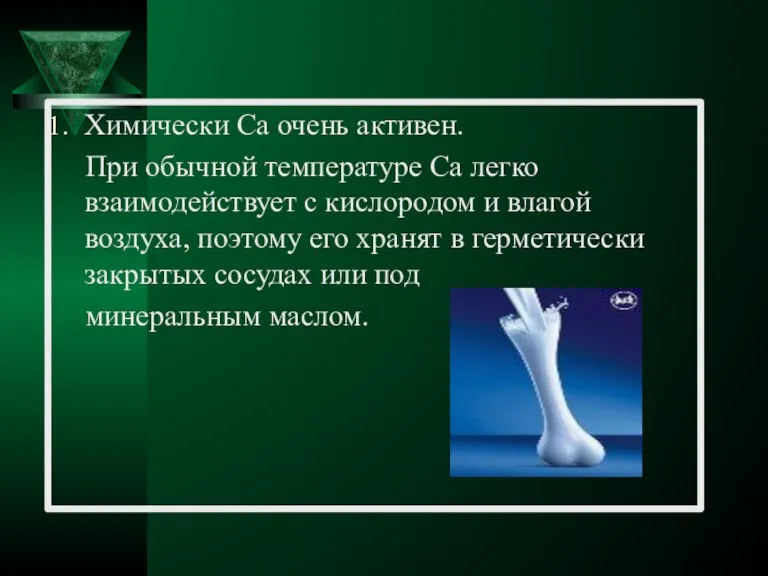
- 20. Химически Ca очень активен. При обычной температуре Ca легко взаимодействует с кислородом и влагой воздуха, поэтому
- 21. Кальций взаимодействие с простыми веществами – неметаллами. Ca + 2 C = CaC2 карбид кальция 2.
- 22. - С фтором реагирует на холоду: Са+|F2 = CaF2 -C хлором и бромом при температуре свыше
- 23. Трудно вступают в реакцию с азотом и фосфором: ЗСа + N2 = Са3N2 (нитрид магния) ЗСа
- 24. Получение и применение. В промышленности кальций получают двумя способами: 1.Нагреванием брикетированной смеси СаО и порошка Al
- 26. Скачать презентацию




















 АСВ-Техникс
АСВ-Техникс Проект по восстановлению мест гнездования балобана в Республике Тува
Проект по восстановлению мест гнездования балобана в Республике Тува Воздушные компрессора Patriot
Воздушные компрессора Patriot Автоматизированная система учета помещений ВУЗа
Автоматизированная система учета помещений ВУЗа Программное обеспечение персонального компьютера
Программное обеспечение персонального компьютера Производственная логистика
Производственная логистика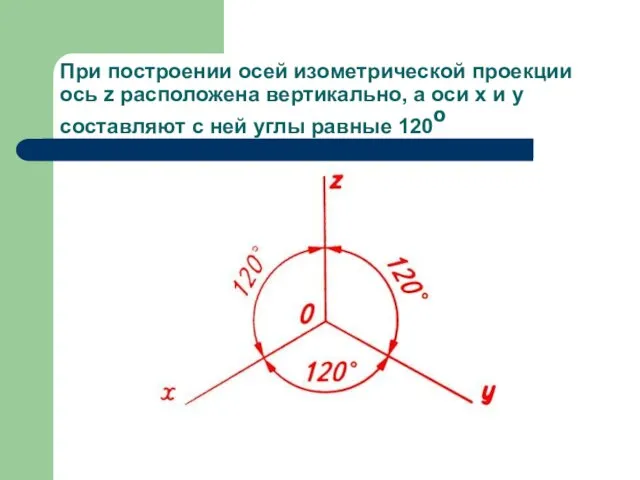 Изометрическая проекция детали
Изометрическая проекция детали Подготовка и организация строительства
Подготовка и организация строительства Управление дебиторкой
Управление дебиторкой Морозова Ольга Васильевна
Морозова Ольга Васильевна Введение в специальность
Введение в специальность Демографическая ситуация в России (11 класс)
Демографическая ситуация в России (11 класс) Научные интенсивы. Шаблон для защиты проекта
Научные интенсивы. Шаблон для защиты проекта Сложение и вычитание чисел в пределах 100
Сложение и вычитание чисел в пределах 100 Волшебное путешествие к мечте
Волшебное путешествие к мечте Развиваем дар слова
Развиваем дар слова Nineteeneffect by nineteenstudio
Nineteeneffect by nineteenstudio Откуда ты, имя?
Откуда ты, имя? Descriptive language
Descriptive language Familia de Microcontrolere AVR (ATMEL)
Familia de Microcontrolere AVR (ATMEL) florists department
florists department Правописание суффиксов имен существительных
Правописание суффиксов имен существительных «1С:Предприятие 8. 1С-Рейтинг: Диетпитание»
«1С:Предприятие 8. 1С-Рейтинг: Диетпитание» Международное гуманитарное право.
Международное гуманитарное право. Персональный стиль
Персональный стиль Проблемы реализации процедуры конкурсного производства в отношении должника и пути их решения
Проблемы реализации процедуры конкурсного производства в отношении должника и пути их решения «Вишнёвый сад»
«Вишнёвый сад» Thanksgiving day. My finally comment
Thanksgiving day. My finally comment