Содержание
- 2. Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер
- 3. Кислород как элемент (продолжение). 4. В земной коре его 49% по массе, в гидросфере – 89%
- 4. Физические свойства Газ - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.);
- 5. Химические свойства С неметаллами C + O2 → CO2 S + O2 → SO2 2H2 +
- 6. Способы получения Промышленный способ (перегонка жидкого воздуха). Лабораторный способ (разложение некоторых кислородосодержащих веществ) 2KClO3 –t°;MnO2→ 2KCl
- 7. Способы получения кислорода (продолжение). перманганата калия при нагревании: 2KMnO4 –t°→ K2MnO4 + MnO2 + O2↑ Разложение
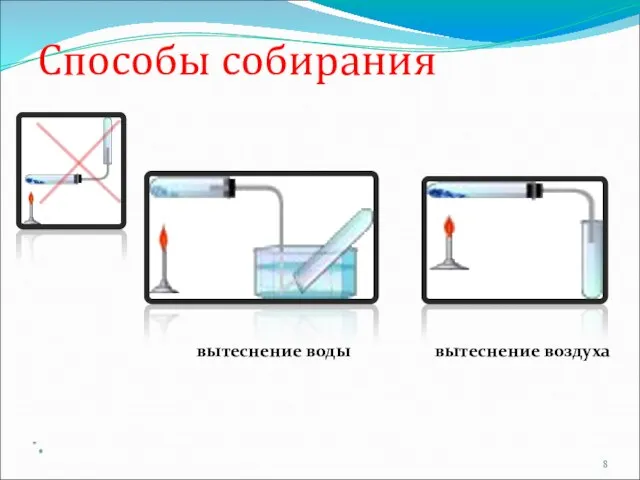
- 8. Способы собирания вытеснение воды вытеснение воздуха = *
- 10. Скачать презентацию






 Патогенез
Патогенез Устав общероссийског о профсоюза образования
Устав общероссийског о профсоюза образования Водоемы нашего края
Водоемы нашего края Сергей Александрович Есенин
Сергей Александрович Есенин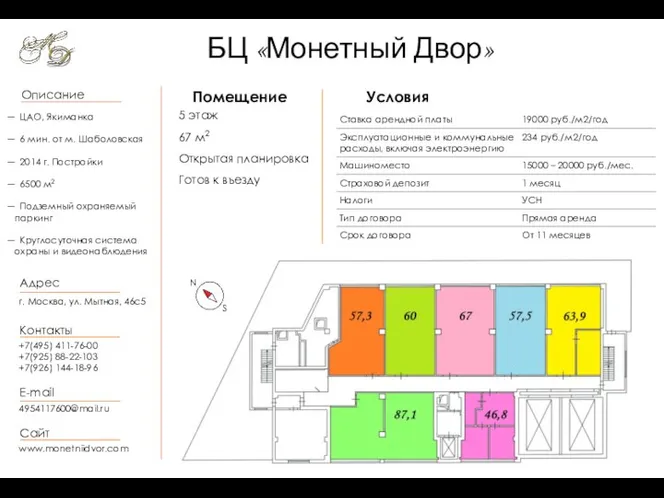 БЦ Монетный Двор 67 кв.м. (для показа)
БЦ Монетный Двор 67 кв.м. (для показа) ?
? Сложные условия на Паскале. Операторные скобки
Сложные условия на Паскале. Операторные скобки Костюмы
Костюмы Германия
Германия Буква ю – показатель мягкости согласного звука
Буква ю – показатель мягкости согласного звука Экологические проблемы космического масштаба
Экологические проблемы космического масштаба Презентация на тему Речь (8 класс)
Презентация на тему Речь (8 класс) Selection Lee man FW18 c ценами
Selection Lee man FW18 c ценами Международные отношения в 1920-30-е годы
Международные отношения в 1920-30-е годы Урок-путешествие по стране Терра Лигва
Урок-путешествие по стране Терра Лигва ПРИРОДА
ПРИРОДА Второстепенные члены предложения. Дополнение
Второстепенные члены предложения. Дополнение Волейбол (англ.. volleyball от volley)
Волейбол (англ.. volleyball от volley) «Разнообразие природных комплексов на территории Краснодарского края»
«Разнообразие природных комплексов на территории Краснодарского края» Презентация на тему Расписание дня школьника
Презентация на тему Расписание дня школьника Веревочные узлы, их виды и способы вязки
Веревочные узлы, их виды и способы вязки Социальные права человека
Социальные права человека МБОУ «СОШ №38» г. КурганаРаботу выполнила ученица 10 класса ВКовалёва ЕкатеринаРуководитель Учитель русского языка и литерату
МБОУ «СОШ №38» г. КурганаРаботу выполнила ученица 10 класса ВКовалёва ЕкатеринаРуководитель Учитель русского языка и литерату Академическое красноречие и его виды, строение и языковые особенности
Академическое красноречие и его виды, строение и языковые особенности Культура ацтеков
Культура ацтеков Измерение высоты здания разными способами
Измерение высоты здания разными способами 2013
2013