Слайд 2Введение
В 2001 г. исполнилось 50 лет открытию Б.П.Белоусовым автоколебательной химической реакции,

благодаря которой появилась возможность наблюдать периодические изменения концентрации реагентов и распространение автоволн в гомогенной химической системе.
Слайд 3 Вы смотрите на стакан с красно-лиловой жидкостью, а он вдруг становится

ярко-синим. А потом снова красно-лиловым. И снова синим. И вы невольно начинаете дышать в такт колебаниям. А когда жидкость налита тонким слоем, в ней распространяются волны изменения окраски. Образуются сложные узоры, круги, спирали, вихри, или все приобретает совершенно хаотический вид.
Слайд 5 Эта реакция известна уже более 40 лет. Ее открыл в 1951

году Борис Павлович Белоусов. Анатолию Марковичу Жаботинскому принадлежит решающий вклад в изучение этой реакции, в то, что это замечательное явление стало общенаучным достоянием. Реакция именуется особо почетным образом двумя инициалами : BZ-reaction.
Слайд 6Б.П.Белоусов - конец 30-х годов

Слайд 7 КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ – класс окислительно-восстановительных периодических реакций. Механизм реакции напоминает работу

устройства со сдерживающей защелкой.
Слайд 8 Борис Павлович Белоусов открыл колебания концентраций окисленной и восстановленной форм церия

в реакции взаимодействия лимонной кислоты с броматом калия, катализируемой ионами церия. Раствор регулярно менял свою окраску от бесцветной к желтой, обусловленной наличием церия(IV), затем снова к бесцветной из-за церия(III) и т. д. Белоусов провел достаточно подробное исследование этой реакции и, в частности, выяснил, что период колебаний существенно уменьшается с повышением кислотности среды и температуры.
Слайд 10 Значительно позже, в 1974 году, профессором химии и биологии Аризонского университета

(США) Артуром Т. Уинфри были открыты пространственно-временные структуры в неперемешиваемой системе Белоусова-Жаботинского, возникающие и существующие в виде различных дву- и трехмерных пространственных рисунков (например, концентрических колец, спиралей, волновых фронтов и т.п.). С тех пор интерес к системам без перемешивания постоянно растет и в последнее время в большой мере не остается только академическим, но и указывает на перспективность исследований в данном направлении.
Слайд 12 Влияние физических и химических факторов на систему БЖ также занимает важное

место в ее исследовании. Сюда следует прежде всего отнести влияние перемешивания, влияние излучения и влияние молекулярного кислорода. Собственно, эти три фактора, наряду с влиянием шума, и определяют спектр современных практических и в большинстве своем теоретических исследований осцилляторов Белоусова-Жаботинского.
Слайд 13Реакция Белоусова
Необходимые условия, обеспечивающие возможность протекания таких реакций:
Скорость первой стадии

должна заметно превышать скорость второй стадии;
На второй стадии должно возникать соединение, тормозящее протекание первой стадии (его называют ингибитором).
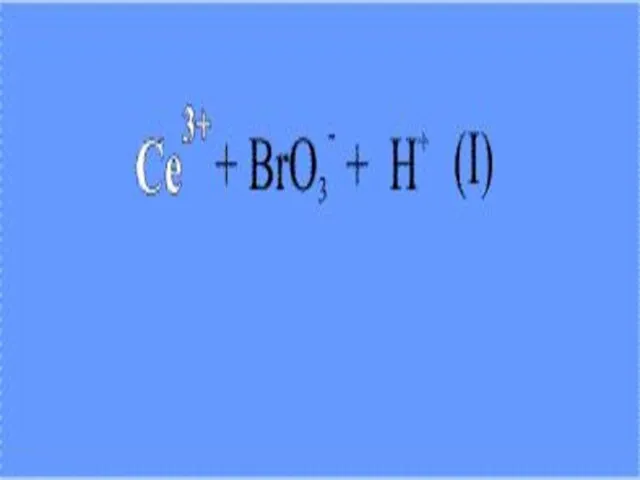
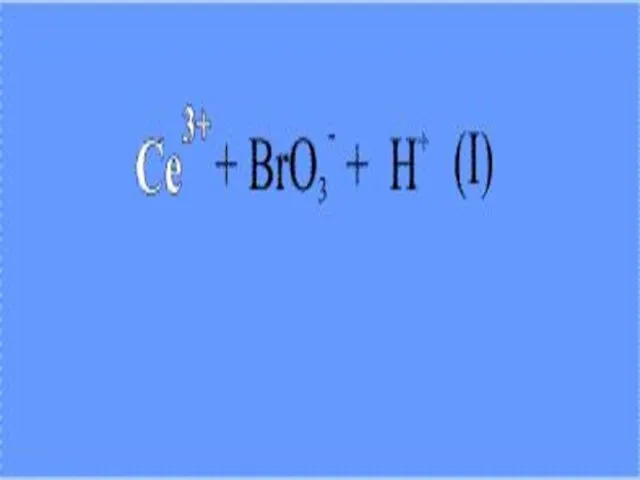
Слайд 14 Подобную реакцию можно наблюдать при смешении водных растворов соли церия(III) (например,

сульфат церия), бромата калия KBrO3 и броммалоновой кислоты HO(O)C – CH(Br) – C(O)OH. Реакционную массу подкисляют серной кислотой.
Слайд 15 На первой стадии ион трехвалентного церия (возникший при диссоциации соли церия)

восстанавливается бромат-анионом (его поставляет бромат калия). При этом ион Се(III) окисляется до Се(IV), что внешне заметно по изменению окраски реакционного раствора – ионы Се(III) в водном растворе бесцветны, а Се(IV) имеют желтую окраску.
Слайд 17 На следующей стадии образовавшийся ион Се(IV) реагирует с броммалоновой кислотой, окисляя

ее:
Слайд 19 При этом церий вновь становится ионом Се(III) и может вновь участвовать

в реакции I. В данном случае он играет роль типичного катализатора, участвует в реакции, но при этом не расходуется, тем не менее, без него реакция не пойдет. Расходуются в процессе реакции бромат калия и броммалоновая кислота, церий лишь передает электроны от одного реагента к другому (исходные реагенты отмечены черным цветом, а продукты реакции – красным):
Слайд 21 Своеобразие этой реакции состоит в том, что на стадии II в

качестве побочного продукта возникает бром-анион Br–. Он ингибирует, то есть тормозит стадию I, а на стадию II влияния не оказывает. В результате в реакционной системе накапливаются продукты стадии II, прежде всего, ионы Се3+.
Слайд 22 В определенный момент, когда этих ионов накапливается очень много, ионы брома

уже не могут далее тормозить стадию I, и она проходит с высокой скоростью. В системе вновь появляются ионы Се(IV), которые далее участвуют в медленной стадии II.
Слайд 23 Таким образом, ионы брома исполняют роль спускового крючка, не позволяющего до

определенного момента стартовать первой стадии.
Слайд 24 Внешне это выглядит следующим образом (ионы Се(III) в водном растворе бесцветны,

а Се(IV) имеют желтую окраску): реакционная масса мгновенно желтеет, а затем медленно обесцвечивается (стакан № 1). Цвет меняется приблизительно каждые полторы минуты, интервал времени сохраняется неизменным в течение нескольких часов.
Слайд 26 Если постепенно добавлять расходующиеся реагенты, то такие «химические часы» будут работать

очень долго. При повышении температуры временнóй цикл колебательной реакции сокращается.
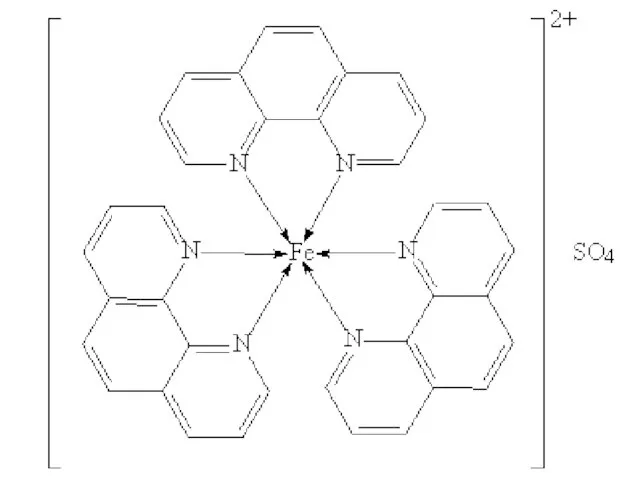
Слайд 27 Существуют другие примеры колебательных реакций. В описанной выше системе ионы церия

можно заменить ионами железа. Для этого используют комплекс сульфата Fe(II) с тремя молекулами фенантролина, который в водном растворе окрашен в красный цвет (этот комплекс широко используют для количественного определения железа):
Слайд 29 Аналогичный комплекс Fe(III), появляющийся в результате окисления, окрашен в голубой цвет,

в процессе реакции голубой цвет мгновенно становится красным, который вновь постепенно переходит в голубой (стакан № 2).
Слайд 31 Если заменить броммалоновую кислоту лимонной [НОС(О)СН2]2С(ОН)С(О)ОН, то в присутствии каталитических количеств
![Если заменить броммалоновую кислоту лимонной [НОС(О)СН2]2С(ОН)С(О)ОН, то в присутствии каталитических количеств солей](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/452675/slide-30.jpg)
солей марганца возникает система, в которой цвет пульсирует каждые две минуты (стакан № 3).
Слайд 33 Щавелево-уксусная кислота НОС(О)СН2С(О)С(О)ОН с солями церия отсчитывает шестисекундные интервалы (стакан №

4). Интервалы времени на анимированном рисунке показаны условно, самый большой интервал смены цвета в стакане № 3, самый малый – в стакане № 4













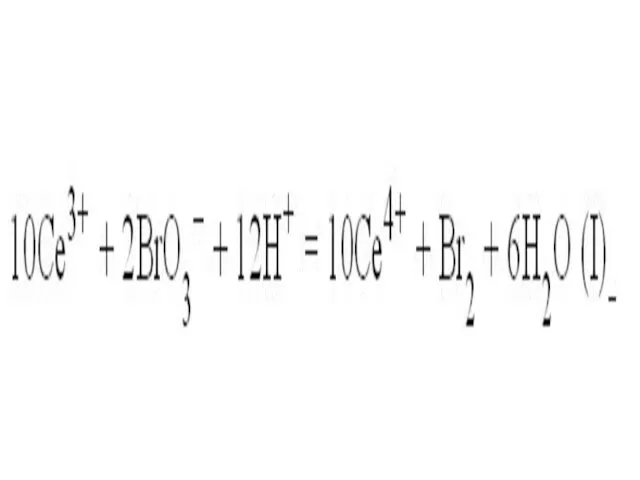

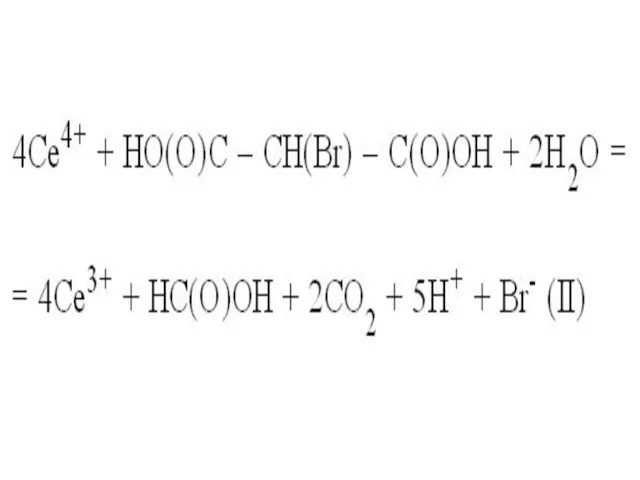










![Если заменить броммалоновую кислоту лимонной [НОС(О)СН2]2С(ОН)С(О)ОН, то в присутствии каталитических количеств солей](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/452675/slide-30.jpg)



 Предквантум
Предквантум Старинные зимние обычаи и праздники, «Рождество», «Святки»
Старинные зимние обычаи и праздники, «Рождество», «Святки» ВИДЕО-СТЕНА DIBOSS LB-40
ВИДЕО-СТЕНА DIBOSS LB-40 Новый подход к интеграции календарно-сетевых графиков и смет
Новый подход к интеграции календарно-сетевых графиков и смет Областной конкурс Методическая разработка дистанционного урока - 2021
Областной конкурс Методическая разработка дистанционного урока - 2021 Музей путешествий. Поклонная гора. Парк Победы
Музей путешествий. Поклонная гора. Парк Победы Товары и услуги
Товары и услуги Техническое регулирование
Техническое регулирование 20140305_lekarstvennye_rasteniya_buturlinovskogo_rayona
20140305_lekarstvennye_rasteniya_buturlinovskogo_rayona Консолидация ритейла в Украине: роль логистики 1.Предпосылки для консолидации ритейла 2.Когда ритейлеру нужен 3PL-оператор? 3.Case study 4.
Консолидация ритейла в Украине: роль логистики 1.Предпосылки для консолидации ритейла 2.Когда ритейлеру нужен 3PL-оператор? 3.Case study 4. Project on the Indian Ocean
Project on the Indian Ocean  Портретная студийная съёмка
Портретная студийная съёмка Внешняя политика Советского государства 1920-х
Внешняя политика Советского государства 1920-х СТРОКА, ОБОРВАННАЯ ПУЛЕЙ
СТРОКА, ОБОРВАННАЯ ПУЛЕЙ ЕГЭ В 3 «Площади»
ЕГЭ В 3 «Площади» Цветовой контраст (хроматический)
Цветовой контраст (хроматический) Фотожурналист Владимир Вяткин
Фотожурналист Владимир Вяткин 26-27 апреля 2006 года Центр практической психологии РГУ имени С.А. Есенина Московский городской психолого-педагогический университе
26-27 апреля 2006 года Центр практической психологии РГУ имени С.А. Есенина Московский городской психолого-педагогический университе Кейс-стади для педагогов
Кейс-стади для педагогов Об аксиомах геометрии
Об аксиомах геометрии Презентация на тему Родная природа в стихотворениях поэтов xx века
Презентация на тему Родная природа в стихотворениях поэтов xx века  Каталог Атоми
Каталог Атоми Особенности организации и проведения школьного этапа Всероссийской олимпиады школьников по русскому языку Соловьева Т.В., предсе
Особенности организации и проведения школьного этапа Всероссийской олимпиады школьников по русскому языку Соловьева Т.В., предсе Создание новогодней открытки на основе пейзажа «Зимние россыпи»
Создание новогодней открытки на основе пейзажа «Зимние россыпи» Внесем порядок в хаос! ИЗО 7 класс
Внесем порядок в хаос! ИЗО 7 класс Космонавты, рожденные Украиной: космонавты Луганщины
Космонавты, рожденные Украиной: космонавты Луганщины Межрегиональный образовательный форум «Открытое образовательное пространство: живая праКтика тьюторства»
Межрегиональный образовательный форум «Открытое образовательное пространство: живая праКтика тьюторства» ДДК. Экскурсия
ДДК. Экскурсия