Содержание
- 2. Атомы благородных газов имеют завершённый внешний энергетический уровень. Он наиболее устойчив и стабилен, что является причиной
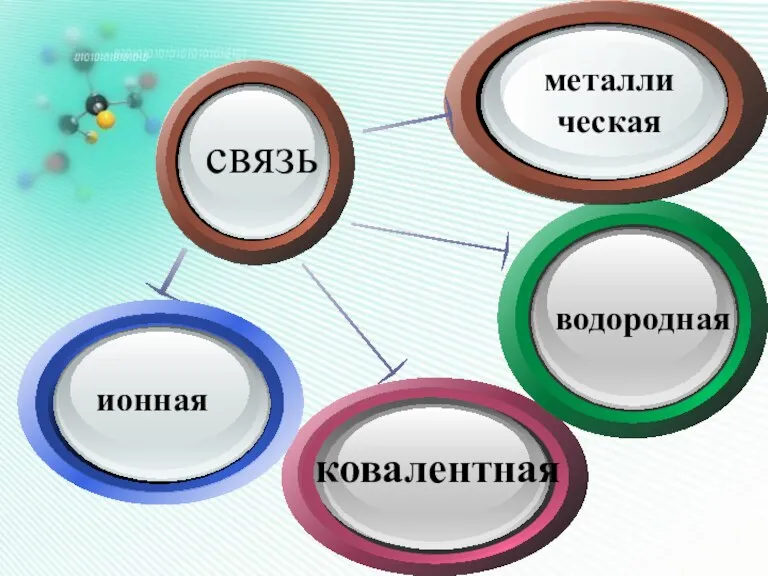
- 3. Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
- 4. Валентность – это способность атома элемента образовывать различное число химических связей с другими атомами. Величина валентности
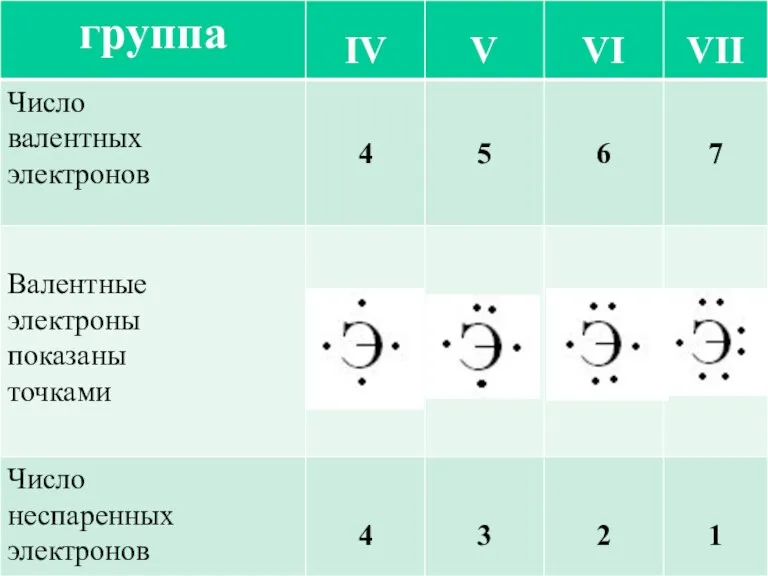
- 5. В образовании химической связи участвуют только валентные электроны. У элементов главных подгрупп это электроны внешнего энергетического
- 6. Click to add Titl водородная металлическая связь
- 7. В образовании ковалентной связи принимают участие неспаренные валентные электроны атома, которые располагаются на внешнем уровне по
- 9. Ковалентная связь – это химическая связь между атомами, осуществляемая при помощи общих электронных пар.
- 10. Механизм образования ковалентной связи Неспаренные электроны Общая или поделённая пара электронов Между ядрами образуется сгущение отрицательного
- 11. Образование ковалентной связи в молекуле хлора (Cl2). +17Cl 2е- 8е- 7е- Для завершения внешнего слоя каждому
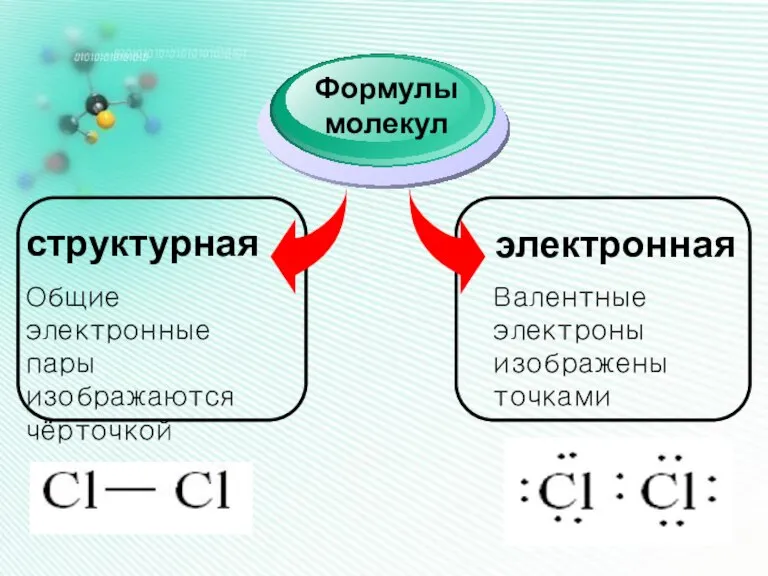
- 12. структурная Формулы молекул электронная Общие электронные пары изображаются чёрточкой Валентные электроны изображены точками
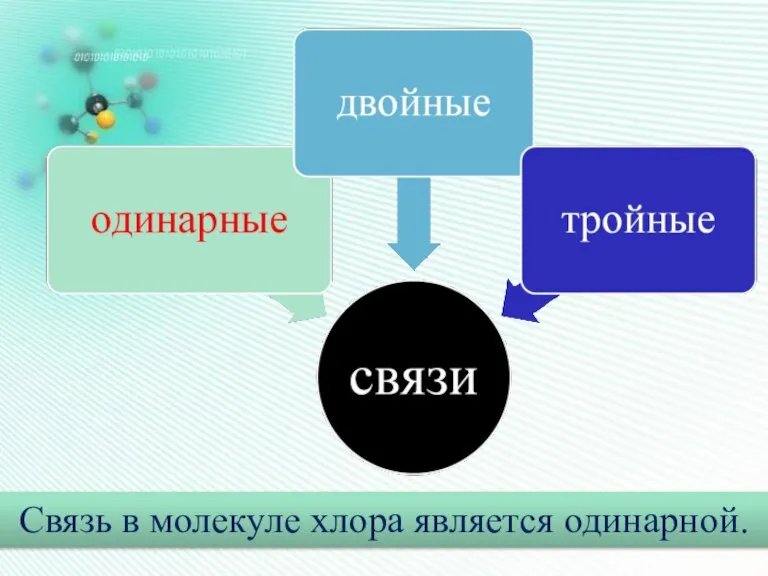
- 13. Связь в молекуле хлора является одинарной.
- 14. Образование молекулы азота (N2). +7N 2е- 5е- В молекуле азота образуется тройная связь, значит атом азота
- 15. Образование молекулы хлороводорода (HCl). +1Н 1е- +17Cl 2е- 8е- 7е- Водород и хлор в молекуле хлороводорода
- 16. Практическая часть. Составьте схему строения атома кислорода. Подчеркните валентные электроны и обозначьте их точками вокруг символа
- 18. Скачать презентацию











 Система оценки результатов образования
Система оценки результатов образования Акционерное общество Завод радиотехнического оборудования
Акционерное общество Завод радиотехнического оборудования Особенности психологического стресса
Особенности психологического стресса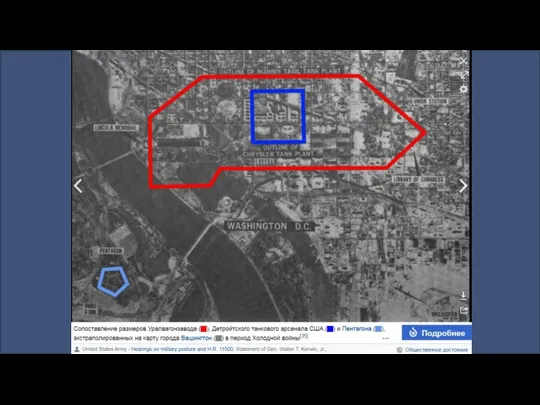 Сопоставление резисторов Уралвагонзавода
Сопоставление резисторов Уралвагонзавода Вторая мировая война
Вторая мировая война LegalBrains
LegalBrains Чудо - сила
Чудо - сила «Кто постигает новое, лелея старое, тот может быть учителем»
«Кто постигает новое, лелея старое, тот может быть учителем» Игра для знатоков химии "Пять звезд"
Игра для знатоков химии "Пять звезд" Тейяр де Шарден
Тейяр де Шарден Business law
Business law  Вид и его критерии
Вид и его критерии Творческий проект Топиарий
Творческий проект Топиарий Моя история tatto
Моя история tatto Толерантность - это...
Толерантность - это... 20140409_prezentatsiya_1
20140409_prezentatsiya_1 Приготовление катамы
Приготовление катамы Контроль закупок и арбитражная практика ЦАК Госкорпорации
Контроль закупок и арбитражная практика ЦАК Госкорпорации Октябрь 1917
Октябрь 1917 Международный туроператор Байкалика
Международный туроператор Байкалика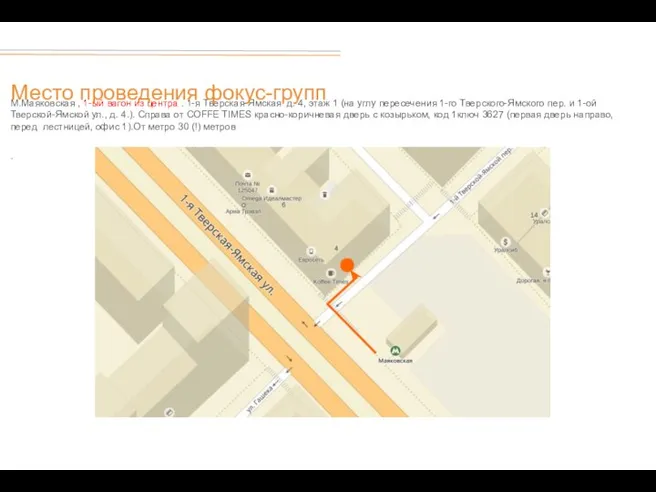 Место проведения фокус-групп
Место проведения фокус-групп Sports in America
Sports in America «Эти непростые односоставные предложения…» (обобщающий урок)
«Эти непростые односоставные предложения…» (обобщающий урок) Образовательный портал Твой репетитор
Образовательный портал Твой репетитор Поэма «Кому на Руси жить хорошо» как народное произведение
Поэма «Кому на Руси жить хорошо» как народное произведение Презентация на тему Сочинение в форме дневниковой записи
Презентация на тему Сочинение в форме дневниковой записи Растениеводство (3 класс)
Растениеводство (3 класс) ЖИВОТНЫЕ В КОСМОСЕ
ЖИВОТНЫЕ В КОСМОСЕ