Содержание
- 2. Механизм кристаллизации Кристаллизация – это процесс перехода металла из жидкого состояния в твердое (кристаллическое) Чем больше
- 4. Критический зародыш. Размер критического зародыша Рост зародышей возможен только при условии, если они достигли определенной величины,
- 5. Свободная энергия Гельмгольца и Гиббса Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется по
- 7. Скорость кристаллизации. Кривые Таммана Чернов Д.К. установил основные законы кристаллизации. Скорость кристаллизации зависит от двух параметров:
- 9. Виды кристаллов. Дендриты. Механизм роста. Виды кристаллов: а - равноосные; б) полиэдры; в) дендриты; г -
- 11. Полиморфные превращения Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как
- 12. Теория сплавов. Сплав. Компонент. Фаза. Химическое соединение. Сплав - материал, имеющий металлические свойства и состоящий из
- 14. Твердые растворы Твердыми растворами называют фазы, в которых один из компонентов сплава (растворитель) сохраняет свою кристаллическую
- 19. Интерметаллиды, фазы внедрения, электронные соединения, фазы Лавеса Интерметаллиды - образуются в сплавах металлов друг с другом
- 20. Правило фаз Связь между числом компонентов К, числом равновесных фаз Ф, температурой, давлением и вариантностью (или
- 21. Структура сплавов. Диаграммы состояния. Структура сплавов Под структурой сплавов понимают форму, размеры и характер взаимного расположения
- 23. Диаграммы состояния сплавов , образующие в твердом состоянии неограниченные твердые растворы Конода – горизонтальный отрезок прямой
- 26. Кристаллизация сплава n1 и компонентов А, В Начало кристаллизации - чуть ниже температуры t1 . Из
- 27. Диаграммы состояния сплавов с неограниченной растворимостью компонентов в жидком состоянии, ограниченной в твердом и нонвариантным эвтектическим
- 30. Эвтектика. Кривая охлаждения сплава m Кристаллизация ограниченных α и β-растворов в сплавах участков А – а1
- 31. Микроструктура сплава m Под микроскопом в структуре этого сплава при средних увеличениях можно различить кристаллы двух
- 32. Кристаллизация сплава С Сплав кристаллизуется, как сплав m по схеме Ж3-e α4-a Окончание кристаллизации – при
- 33. Эвтектический сплав (e1) Жидкость состава e1 кристаллизуется при постоянной температуре te в эвтектику по схеме Же
- 34. Доэвтектический сплав n1. При температуре te количество первичных α-кристаллов определится отношением отрезков ne/ae*Q количество оставшейся жидкости
- 35. Структурная диаграмма (при комнатной Т) Сплавы участков А – а1 и b1 - В - одна
- 36. Диаграммы состояния сплавов, компоненты которого не растворимы в твердом состоянии и при кристаллизации образуют эвтектику Кривые
- 37. Диаграммы состояния сплавов, образующих в твердом состоянии промежуточную фазу - химическое соединение. Промежуточными называют все твердые
- 40. Перитектическая реакция Жр+βb αa, заключается во взаимодействии жидкости Жp с ранее выпавшими первичными βb-кристаллами, в результате
- 42. Сплав n1. При первичной кристаллизации в интервале температур t1-tp состав β-кристаллов изменяется по кривой солидус B′b
- 43. Сплав m1. До температуры tP в нем протекает фазовое превращение: Ж3-Р -- β4-е. При температуре tP
- 44. Сплав l1. Аналогично сплавам m1 и n1 до tP кристаллизуется сплав l1. Соотношение количества жидкости Жp
- 45. Сплавы l1, р1 и в1 Сплавы l1 Аналогично сплавам m1 и n1 до tP кристаллизуется сплав
- 46. Полиморфизм (аллотропия) – свойство некоторых металлов иметь различные кристаллические решетки при разных температурах. Если один или
- 48. Сплав 2. Полная кристаллизация ниже t2. В точке t3 начинается полиморфное превращение γ↔α, а в точке
- 49. Диаграмма состояния с полиморфным превращением у двух компонентов : ТАаТВ – линия ликвидус, ТАбТВ – линия
- 50. Диаграмма состояния с полиморфным превращением у одного из компонентов и с перитектическим превращением ТАFТВ – линия
- 51. Диаграмма состояния с полиморфным превращением двух компонентов и с эвтектоидным превращением ТпА и ТпВ – начало
- 52. При образовании смесей свойства сплава изменяются по линейному закону (аддитивно). Значение свойств сплавов находятся в интервале
- 54. Скачать презентацию
Слайд 2Механизм кристаллизации
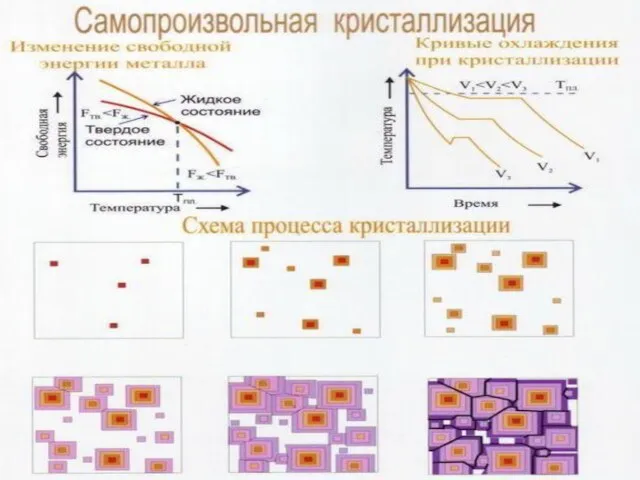
Кристаллизация – это процесс перехода металла из жидкого состояния в твердое
Механизм кристаллизации
Кристаллизация – это процесс перехода металла из жидкого состояния в твердое

Чем больше скорость охлаждения, тем больше степень переохлаждения и меньше время кристаллизации.
Образование зародышей кристаллизации. С понижением температуры степень ближнего порядка и размер микрообъектов с ближним порядком возрастает. Образуются фазовые флуктуации, в которых атомы упакованы так же, как в кристаллах. Они превращаются в центры кристаллизации.
Процесс кристаллизации. Происходит рост как ранее образовавшихся зародышей, так и появление и рост новых зародышей. Когда растущие зерна сталкиваются друг с другом, образуется граница зерна
Форма зерен. При свободном росте кристаллы имеют более или менее правильную геометрическую форму. В конечном итоге жидкость полностью исчезает, и металл состоит из отдельных зерен неправильной формы или кристаллитов.
Кристаллическая решетка зерен. Границы. Каждое зерно имеет одну и ту же кристаллическую решетку. Так как кристаллизация отдельных зерен происходит независимо друг от друга, их кристаллические решетки оказываются произвольно ориентированными в пространстве, а на границе двух соседних зерен имеется переходная зона от кристаллической решетки одного зерна к кристаллической решетке соседнего.
Границы зерен обладают большим количеством дефектов. Эти границы называются большеугловыми.
V3> V2> V1
Слайд 4Критический зародыш. Размер критического зародыша
Рост зародышей возможен только при условии, если
Критический зародыш. Размер критического зародыша
Рост зародышей возможен только при условии, если
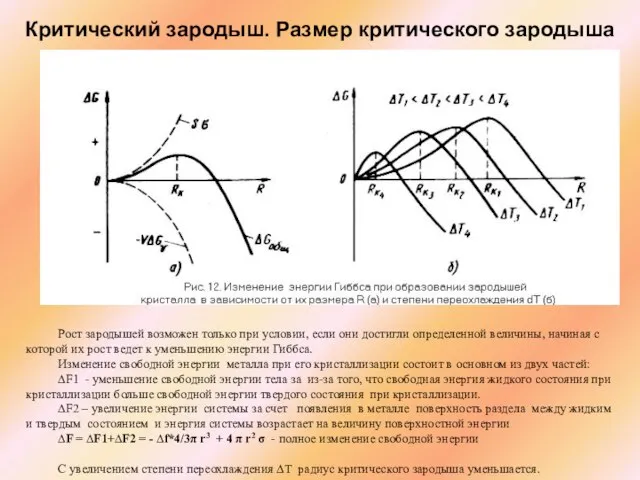
Изменение свободной энергии металла при его кристаллизации состоит в основном из двух частей:
∆F1 - уменьшение свободной энергии тела за из-за того, что свободная энергия жидкого состояния при кристаллизации больше свободной энергии твердого состояния при кристаллизации.
∆F2 – увеличение энергии системы за счет появления в металле поверхность раздела между жидким и твердым состоянием и энергия системы возрастает на величину поверхностной энергии
∆F = ∆F1+∆F2 = - ∆f*4/3π r3 + 4 π r2 σ - полное изменение свободной энергии
С увеличением степени переохлаждения ∆Т радиус критического зародыша уменьшается.
Слайд 5Свободная энергия Гельмгольца и Гиббса
Свободная энергия Гельмгольца для системы с постоянным числом
Свободная энергия Гельмгольца и Гиббса
Свободная энергия Гельмгольца для системы с постоянным числом

F = U – TS
где U — внутренняя энергия,
T — абсолютная температура,
S — энтропия.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
F = U + PV – TS
где P и V - давление и объем
Энергию Гиббса можно понимать как полную химическуюЭнергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамикеПонятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Слайд 7Скорость кристаллизации. Кривые Таммана
Чернов Д.К. установил основные законы кристаллизации. Скорость кристаллизации
Скорость кристаллизации. Кривые Таммана
Чернов Д.К. установил основные законы кристаллизации. Скорость кристаллизации

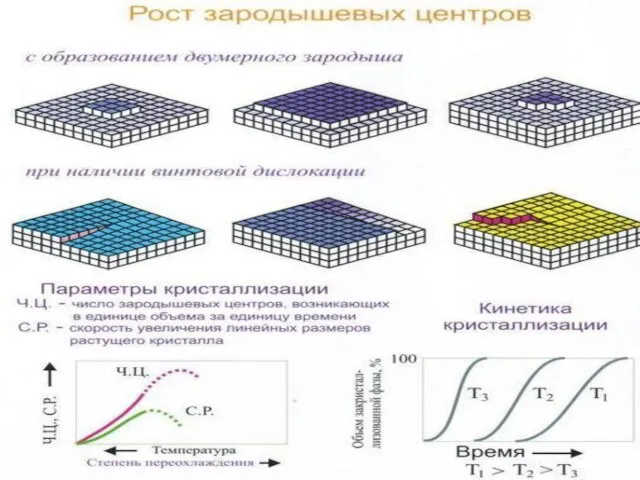
От числа зародышей кристаллизации, которые появляются в единицу времени в объеме металла, то есть от скорости образования новых зародышей
От скорости роста размера зародыша
С увеличением ∆Т растет число зерен металла, получается более мелкозернистая структура.
С другой стороны при увеличении ∆Т снижается температура кристаллизации, уменьшается коэффициент диффузии, а следовательно и скорость диффузионных процессов кристаллизации.
Гетерогенное образование зародышей. Самопроизвольное образование может происходить только в высоко чистом жидком металле при больших степенях переохлаждения.
Чаще источником образования зародышей являются всевозможные твердые частицы, которые всегда присутствуют в расплаве.
Если частица примеси имеют одинаковую кристаллическую решетку с решеткой затвердевающего металла (изоморфные примеси) и параметры сопрягающихся решеток примеси и кристаллизующегося вещества отличаются не более, чем на 9%, то они играют роль готовых центов кристаллизации.
Модифицирование - использование специально вводимых в жидкий металл примесей (модификаторов) для получения мелкого зерна по описанному выше механизму (карбиды, нитриды, оксиды).
Слайд 9Виды кристаллов. Дендриты. Механизм роста.
Виды кристаллов: а - равноосные; б) полиэдры;
Виды кристаллов. Дендриты. Механизм роста.
Виды кристаллов: а - равноосные; б) полиэдры;
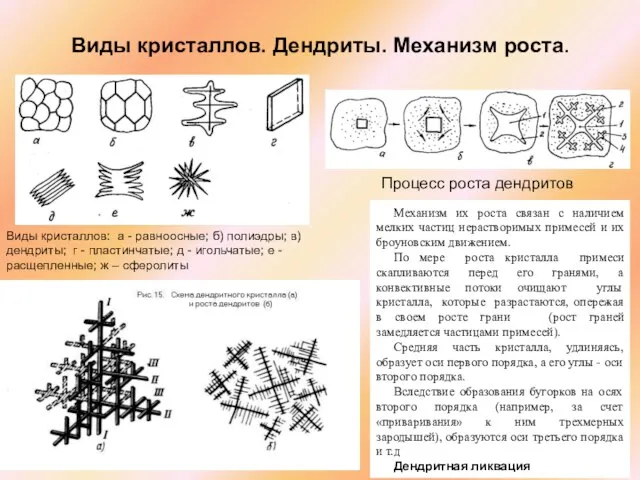
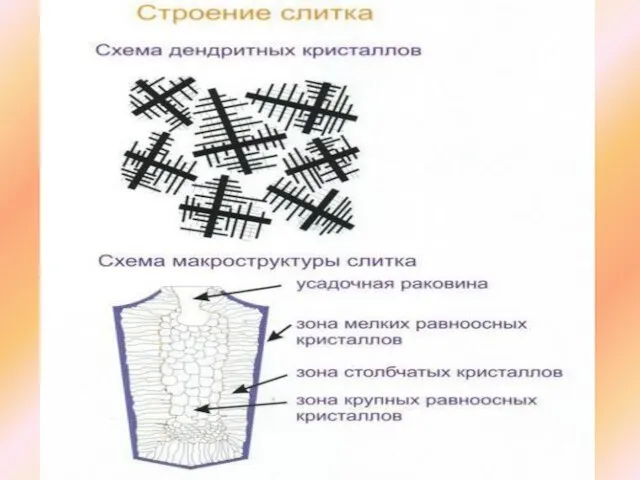
Процесс роста дендритов
Механизм их роста связан с наличием мелких частиц нерастворимых примесей и их броуновским движением.
По мере роста кристалла примеси скапливаются перед его гранями, а конвективные потоки очищают углы кристалла, которые разрастаются, опережая в своем росте грани (рост граней замедляется частицами примесей).
Средняя часть кристалла, удлиняясь, образует оси первого порядка, а его углы - оси второго порядка.
Вследствие образования бугорков на осях второго порядка (например, за счет «приваривания» к ним трехмерных зародышей), образуются оси третьего порядка и т.д
Дендритная ликвация
Слайд 11Полиморфные превращения
Многие металлы в зависимости от температуры могут существовать в разных кристаллических
Полиморфные превращения
Многие металлы в зависимости от температуры могут существовать в разных кристаллических

Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой a, а при более высокой - b, затем g и т.д.
Полиморфное превращение протекает вследствие того, что образование новой модификации сопровождается уменьшением энергии Гиббса.
Полиморфное превращение по своему механизму - кристаллизационный процесс, осуществляемый путем образования зародышей и последующего их роста
Известны полиморфные превращения для металлов Fea - Feb, Tia-Tib, Mna - Mnb - Mng -Mns , Sna - Snb,
Слайд 12Теория сплавов. Сплав. Компонент. Фаза.
Химическое соединение.
Сплав - материал, имеющий металлические
Теория сплавов. Сплав. Компонент. Фаза.
Химическое соединение.
Сплав - материал, имеющий металлические

Компоненты – вещества, которые образуют сплав
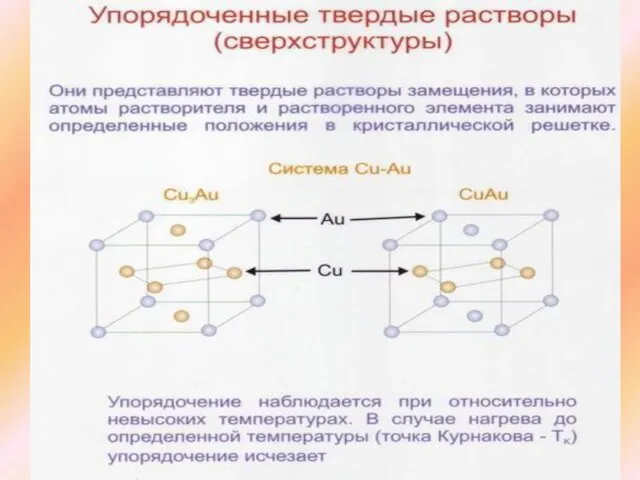
Фаза - однородная часть неоднородной системы, которая имеет границу раздела и взаимодействует с другими частями. В качестве фаз в сплавах могут быть: 1-жидкие растворы, 2-твердые растворы, 3-компоненты, 4- химические соединения, 5 – интерметаллиды.
Химическое соединение характеризуется строго определенным химическим составом и определенными температурами кристаллизации и плавления.
Кристаллическая решетка химического соединения отличается от кристаллической решетки тех элементов, их которых состоит это химическое соединение.
Характерные особенности химических соединений
Кристаллическая решетка отличается от решеток компонентов, образующих соединение.
В соединении всегда сохраняется простое кратное соотношение компонентов. Это позволяет выразить их состав простой формулой Аn Вm, где А и В-существующие элементы; n и m - простые числа.
Свойства соединения резко отличаются от свойств образующих их компонентов.
Температура плавления (диссоциации) постоянная.
Образование химического соединения сопровождается значительным тепловым эффектом.
В отличии от твердых растворов химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Например: Mg2Sn, M2Pb, Mg2P, Mg3Sb, Mg3Bi2, Mg S и др. )
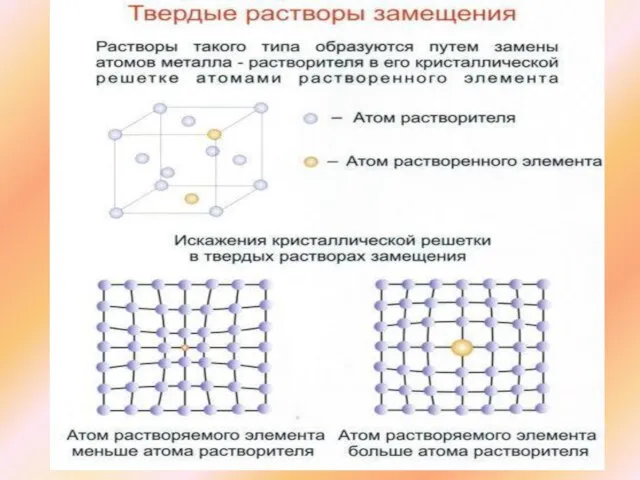
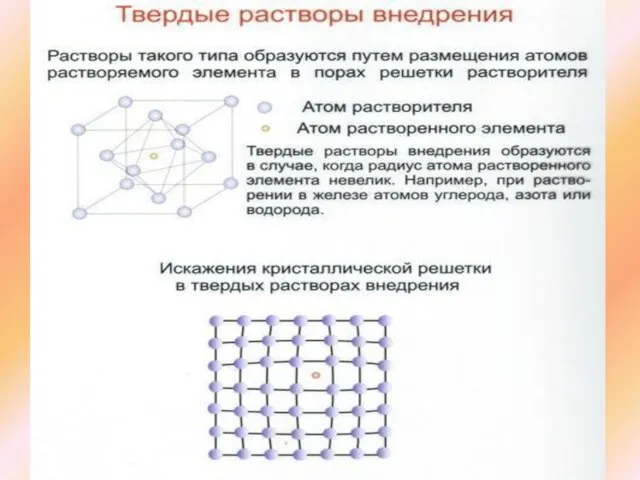
Слайд 14Твердые растворы
Твердыми растворами называют фазы, в которых один из компонентов сплава
Твердые растворы
Твердыми растворами называют фазы, в которых один из компонентов сплава
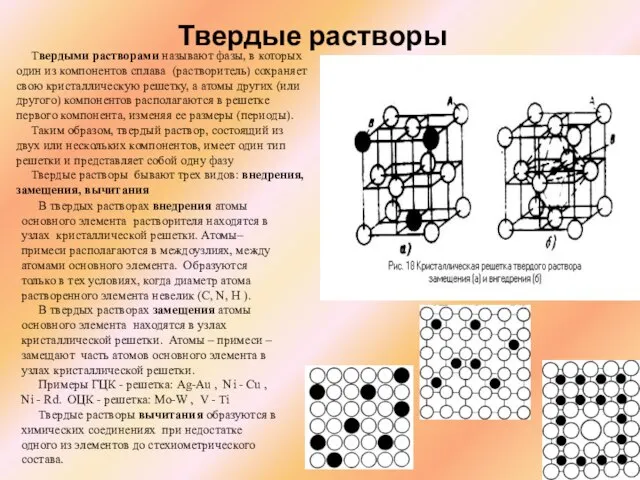
Таким образом, твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу
Твердые растворы бывают трех видов: внедрения, замещения, вычитания
В твердых растворах внедрения атомы основного элемента растворителя находятся в узлах кристаллической решетки. Атомы–примеси располагаются в междоузлиях, между атомами основного элемента. Образуются только в тех условиях, когда диаметр атома растворенного элемента невелик (C, N, H ).
В твердых растворах замещения атомы основного элемента находятся в узлах кристаллической решетки. Атомы – примеси – замещают часть атомов основного элемента в узлах кристаллической решетки.
Примеры ГЦК - решетка: Ag-Au , Ni - Cu , Ni - Rd. ОЦК - решетка: Mo-W , V - Ti
Твердые растворы вычитания образуются в химических соединениях при недостатке одного из элементов до стехиометрического состава.
Слайд 19Интерметаллиды, фазы внедрения, электронные соединения, фазы Лавеса
Интерметаллиды - образуются в сплавах металлов
Интерметаллиды, фазы внедрения, электронные соединения, фазы Лавеса
Интерметаллиды - образуются в сплавах металлов

Фазы внедрения. Переходные металлы (железо, марганец, хром, молибден и др.) образуют с углеродом, азотом, бором и водородом, т.е. с элементами, имеющими малый атомный радиус, соединения: карбиды, нитриды, бориды и гидриды. Они имеют общность строения и свойств и часто называются фазами внедрения. Фазы внедрения имеют формулу М4Х, М2Х и МХ.
Фазы внедрения являются фазами переменного состава, карбиды и нитриды, относящиеся к фазам внедрения, обладают высокой твердостью. Рассмотренные выше твердые растворы внедрения образуются при значительно меньшей концентрации второго компонента (C, N, H) и имеют решетку металла растворителя, тогда как фазы внедрения получают кристаллическую решетку, отличную от решетки металла.
На базе фазы внедрения легко образуются твердые растворы вычитания, называемые иногда твердыми растворами с дефектной решеткой. В твердых растворах вычитания часть узлов решетки, которые должны быть заняты атомами одного из компонент, оказывается свободным. В избытке имеется другой компонент)
Электронные соединения. Эти соединения чаще всего образуются между одновалентными металлами или металлами переходных групп, с одной стороны и простыми металлами с валентностью от 2 до 5, с другой стороны. Соединения этого типа имеют определенное отношение числа валентных электронов к числу атомов, т.е. определенную электронную концентрацию Так, существуют соединения, у которых это соотношение в одних случаях равно 3/2 (1,5), в других - 21/13 (1,62), в третьих - 7/4 (1,75).
Соединения 3/2, обозначаются как - соединения, 21/13 - - соединения, 7/4 - - соединение).
Фазы Лавеса. Эти фазы имеют формулу АВ2 и образуются между компонентами типа А и В при соотношении атомных диаметров DА/DВ 1,11,6. Фазы Лавеса имеют решетку ГПУ или ГЦК.)
Слайд 20Правило фаз
Связь между числом компонентов К, числом равновесных фаз Ф, температурой, давлением
Правило фаз
Связь между числом компонентов К, числом равновесных фаз Ф, температурой, давлением

С = К − Ф + n,
где n - это внешние факторы равновесия, при n = 2 - это температура и давление.
При исследовании металлических систем постоянным обычно принимается внешнее давление, поэтому n = 1 – это температура и уравнение принимает вид:
С = К − Ф + I.
Из правила фаз следует, что вариантность (или число степеней свободы) любой системы всегда положительна или равна нулю, то есть С≥0.
При С = 0 система называется нонвариантной. Это значит, что все независимые переменные, определяющие состояние системы, имеют строго фиксированные (единственные) значения, которые нельзя изменить, не нарушая фазового равновесия в системе.
При С = 1 систему называют моновариантной, при С = 2 - бивариантной и т.д.
Наличие одной, двух или большего числа степеней свободы позволяет независимо изменить соответственно одну, две или большее число переменных без изменения числа фаз в системе, т.е. не нарушая фазового равновесия.
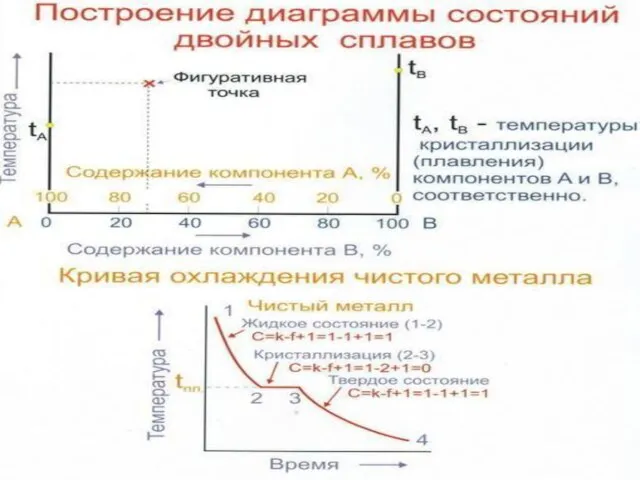
Слайд 21Структура сплавов. Диаграммы состояния.
Структура сплавов
Под структурой сплавов понимают форму, размеры и
Структура сплавов. Диаграммы состояния.
Структура сплавов
Под структурой сплавов понимают форму, размеры и

При полной взаимной растворимости компонентов в твердом состоянии микроструктура всех сплавов представляет собой зерна твердого раствора.
При ограниченной растворимости, которая характерна для многих сплавов, структура состоит из двух фаз.
Эвтектика состоит из двух и более фаз, имеющих форму пластинок, равномерно чередующихся между собой, которые образуют колонии.
Диаграммы состояния.
Диаграммы состояния описывают связь между концентрацией, температурой, фазовым составом или структурой сплава.
Сплавы бывают двухкомпонентные, трехкомпонентные, четырехкомпонентные и т.д.
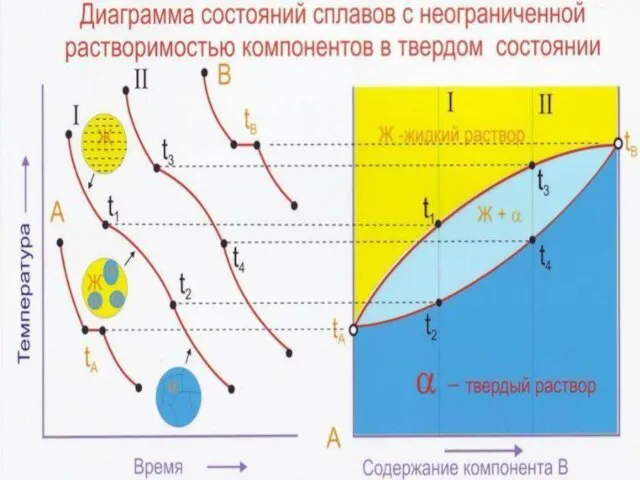
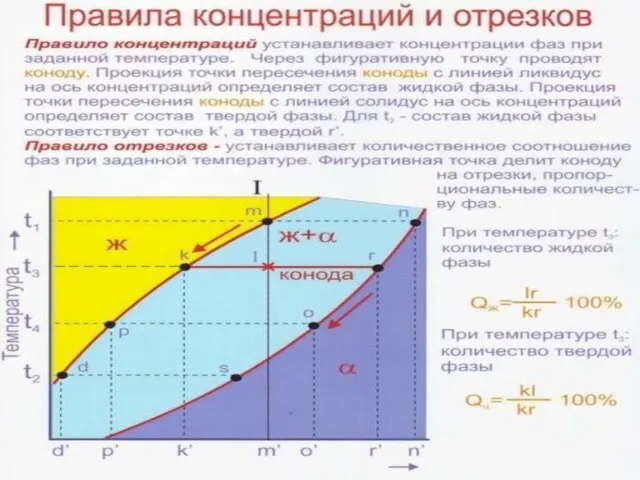
Слайд 23Диаграммы состояния сплавов , образующие в твердом состоянии неограниченные твердые растворы
Конода –
Диаграммы состояния сплавов , образующие в твердом состоянии неограниченные твердые растворы
Конода –
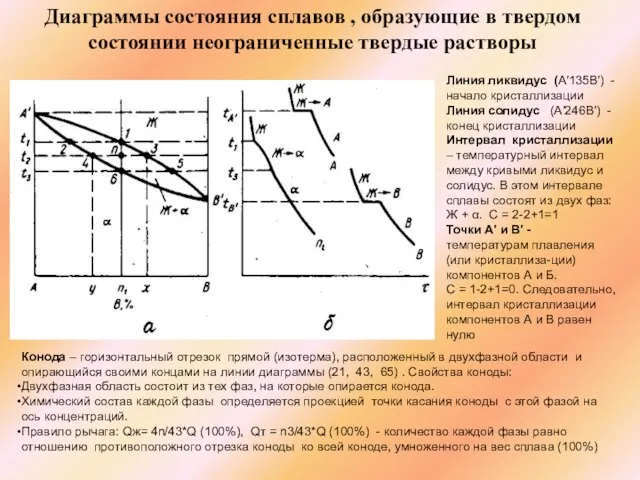
Двухфазная область состоит из тех фаз, на которые опирается конода.
Химический состав каждой фазы определяется проекцией точки касания коноды с этой фазой на ось концентраций.
Правило рычага: Qж= 4n/43*Q (100%), Qт = n3/43*Q (100%) - количество каждой фазы равно отношению противоположного отрезка коноды ко всей коноде, умноженного на вес сплава (100%)
Линия ликвидус (А′135В′) - начало кристаллизации
Линия солидус (А′246В′) - конец кристаллизации
Интервал кристаллизации – температурный интервал между кривыми ликвидус и солидус. В этом интервале сплавы состоят из двух фаз: Ж + α. С = 2-2+1=1
Точки А′ и В′ - температурам плавления (или кристаллиза-ции) компонентов А и Б.
С = 1-2+1=0. Следовательно, интервал кристаллизации компонентов А и В равен нулю
Слайд 26Кристаллизация сплава n1 и компонентов А, В
Начало кристаллизации - чуть ниже
Кристаллизация сплава n1 и компонентов А, В
Начало кристаллизации - чуть ниже

При Т2 концентрация Ж определяется точкой 3, а кристаллов альфа – точкой 4.
При Т3 α-кристаллы имеют концентрацию точки 6, последние следы жидкости Ж имеют состав точки 5.
При охлаждении от Т3 до комнатной в сплаве n1, не происходит никаких фазовых превращений (простое физическое охлаждение α-кристаллов).
Количество твердой фазы (α4 –кристаллов) в сплаве n1 при температуре t2 равно отношению части коноды, прилежащей к кривой ликвидус, ко всей коноде (n3/34), умноженной на массу сплава (100%)
Количество жидкой фазы (Ж3 ) равно соотвественно n4/34*100%
Кристаллизация сплава n1 является моновариантным превращением С1 = 2(А,В) -2 (Ж,альфа) +1=1 и происходит в интервале температур. Поэтому на кривой охлаждения сплава n1 горизонтальная площадка отсутствует, а имеются два перегиба
Кристаллизация чистых компонентов А (или В) является нонвариантным превращением Са = 1 (А) -2 (Ж,А)+1 = 0, Св = 1 (В) – 2(Ж,В) +1 = 0. Поэтому на кривых охлаждения компонентов А и В - соответственно по одной критической точке в виде горизонтальной площадки (остановки) при температурах, отвечающих их температурам плавления.
Дендритная ликвация
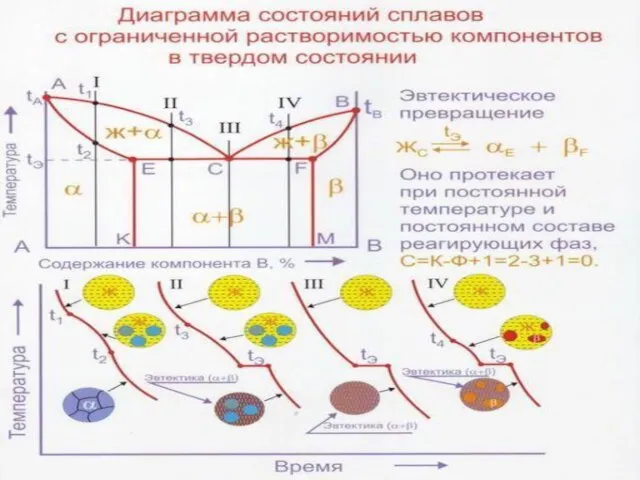
Слайд 27Диаграммы состояния сплавов с неограниченной растворимостью компонентов в жидком состоянии, ограниченной в
Диаграммы состояния сплавов с неограниченной растворимостью компонентов в жидком состоянии, ограниченной в

А′е - линия начала кристаллизации α -твердого раствора (ликвидус)
Ве′ - линия начала кристаллизации бета твердого раствора (ликвидус)
А′а – линия конца кристаллизации альфа-твердого раствора (солидус)
В′в = линия конца кристаллизации бета-твердого раствора (солидус)
Сплавы участка а - в заканчивают кристаллизацию при температуре te по эвтектической реакции. Эвтектика по гречески «легко плавящийся». Эвтектический сплав - это легкоплавкий сплав, т.е. сплав с минимальной температурой плавления.
Кривые аа1 и вв1 - это кривые сольвус (кривые ограниченной растворимости), которые показывают, как изменяется растворимость компонента В в компоненте А (аа1) и, наоборот, компонента А в компоненте В (вв1.)
Максимальная взаимная растворимость компонентов А и В в твердом состоянии наблюдается при эвтектической температуре te и изображается точками a и в. С понижением температуры растворимость уменьшается и при комнатной температуре изображается соответственно точками а1 и в1.
Поэтому при понижении температуры из этих растворов выделяются соответственно вторичные (или избыточные) α или β-кристаллы.
Альфа –ограниченный твердый раствор компонента В в компоненте А (с ре-шеткой компонента А)
Бета - ограниченный твердый раствор компонента А в компоненте В (с решет-кой компонента В).
Слайд 30Эвтектика. Кривая охлаждения сплава m
Кристаллизация ограниченных α и β-растворов в сплавах участков
Эвтектика. Кривая охлаждения сплава m
Кристаллизация ограниченных α и β-растворов в сплавах участков

Сплав m. В интервале температур t1- t3 сплав m1 кристаллизуется как граничный α-раствор, что можно записать как Ж1-5 α2-6 и при охлаждении до температуры t4 в нем не протекают никакие фазовые превращения.
Как только температура достигнет кривой сольвус aa1 α-раствор состава точки 7 достигнет предельной растворимости в нем компонента В. Поэтому при дальнейшем понижении температуры от t4 до комнатной из α-кристаллов выделяются вторичные β-кристаллы по схеме α7-а1 β8-в1.
На кривой охлаждения сплава m видны три критические точки (рис.9.3б): две верхние точки отвечают температурам начала и конца кристаллизации α-твердого раствора, а третья (нижняя) критическая точка - температуре начала выделения вторичных β из первичных α-кристаллов. Все три превращения – моновариантны.
Аналогичные фазовые превращения протекают в сплавах, расположенных на участке b1 – d. Из жидкости кристаллизуется β-раствор, из которого при охлаждении в твердом состоянии (ниже кривой сольвус bb1) выделяются вторичные α-кристаллы.
При эвтектической температуре te из жидкости Же кристаллизуется смесь кристаллов α- и β-твердых растворов максимальной концентрации, то есть
Же →te αa + βb.
Сплавы, расположенные между точками а и е, на-зываются доэвтектическими,
Сплавы между точками е и в - заэвтектическими,
Сплавс составом е –называется эвтектическим
Слайд 31 Микроструктура сплава m
Под микроскопом в структуре этого сплава при средних увеличениях
Микроструктура сплава m
Под микроскопом в структуре этого сплава при средних увеличениях
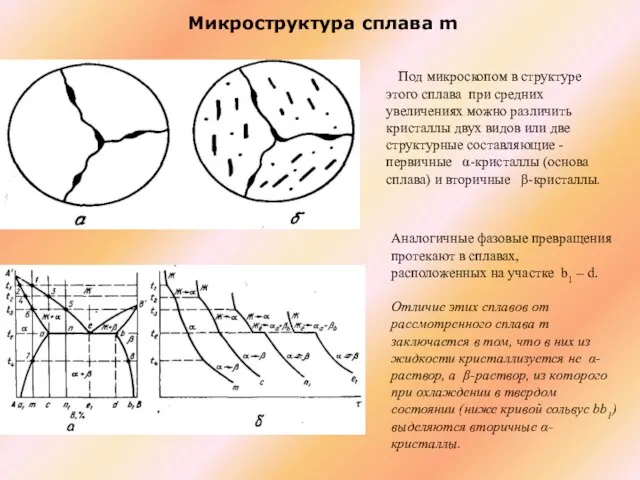
Аналогичные фазовые превращения протекают в сплавах, расположенных на участке b1 – d.
Oтличие этих сплавов от рассмотренного сплава m заключается в том, что в них из жидкости кристаллизуется не α-раствор, а β-раствор, из которого при охлаждении в твердом состоянии (ниже кривой сольвус bb1) выделяются вторичные α-кристаллы.
Слайд 32Кристаллизация сплава С
Сплав кристаллизуется, как сплав m по схеме Ж3-e α4-a
Кристаллизация сплава С
Сплав кристаллизуется, как сплав m по схеме Ж3-e α4-a
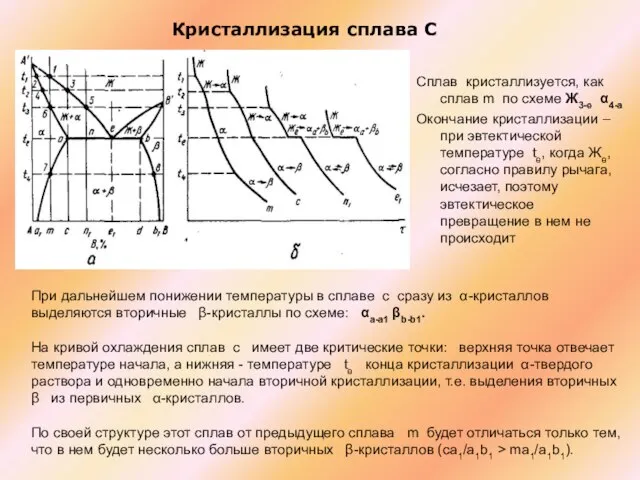
Окончание кристаллизации – при эвтектической температуре te, когда Же, согласно правилу рычага, исчезает, поэтому эвтектическое превращение в нем не происходит
При дальнейшем понижении температуры в сплаве c сразу из α-кристаллов выделяются вторичные β-кристаллы по схеме: αa-a1 βb-b1.
На кривой охлаждения сплав c имеет две критические точки: верхняя точка отвечает температуре начала, а нижняя - температуре te конца кристаллизации α-твердого раствора и одновременно начала вторичной кристаллизации, т.е. выделения вторичных β из первичных α-кристаллов.
По своей структуре этот сплав от предыдущего сплава m будет отличаться только тем, что в нем будет несколько больше вторичных β-кристаллов (ca1/a1b1 > ma1/a1b1).
Слайд 33Эвтектический сплав (e1)
Жидкость состава e1 кристаллизуется при постоянной температуре te в
Эвтектический сплав (e1)
Жидкость состава e1 кристаллизуется при постоянной температуре te в
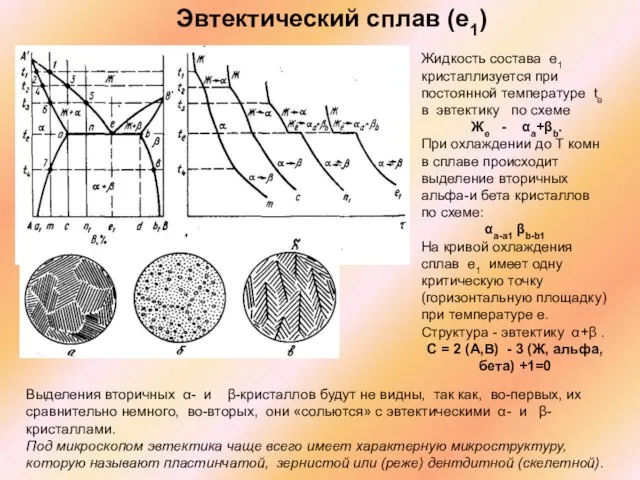
Же - αa+βb.
При охлаждении до Т комн в сплаве происходит выделение вторичных альфа-и бета кристаллов по схеме:
αa-a1 βb-b1
На кривой охлаждения сплав e1 имеет одну критическую точку (горизонтальную площадку) при температуре е.
Структура - эвтектику α+β .
С = 2 (А,В) - 3 (Ж, альфа, бета) +1=0
Выделения вторичных α- и β-кристаллов будут не видны, так как, во-первых, их сравнительно немного, во-вторых, они «сольются» с эвтектическими α- и β-кристаллами.
Под микроскопом эвтектика чаще всего имеет характерную микроструктуру, которую называют пластинчатой, зернистой или (реже) дентдитной (скелетной).
Слайд 34Доэвтектический сплав n1.
При температуре te количество первичных α-кристаллов определится отношением отрезков
Доэвтектический сплав n1.
При температуре te количество первичных α-кристаллов определится отношением отрезков

Из оставшейся жидкости Же при постоянной температуре te (С = К-Ф+1 = 2 -3 + 1 = 0) выделится эвтектическая смесь кристаллов α+β по схеме: Жe - αa+βb. По окончании кристаллизации эвтектики сплав n1 оказывается состоящим из первичных αa-кристаллов и эвтектики αa+βb.
При охлаждении до Т комн из αа-кристаллов будут выделяться вторичные β-кристаллы.
На кривой охлаждения сплава n1 - две критические точки: перегиб отвечает температуре начала кристаллизации α-твердого раствора, а горизонтальная площадка - соответственно температуре te кристаллизации эвтектики α+β и начала выделения вторичных β -кристаллов из первичных α--кристаллов.
Под микроскопом в структуре этого сплава можно увидеть первичные α-кристаллы, эвтектическую смесь кристаллов α+β и выделения вторичных β внутри первичных α-кристаллов.
Ниже линии ликвидус в сплаве происходи кристаллизация альфа-твердого раствора по схеме
Ж5-е - α6-а.
Химический состав жидкости изменяется по линии ликвидус (5-е), а твердой фазы – по линии солидус (6-а)
Слайд 35Структурная диаграмма (при комнатной Т)
Сплавы участков А – а1 и b1 -
Структурная диаграмма (при комнатной Т)
Сплавы участков А – а1 и b1 -
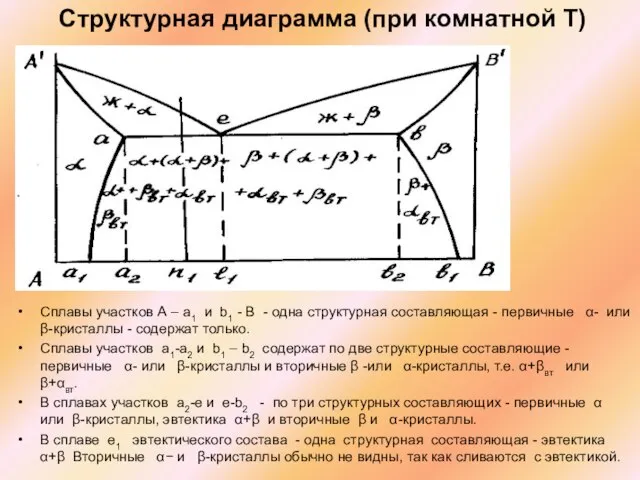
Сплавы участков а1-a2 и b1 – b2 содержат по две структурные составляющие - первичные α- или β-кристаллы и вторичные β -или α-кристаллы, т.е. α+βвт или β+αвт.
В сплавах участков а2-е и е-b2 - по три структурных составляющих - первичные α или β-кристаллы, эвтектика α+β и вторичные β и α-кристаллы.
В сплаве е1 эвтектического состава - одна структурная составляющая - эвтектика α+β Вторичные α− и β-кристаллы обычно не видны, так как сливаются с эвтектикой.
Слайд 36Диаграммы состояния сплавов, компоненты которого не растворимы в твердом состоянии и при
Диаграммы состояния сплавов, компоненты которого не растворимы в твердом состоянии и при
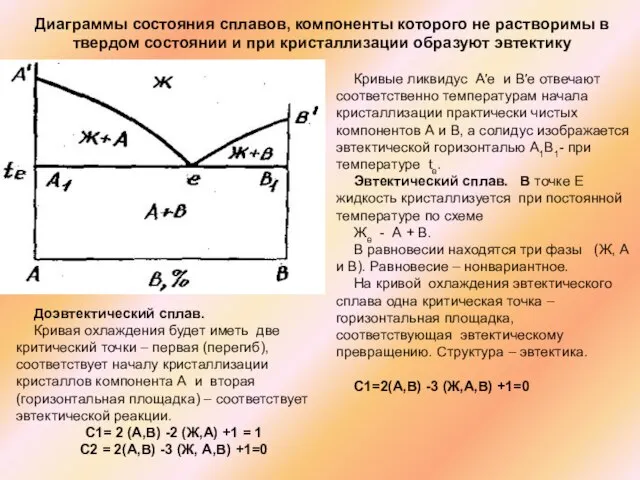
Кривые ликвидус А′е и В′е отвечают соответственно температурам начала кристаллизации практически чистых компонентов А и В, а солидус изображается эвтектической горизонталью А1В1- при температуре te.
Эвтектический сплав. В точке Е жидкость кристаллизуется при постоянной температуре по схеме
Же - А + В.
В равновесии находятся три фазы (Ж, А и В). Равновесие – нонвариантное.
На кривой охлаждения эвтектического сплава одна критическая точка – горизонтальная площадка, соответствующая эвтектическому превращению. Структура – эвтектика.
С1=2(А,В) -3 (Ж,А,В) +1=0
Доэвтектический сплав.
Кривая охлаждения будет иметь две критический точки – первая (перегиб), соответствует началу кристаллизации кристаллов компонента А и вторая (горизонтальная площадка) – соответствует эвтектической реакции.
С1= 2 (А,В) -2 (Ж,А) +1 = 1
С2 = 2(А,В) -3 (Ж, А,В) +1=0
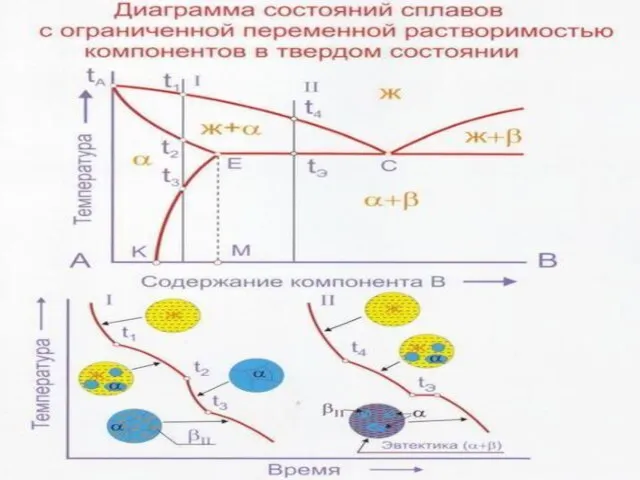
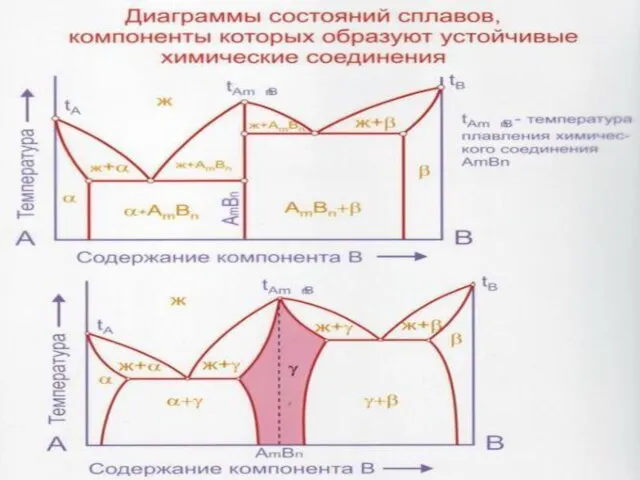
Слайд 37Диаграммы состояния сплавов, образующих в твердом состоянии промежуточную фазу - химическое соединение.
Диаграммы состояния сплавов, образующих в твердом состоянии промежуточную фазу - химическое соединение.
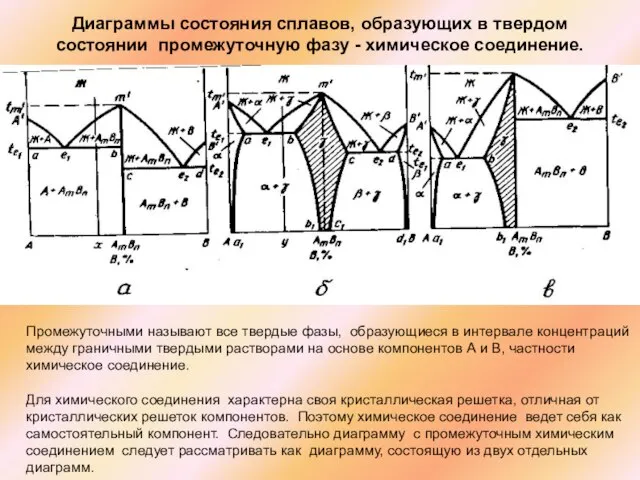
Промежуточными называют все твердые фазы, образующиеся в интервале концентраций между граничными твердыми растворами на основе компонентов А и В, частности химическое соединение.
Для химического соединения характерна своя кристаллическая решетка, отличная от кристаллических решеток компонентов. Поэтому химическое соединение ведет себя как самостоятельный компонент. Следовательно диаграмму с промежуточным химическим соединением следует рассматривать как диаграмму, состоящую из двух отдельных диаграмм.
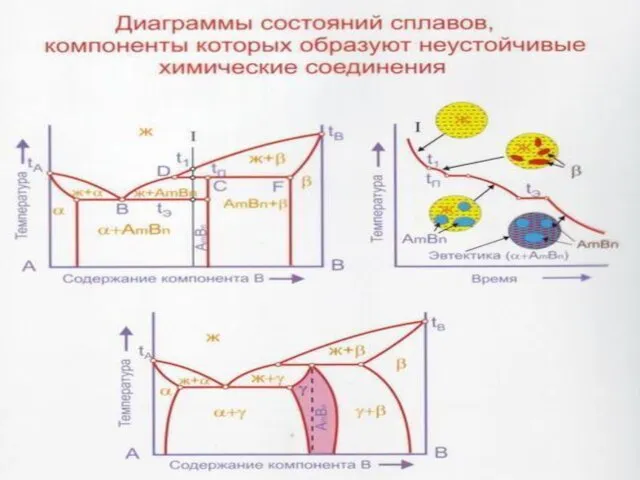
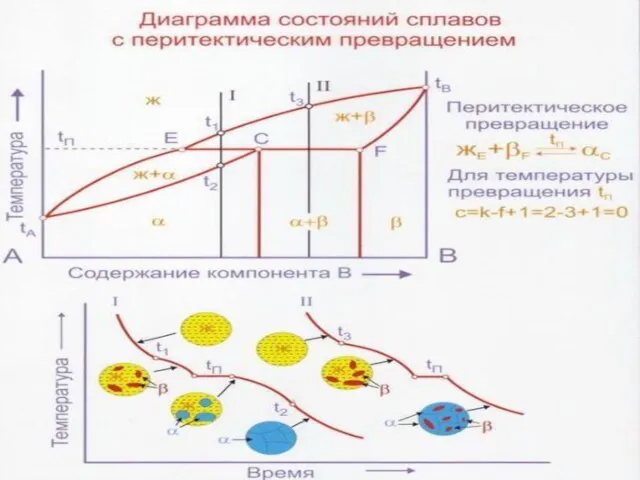
Слайд 40Перитектическая реакция Жр+βb αa, заключается во взаимодействии жидкости Жp с ранее выпавшими
Перитектическая реакция Жр+βb αa, заключается во взаимодействии жидкости Жp с ранее выпавшими
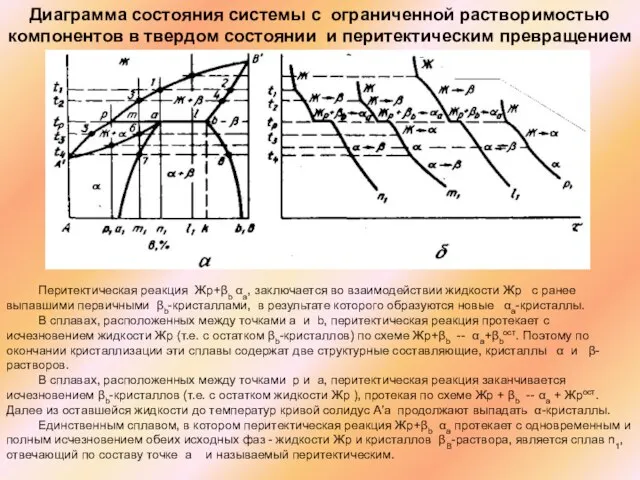
В сплавах, расположенных между точками a и b, перитектическая реакция протекает с исчезновением жидкости Жр (т.е. с остатком βb-кристаллов) по схеме Жр+βb -- αa+βbост. Поэтому по окончании кристаллизации эти сплавы содержат две структурные составляющие, кристаллы α и β-растворов.
В сплавах, расположенных между точками р и а, перитектическая реакция заканчивается исчезновением βb-кристаллов (т.е. с остатком жидкости Жp ), протекая по схеме Жp + βb -- αa + Жрост. Далее из оставшейся жидкости до температур кривой солидус А′а продолжают выпадать α-кристаллы.
Единственным сплавом, в котором перитектическая реакция Жp+βb αa протекает с одновременным и полным исчезновением обеих исходных фаз - жидкости Жр и кристаллов βB-раствора, является сплав n1, отвечающий по составу точке а и называемый перитектическим.
Диаграмма состояния системы с ограниченной растворимостью компонентов в твердом состоянии и перитектическим превращением
Слайд 42Сплав n1.
При первичной кристаллизации в интервале температур t1-tp состав β-кристаллов изменяется
Сплав n1.
При первичной кристаллизации в интервале температур t1-tp состав β-кристаллов изменяется

По достижении температуры tP (до начала перитектической реакции; в равновесии оказываются жидкость Жр и βb-кристаллы, относительные количества которых определяются отношениями отрезков аb/pb и ap/рb,
В момент окончания перитектической реакции сплав n1 окажется состоящим из αa-кристаллов. При дальнейшем понижении температуры из них должны выделяться вторичные β-кристаллы.
Состав αa кристаллов изменится по кривой сольвус aa1 в направлении от точки a к точке а1, а вторичных β-кристаллов - по кривой bb1, в направлении от точки b к точке b1, т.е. αa-a1 βb-b1. При комнатной температуре αa1-кристаллы оказываются в равновесии с βb1-кристаллами. Относительные количества этих фаз определятся отношениями отрезков n1b1/a1b1 и n1a1/a1b1.
На кривой охлаждения сплав n1 имеет две критические точки (рис.9.9б), а в структуре - две структурные составляющие: α-кристаллы, образовавшиеся по перитектической реакции (основа сплава), и вторичные β-кристаллы. Структура этого сплава напоминает структуру сплава из системы эвтектического типа (рис.9.3, 9.4).
Слайд 43Сплав m1.
До температуры tP в нем протекает фазовое превращение: Ж3-Р --
Сплав m1.
До температуры tP в нем протекает фазовое превращение: Ж3-Р --

При температуре tP в этом сплаве в равновесии оказываются жидкость ЖP и первичные β-кристаллы, соотношение между количествами которых измеряется отношением отрезков mb/mp. Перитектическая реакция закончится с остатком некоторого количества жидкости ЖP.
Двухфазное структура жидкости ЖP и βe-кристаллов до начала перитектической реакции при температуре tP, заменится после ее окончания двухфазной структурой жидкости ЖP и образовавшихся αа-кристаллов.
При дальнейшем понижении температуры из оставшейся жидкости выделяются α-кристаллы. Их состав изменится по кривой солидус аА′ в направлении от точки а к точке 6, а жидкости - по кривой ликвидус рА′ в направлении от точки р к точке 5 или Жр αа-6 .
Кристаллизация сплава m1 закончится при температуре t3, когда исчезнут последние следы жидкости Ж5, а все α-кристаллы примут состав точки 6, т.е. исходного сплава.
В интервале t3-t4 сплав m1 охлаждается без каких бы то ни было изменений в структуре (простое физическое охлаждение).
Начиная с температуры t4, из α-кристаллов выделяются вторичные β-кристаллы, что можно записать как α7-a1 -- β8-b1.
В итоге на кривой охлаждения сплава m1 четыре критические точки (рис.9.96). Верхняя критическая точка отвечает Т начала кристаллизации β-раствора, вторая точка (горизонтальная площадка) – Т перитектической реакции, третья - Т конца кристаллизации α-раствора и, наконец, четвертая критическая точка - Тначала выделения из α-вторичных β-кристаллов.
Под микроскопом в сплаве m1 будут видны две структурные составляющие α-кристаллы, образовавшиеся по перитектической реакции и из оставшейся после нее жидкости, и вторичные β-кристаллы, причем последних будет меньше, чем в сплаве n1.
Слайд 44Сплав l1.
Аналогично сплавам m1 и n1 до tP кристаллизуется сплав l1.
Сплав l1.
Аналогично сплавам m1 и n1 до tP кристаллизуется сплав l1.

В результате уменьшения взаимной растворимости компонентов А и В в твердом состоянии при понижении температуры от tP до комнатной в сплаве l1 из оставшихся βb-кристаллов выделятся вторичные α-кристаллы, а из образовавшихся по перитектической реакции αа-кристаллов - соответственно вторичные β-кристаллы, т.е. αа-а1 βb-b1.
На кривой охлаждения сплав l1 имеет две критические точки (рис.9.96), а в структуре - четыре структурные составляющие: первичные β-кристаллы, оставшиеся после перитектической реакции, и внутри них вторичные α-кристаллы, а также образовавшиеся по перитектической реакции α-кристаллы и внутри них вторичные β-кристаллы.
Слайд 45Сплавы l1, р1 и в1
Сплавы l1 Аналогично сплавам m1 и n1
Сплавы l1, р1 и в1
Сплавы l1 Аналогично сплавам m1 и n1

В результате уменьшения взаимной растворимости компонентов А и В в твердом состоянии при понижении температуры от tP до комнатной в сплаве l1 из оставшихся βb-кристаллов выделятся вторичные α-кристаллы, а из образовавшихся по перитектической реакции αа-кристаллов - соответственно вторичные β-кристаллы, т.е. αа-а1 βb-b1.
На кривой охлаждения сплав l1 имеет две критические точки (рис.9.96), а в структуре - четыре структурные составляющие: первичные β-кристаллы, оставшиеся после перитектической реакции, и внутри них вторичные α-кристаллы, а также образовавшиеся по перитектической реакции α-кристаллы и внутри них вторичные β-кристаллы.
Сплав р1 и в1. Сплав, отвечающий по составу точке р , кристаллизуется как α-твердый раствор. Аналогично кристаллизуется сплав, отвечающий по составу точке b однако в нем, начиная с температуры tP, в твердом состоянии из первичных β-выделяются вторичные α-кристаллы.
Особенность этих двух сплавов заключается в том, что в них не протекает перитектическая реакция, так как при температуре tP в первом сплаве есть только жидкость Жp, а во втором - только первичные βb-кристаллы, а этого недостаточно для перитектической реакции.
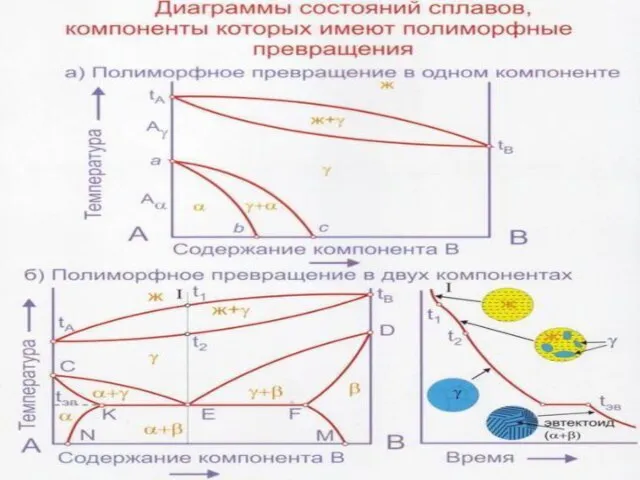
Слайд 46Полиморфизм (аллотропия) – свойство некоторых металлов иметь различные кристаллические решетки при разных
Полиморфизм (аллотропия) – свойство некоторых металлов иметь различные кристаллические решетки при разных
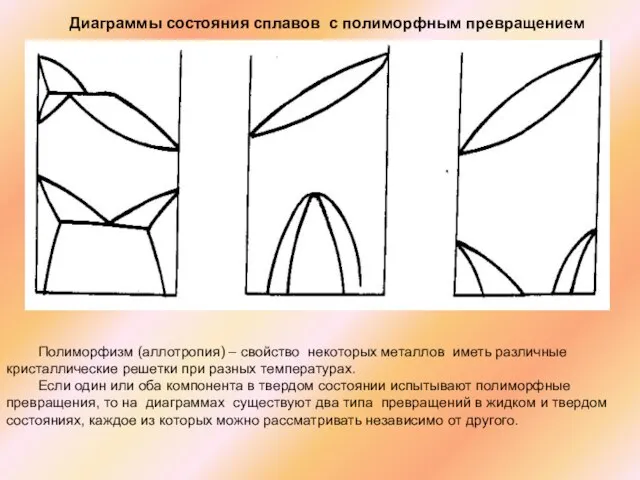
Если один или оба компонента в твердом состоянии испытывают полиморфные превращения, то на диаграммах существуют два типа превращений в жидком и твердом состояниях, каждое из которых можно рассматривать независимо от другого.
Диаграммы состояния сплавов с полиморфным превращением
Слайд 48Сплав 2.
Полная кристаллизация ниже t2.
В точке t3 начинается полиморфное превращение γ↔α,
Полная кристаллизация ниже t2.
В точке t3 начинается полиморфное превращение γ↔α,
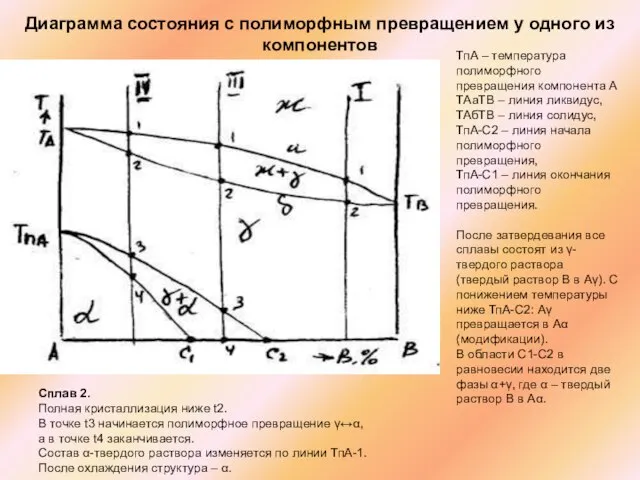
а в точке t4 заканчивается.
Состав α-твердого раствора изменяется по линии ТпА-1.
После охлаждения структура – α.
Диаграмма состояния с полиморфным превращением у одного из компонентов
ТпА – температура полиморфного превращения компонента А ТАаТВ – линия ликвидус, ТАбТВ – линия солидус, ТпА-С2 – линия начала полиморфного превращения,
ТпА-С1 – линия окончания полиморфного превращения.
После затвердевания все сплавы состоят из γ-твердого раствора (твердый раствор В в Аγ). С понижением температуры ниже ТпА-С2: Аγ превращается в Аα (модификации).
В области С1-С2 в равновесии находится две фазы α+γ, где α – твердый раствор В в Аα.
Слайд 49Диаграмма состояния с полиморфным превращением у двух компонентов
:
ТАаТВ – линия
Диаграмма состояния с полиморфным превращением у двух компонентов
:
ТАаТВ – линия
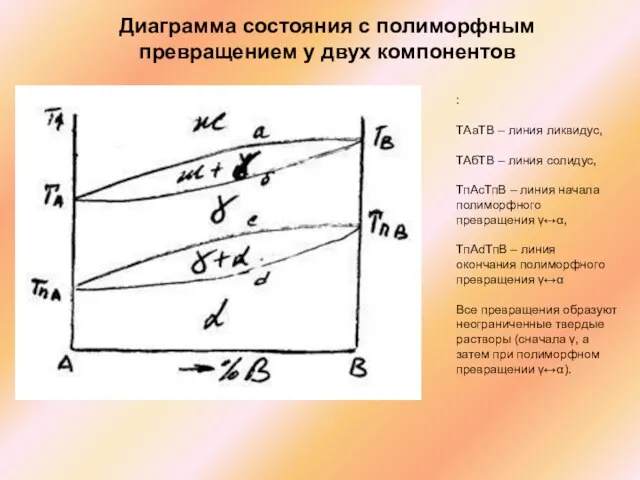
ТАбТВ – линия солидус,
ТпАсТпВ – линия начала полиморфного превращения γ↔α,
ТпАdТпВ – линия окончания полиморфного превращения γ↔α
Все превращения образуют неограниченные твердые растворы (сначала γ, а затем при полиморфном превращении γ↔α).
Слайд 50Диаграмма состояния с полиморфным превращением у одного из компонентов и с перитектическим
Диаграмма состояния с полиморфным превращением у одного из компонентов и с перитектическим
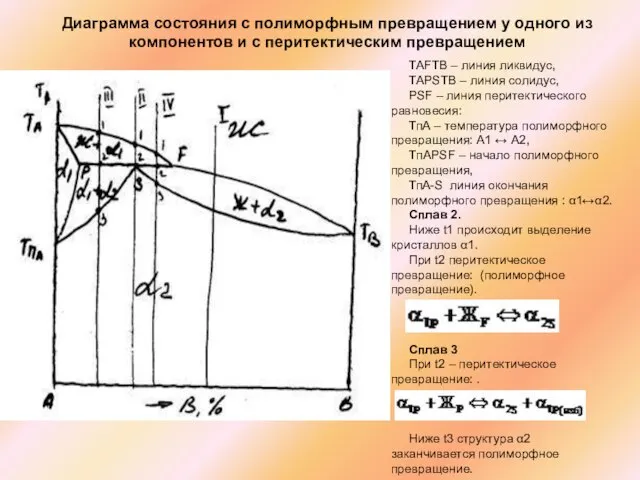
ТАFТВ – линия ликвидус,
ТАPSТВ – линия солидус,
PSF – линия перитектического равновесия:
ТпА – температура полиморфного превращения: А1 ↔ А2,
TпАPSF – начало полиморфного превращения,
ТпА-S линия окончания полиморфного превращения : α1↔α2.
Сплав 2.
Ниже t1 происходит выделение кристаллов α1.
При t2 перитектическое превращение: (полиморфное превращение).
Сплав 3
При t2 – перитектическое превращение: .
Ниже t3 структура α2 заканчивается полиморфное превращение.
Слайд 51Диаграмма состояния с полиморфным превращением двух компонентов и с эвтектоидным превращением
ТпА и
Диаграмма состояния с полиморфным превращением двух компонентов и с эвтектоидным превращением
ТпА и
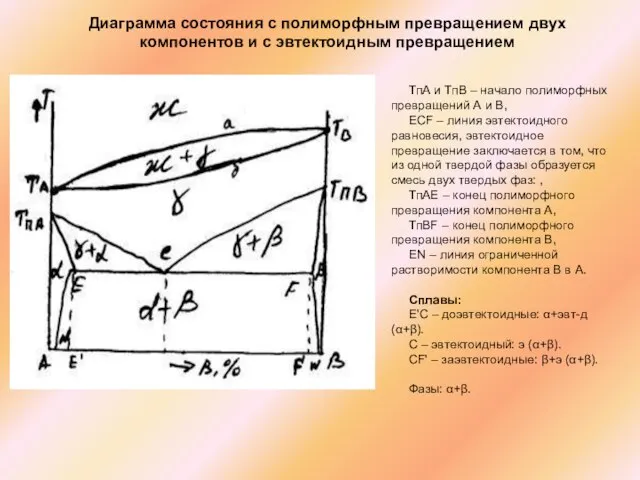
ECF – линия эвтектоидного равновесия, эвтектоидное превращение заключается в том, что из одной твердой фазы образуется смесь двух твердых фаз: ,
ТпАE – конец полиморфного превращения компонента А,
ТпВF – конец полиморфного превращения компонента В,
EN – линия ограниченной растворимости компонента В в А.
Сплавы:
Е'С – доэвтектоидные: α+эвт-д (α+β).
С – эвтектоидный: э (α+β).
CF' – заэвтектоидные: β+э (α+β).
Фазы: α+β.
Слайд 52При образовании смесей свойства сплава изменяются по линейному закону (аддитивно). Значение свойств
При образовании смесей свойства сплава изменяются по линейному закону (аддитивно). Значение свойств
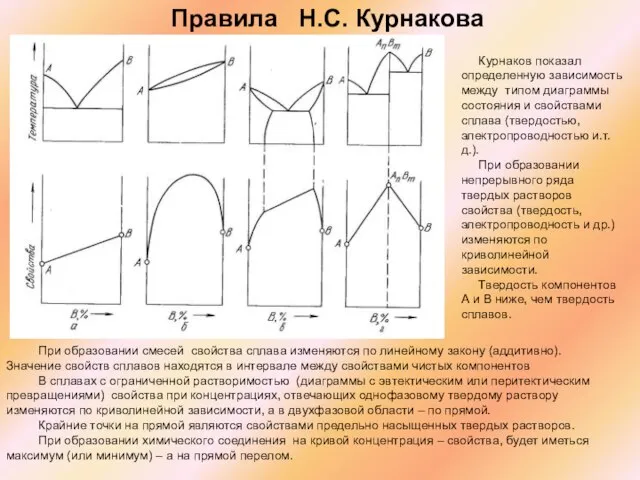
В сплавах с ограниченной растворимостью (диаграммы с эвтектическим или перитектическим превращениями) свойства при концентрациях, отвечающих однофазовому твердому раствору изменяются по криволинейной зависимости, а в двухфазовой области – по прямой.
Крайние точки на прямой являются свойствами предельно насыщенных твердых растворов.
При образовании химического соединения на кривой концентрация – свойства, будет иметься максимум (или минимум) – а на прямой перелом.
Правила Н.С. Курнакова
Курнаков показал определенную зависимость между типом диаграммы состояния и свойствами сплава (твердостью, электропроводностью и.т.д.).
При образовании непрерывного ряда твердых растворов свойства (твердость, электропроводность и др.) изменяются по криволинейной зависимости.
Твердость компонентов А и В ниже, чем твердость сплавов.



 Менеджмент: кризис доверия VS доверие в условиях кризиса27.11.08. Круглый стол. Совместный проект ИМИСП & TRANSEARCH при поддержке «Деловой
Менеджмент: кризис доверия VS доверие в условиях кризиса27.11.08. Круглый стол. Совместный проект ИМИСП & TRANSEARCH при поддержке «Деловой  Северо-восточная Русь.
Северо-восточная Русь. Международный день образования
Международный день образования Рисунок линия 3 – 4 класс
Рисунок линия 3 – 4 класс Click to edit Master title style Click to edit Master subtitle style
Click to edit Master title style Click to edit Master subtitle style  Организация исследовательской деятельности обучающихся на уроках математики и во внеурочное время Подготовила:
Организация исследовательской деятельности обучающихся на уроках математики и во внеурочное время Подготовила:  План на 2023 год
План на 2023 год Презентация на тему Город Кельн
Презентация на тему Город Кельн  РЕЧЕВОЙ ЭТИКЕТ
РЕЧЕВОЙ ЭТИКЕТ Жостовская роспись 3 класс
Жостовская роспись 3 класс История становления и развития логистики. Сущность и содержание логистики
История становления и развития логистики. Сущность и содержание логистики Презентация на тему Мир глазами астронома
Презентация на тему Мир глазами астронома  Менің отаным – Қазақстан
Менің отаным – Қазақстан Living in a big city or in a small town
Living in a big city or in a small town Выполнила учитель изобразительного искусства школы № 4 г. Балтийска Лютикова И.В.
Выполнила учитель изобразительного искусства школы № 4 г. Балтийска Лютикова И.В. Дизайн одежды
Дизайн одежды Инструкция по заполнению анкеты
Инструкция по заполнению анкеты Интеллектуальная игра «Что? Где? Когда?»
Интеллектуальная игра «Что? Где? Когда?» Guy Fawkes' Day
Guy Fawkes' Day Биотехнология
Биотехнология Банковская модель:мобильные платежи
Банковская модель:мобильные платежи Пожарные в живописи
Пожарные в живописи Цель урока: 1. Познакомить с жизнью и творчеством Ф. И. Тютчева. 2. Содействовать воспитанию любви к поэзии. 3. Обогащать духовный мир у
Цель урока: 1. Познакомить с жизнью и творчеством Ф. И. Тютчева. 2. Содействовать воспитанию любви к поэзии. 3. Обогащать духовный мир у ICQ в мире и в Беларуси Аудитория и статистика Рекламные площадки Нестандартные опции
ICQ в мире и в Беларуси Аудитория и статистика Рекламные площадки Нестандартные опции Использование технологии развития критического мышления учащихся (ТРКМ) на уроках
Использование технологии развития критического мышления учащихся (ТРКМ) на уроках Тема-8-Технич-экспл и обслуж
Тема-8-Технич-экспл и обслуж Украинская культура во второй половине 20 века
Украинская культура во второй половине 20 века Игра волейбол
Игра волейбол