Содержание
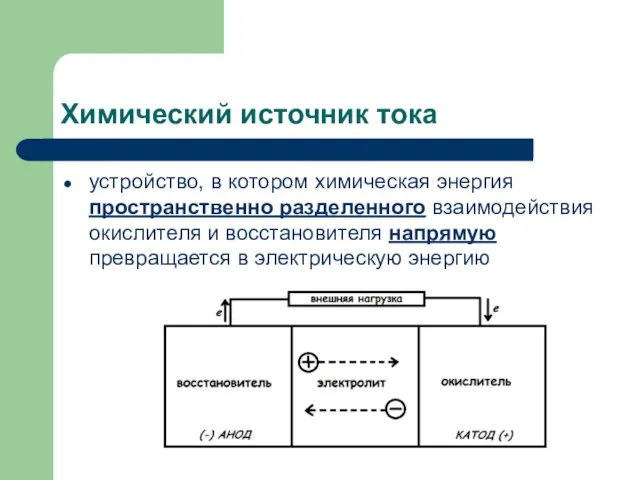
- 2. Химический источник тока устройство, в котором химическая энергия пространственно разделенного взаимодействия окислителя и восстановителя напрямую превращается
- 3. Почему литий? самый отрицательный электродный потенциал среди металлов (-3,04 В в водном растворе) самая высокая удельная
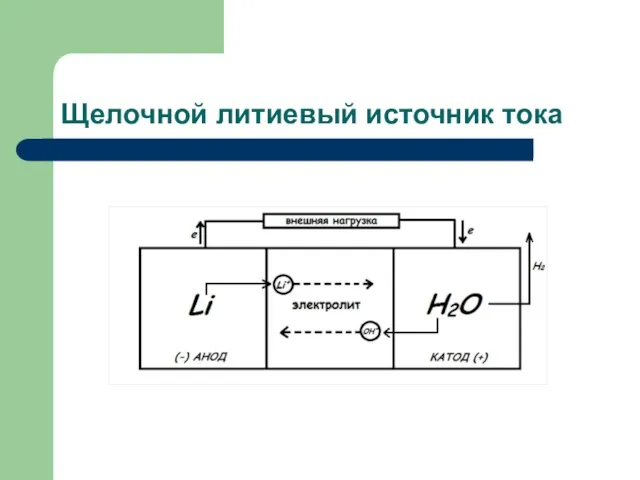
- 4. Щелочной литиевый источник тока
- 5. Требования к неводным растворителям Устойчивость лития Способность образовывать А) концентрированные Б) высокоэлектропроводные растворы литиевых солей
- 6. Литий - «слишком» активный металл термодинамические расчеты показывают принципиальную возможность восстановления литием ВСЕХ мыслимых веществ, которые
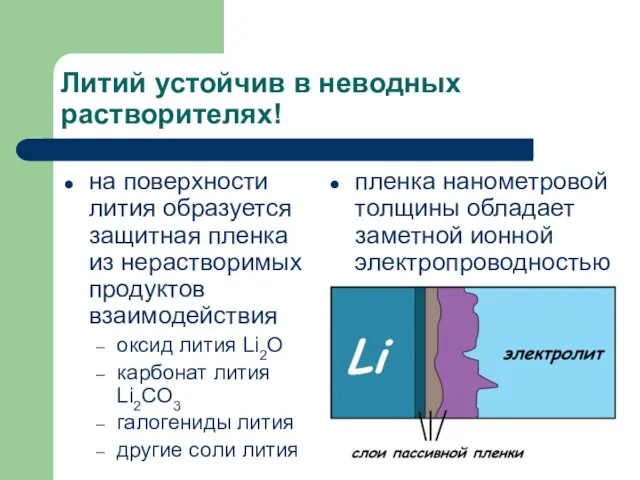
- 7. Литий устойчив в неводных растворителях! на поверхности лития образуется защитная пленка из нерастворимых продуктов взаимодействия оксид
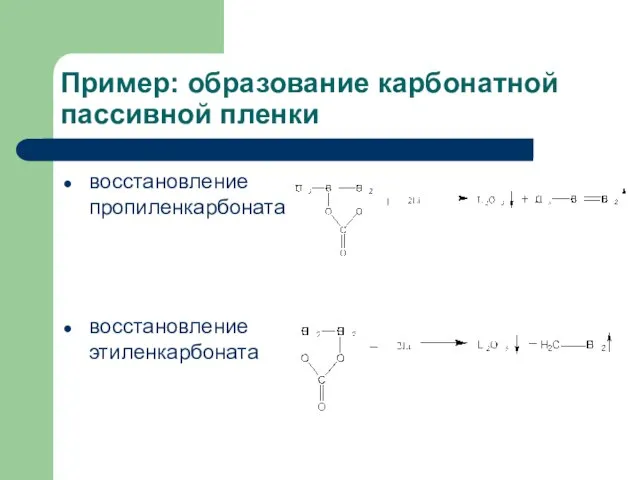
- 8. Пример: образование карбонатной пассивной пленки восстановление пропиленкарбоната восстановление этиленкарбоната
- 9. Неводные растворители: проблема растворимости Простые литиевые соли и основание (LiOH, LiNO3 и др.) не растворяются в
- 10. Неводные растворители: проблема низкой электропроводности Пропиленкарбонат, этиленкарбонат: (+) Высокая диэлектрическая проницаемость соли хорошо диссоциируют (-) Большая
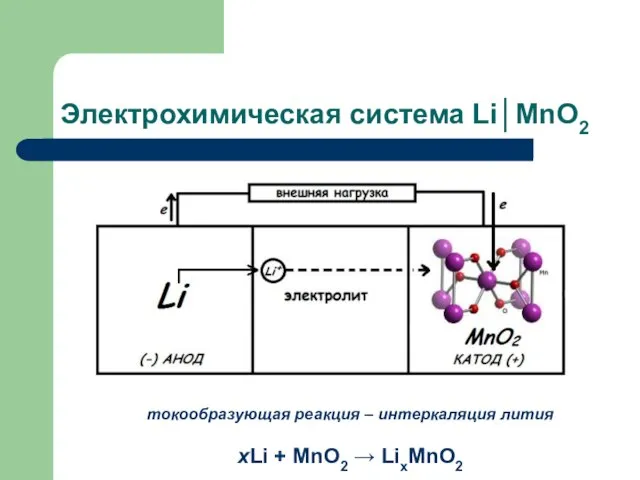
- 11. Электрохимическая система Li│MnO2 токообразующая реакция – интеркаляция лития хLi + MnO2 → LixMnO2
- 12. Металлический литий и аккумуляторы несовместимы? ПРОБЛЕМА: защитная пленка инкапсюлирует литий
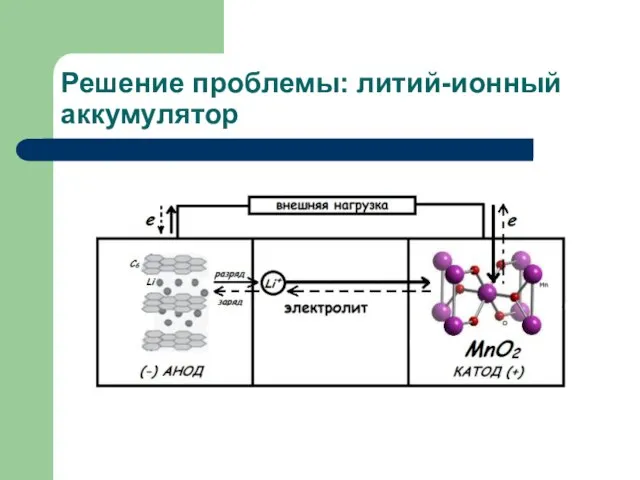
- 13. Решение проблемы: литий-ионный аккумулятор
- 14. Токообразующая реакция: непрерывная перекачка ионов Li+
- 16. Скачать презентацию







 Презентация на тему Алгебра и логика высказываний
Презентация на тему Алгебра и логика высказываний Заболевание височно-нижнечелюстного сустава
Заболевание височно-нижнечелюстного сустава  Конфликтный треугольник: семья-ребенок-образовательное учреждение. Детская агрессия
Конфликтный треугольник: семья-ребенок-образовательное учреждение. Детская агрессия кольцово
кольцово Проблемы преемственности начального и основного (общего) образования
Проблемы преемственности начального и основного (общего) образования Проектная деятельность
Проектная деятельность Власть. Структурная и ситуационная власть
Власть. Структурная и ситуационная власть Свечникова В.В. правоведение тема 2 презентация
Свечникова В.В. правоведение тема 2 презентация Майолика. Гутные изделия. Ковка
Майолика. Гутные изделия. Ковка Saint Petersburg state University
Saint Petersburg state University  Форма и размеры Земли
Форма и размеры Земли Поздравление крестной жениха
Поздравление крестной жениха Гендерные аспекты образования и рынка труда
Гендерные аспекты образования и рынка труда Геометрия на службе у архитектуры
Геометрия на службе у архитектуры Психология двигательно-волевой сферы психической деятельности
Психология двигательно-волевой сферы психической деятельности Команда звёздочки
Команда звёздочки История семейного образования в СанктПетербурге
История семейного образования в СанктПетербурге Русский пейзаж в поэзии и живописи
Русский пейзаж в поэзии и живописи Физическая культура в период самоизоляции студентов педагогического вуза
Физическая культура в период самоизоляции студентов педагогического вуза Заповедники России
Заповедники России Презентация на тему Прощание с 1 классом
Презентация на тему Прощание с 1 классом Клёш и фалды
Клёш и фалды Быть нормальным
Быть нормальным Основные формы рельефа Алтайского края
Основные формы рельефа Алтайского края  Проект: Комплексное сопровождение покупки страховой компании
Проект: Комплексное сопровождение покупки страховой компании Сделка. Предпринимательская деятельность
Сделка. Предпринимательская деятельность русский язык - язык международного общения
русский язык - язык международного общения Условия признания и исполнения иностранных судебных решений
Условия признания и исполнения иностранных судебных решений