Содержание
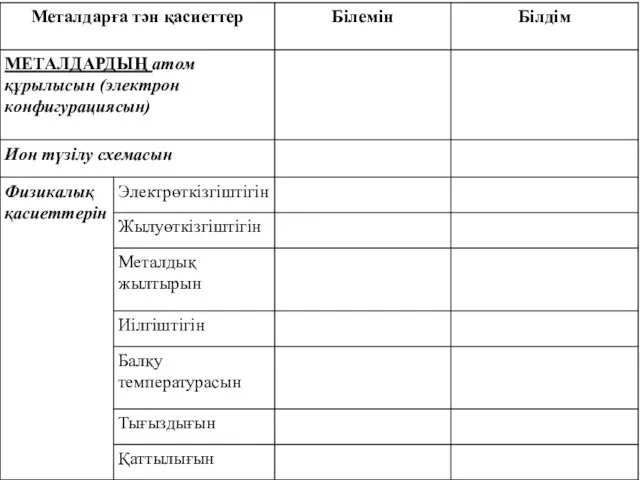
- 2. Металдарға тән қасиеттер
- 3. Оқу мақсаты: 9.1.4.12 кристалл торы мен байланыс түрлері тұрғысынан металдардың физикалық қасиеттерін түсіндіру
- 4. Бағалау критерийлері: Оқушылар оқу мақсатына жетеді, егер: - Металдардың периодтық жүйедегі орны арқылы оның қасиеттерін сипаттай
- 5. «Блиц-сұрау»: 1. Периодтық кестеде металдарды қандай белгілеріне байланысты бөледі? 2. «Типтік» металдар деген қандай металдар? Периодтық
- 6. «Типтік» металдар «Типтік» металдар – бұл s-элементтері (Li-дан Fr-ға дейін IA тобының элементтері; Mg-дан Ra-ға дейін
- 7. Металдық байланыс қалай түзіледі?
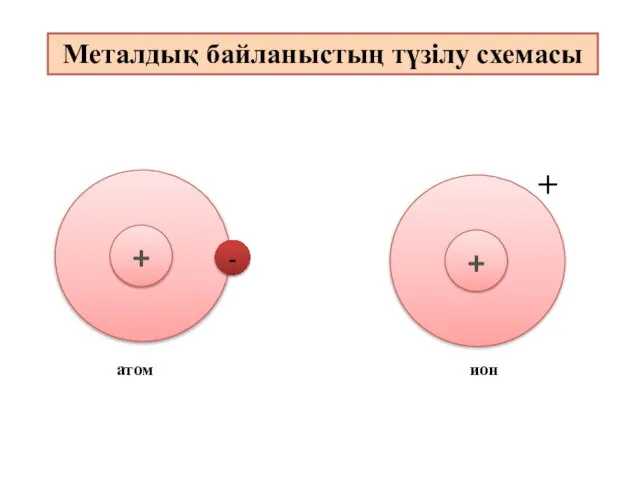
- 8. Металдық байланыстың түзілу схемасы атом ион
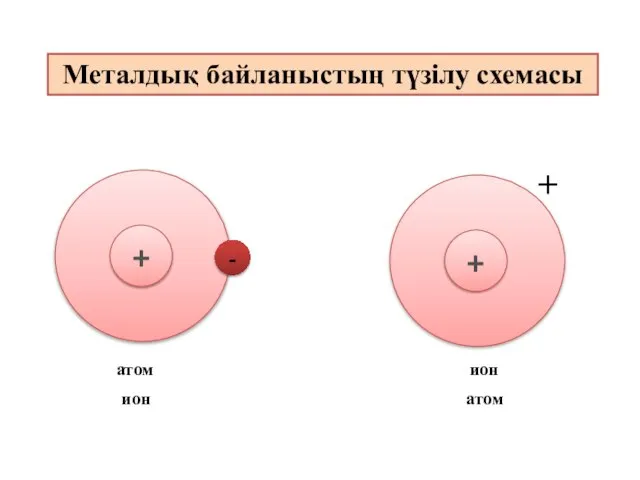
- 9. - + + атом ион ион атом Металдық байланыстың түзілу схемасы
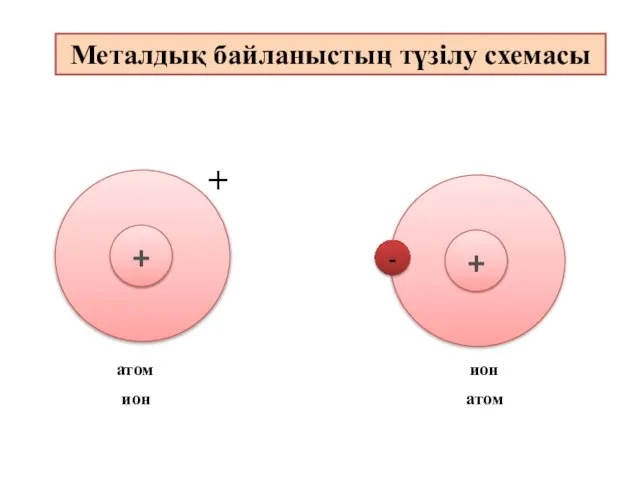
- 10. - + + ион атом атом ион Металдық байланыстың түзілу схемасы
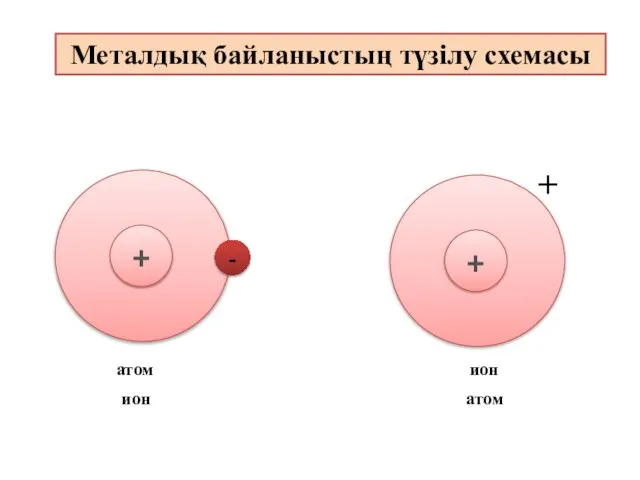
- 11. - + + атом ион ион атом Металдық байланыстың түзілу схемасы
- 12. Металдық байланыс - электостатикалық тартылу нәтижесінде металл атомдары мен оң зарядталған иондар және бос электрондар арасында
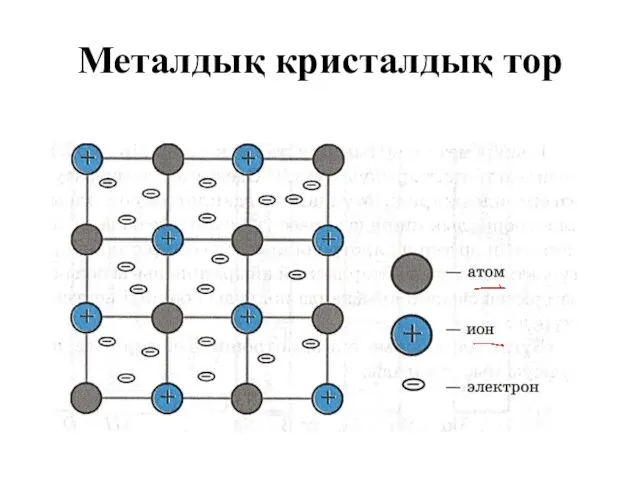
- 14. Металдық кристалдық тор
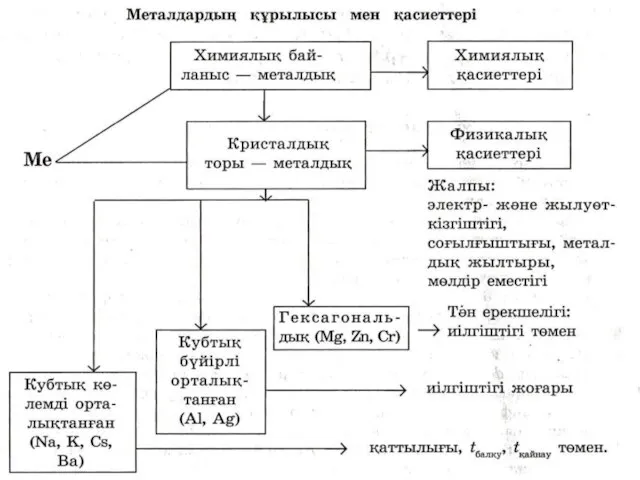
- 15. Металдық кристалдық тор Металдардың кристалдық торлары екі типті болады: кубтық (екі түрлі – бүйірлі орталықтанған, көлемді
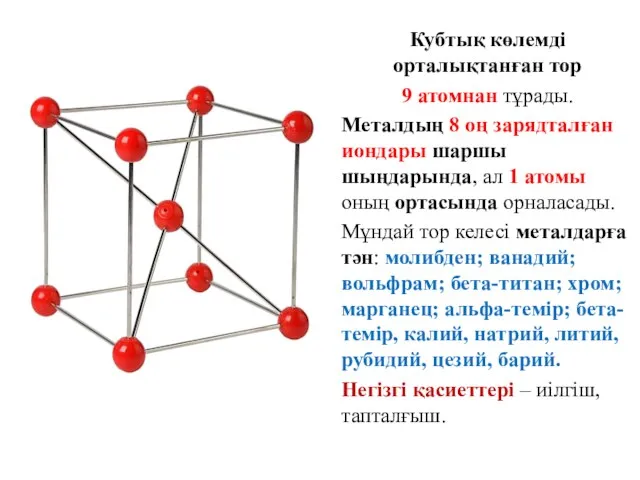
- 16. Кубтық көлемді орталықтанған тор 9 атомнан тұрады. Металдың 8 оң зарядталған иондары шаршы шыңдарында, ал 1
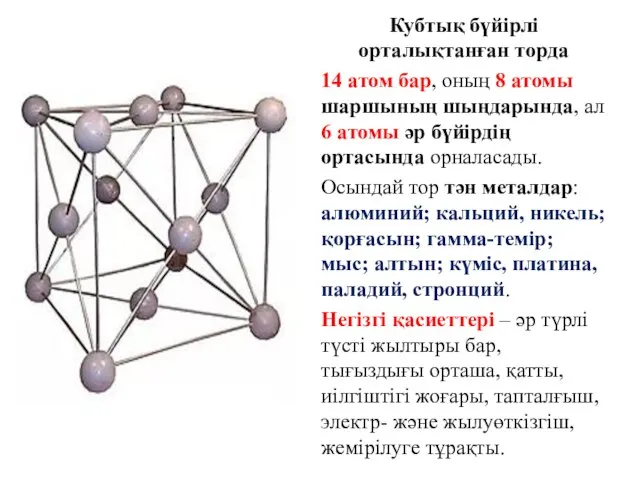
- 17. Кубтық бүйірлі орталықтанған торда 14 атом бар, оның 8 атомы шаршының шыңдарында, ал 6 атомы әр
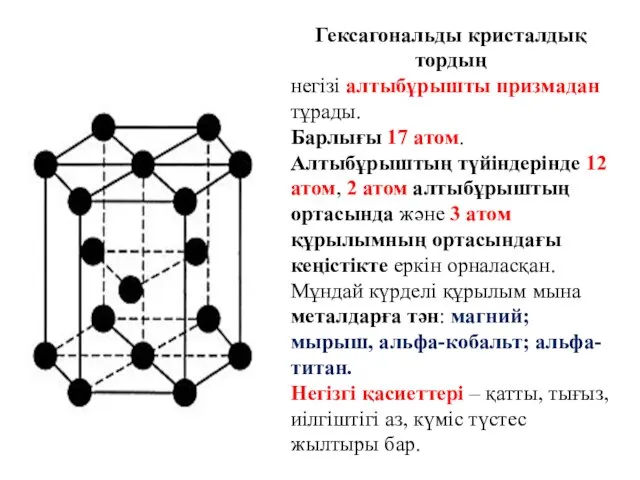
- 18. Гексагональды кристалдық тордың негізі алтыбұрышты призмадан тұрады. Барлығы 17 атом. Алтыбұрыштың түйіндерінде 12 атом, 2 атом
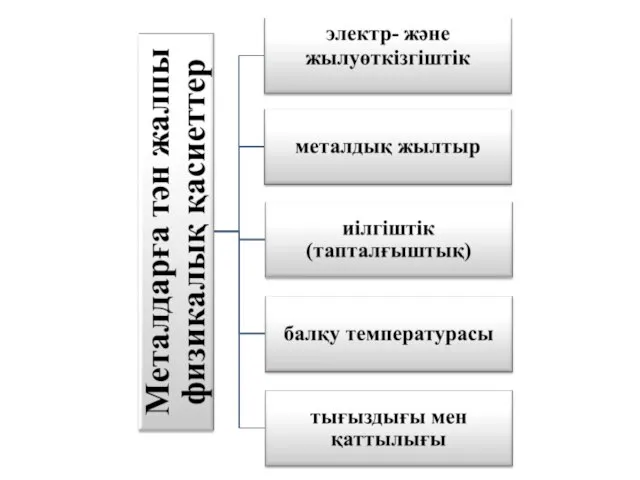
- 20. Металдардың маңызды физикалық қасиеттерін атаңыздар
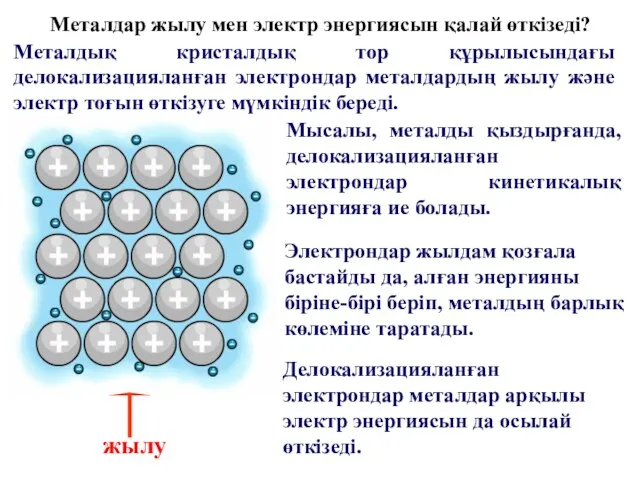
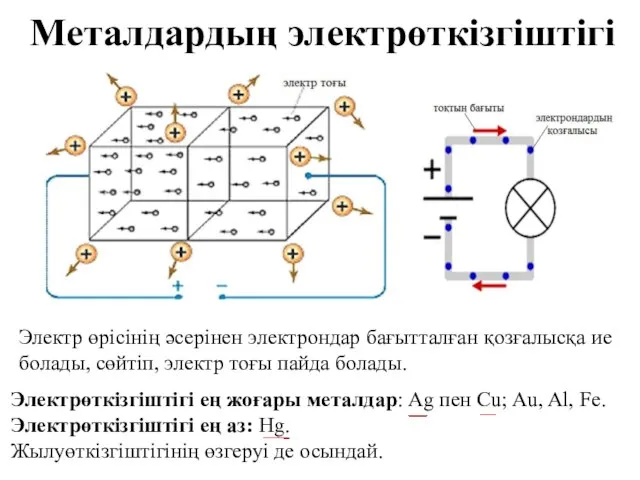
- 22. Металдар жылу мен электр энергиясын қалай өткізеді? Металдық кристалдық тор құрылысындағы делокализацияланған электрондар металдардың жылу және
- 23. Металдардың электрөткізгіштігі Электрөткізгіштігі ең жоғары металдар: Ag пен Cu; Au, Al, Fe. Электрөткізгіштігі ең аз: Hg.
- 24. Металдық жылтыр Бос электрондардың әсері. Жарық металл бетімен сіңіріліп, оның электрондары өздерінің сәулелену толқындарын шығара бастайды,
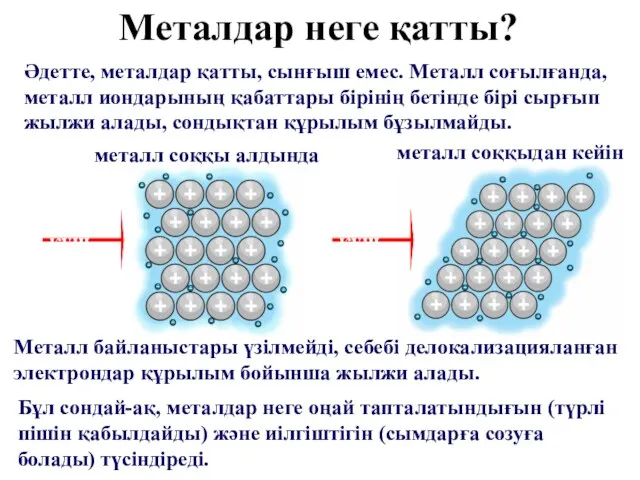
- 25. Әдетте, металдар қатты, сынғыш емес. Металл соғылғанда, металл иондарының қабаттары бірінің бетінде бірі сырғып жылжи алады,
- 26. Металдардың иілгіштігі мынадай қатар бойынша кемиді: Au, Ag, Cu, Sn, Pb, Zn, Fe 1000 °С-тан жоғары
- 27. Металдардың тығыздығы 5 г/см3 – ден аз болса, жеңіл, ал одан асса, ауыр металдар деп бөлінеді.
- 28. Кіші период бойынша және үлкен периодтың жұп қатарында металдардың қаттылығы, балқу температурасы, тығыздығы артады, ал негізгі
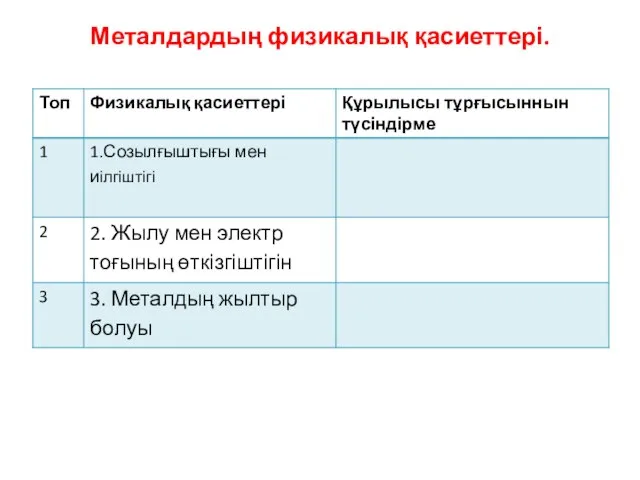
- 29. Металдардың физикалық қасиеттері.
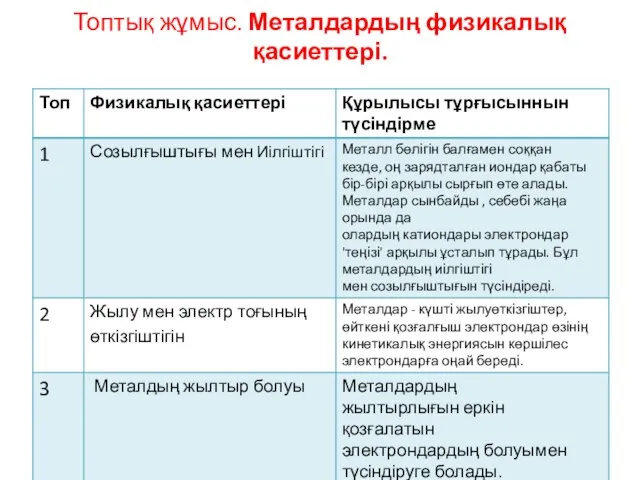
- 30. Топтық жұмыс. Металдардың физикалық қасиеттері.
- 33. Скачать презентацию







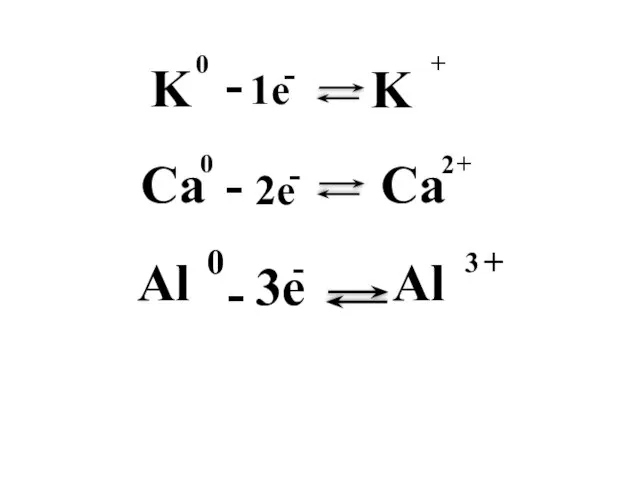






 ООО «ЭкоЛайф 69»
ООО «ЭкоЛайф 69» Борьба Руси с иноземным нашествием в XIII в.
Борьба Руси с иноземным нашествием в XIII в. Формы и методы развития исследовательских способностей
Формы и методы развития исследовательских способностей Подбор, обучение и мониторинг персонала Call центров.
Подбор, обучение и мониторинг персонала Call центров. Наследственное право РФ
Наследственное право РФ Приготовление пресного сдобного теста и изделий из него
Приготовление пресного сдобного теста и изделий из него Парковая зона театра им. Натальи Сац
Парковая зона театра им. Натальи Сац правда и вымыслы об акулах
правда и вымыслы об акулах 1. ПР №1 - Тема -1ч. Развитие психики и сознания
1. ПР №1 - Тема -1ч. Развитие психики и сознания Презентация на тему Личные финансы
Презентация на тему Личные финансы Маленькая фея: новинки
Маленькая фея: новинки Настенная живопись
Настенная живопись Комплексное обеспечение процессов в сфере складской логистики, производства и ритейла
Комплексное обеспечение процессов в сфере складской логистики, производства и ритейла Санаторий Марциальные воды в Карелии. Лечение, отдых, встречи
Санаторий Марциальные воды в Карелии. Лечение, отдых, встречи Алгоритм психологической организации группы. Лекция 1
Алгоритм психологической организации группы. Лекция 1 МЕНЕДЖМЕНТ
МЕНЕДЖМЕНТ Современные принципы государственной политики в области МСБ: налоговое регулирование, доступ к финансам
Современные принципы государственной политики в области МСБ: налоговое регулирование, доступ к финансам О финансировании медицинских организаций в системе ОМС в 2011 году и перспективах перехода на одноканальное финансирование в 2011-201
О финансировании медицинских организаций в системе ОМС в 2011 году и перспективах перехода на одноканальное финансирование в 2011-201 Выборы президента школы
Выборы президента школы Оценка информированности учащихся ГБОУ СОШ № 499 по проблемам, связанным с потреблением наркотиков
Оценка информированности учащихся ГБОУ СОШ № 499 по проблемам, связанным с потреблением наркотиков Н.Д. Голев
Н.Д. Голев Продажа маральников и земельных участков
Продажа маральников и земельных участков Автономный контроллер освещения
Автономный контроллер освещения Система управления предприятием Облик-ERP.Конфигурация Оперативное управление предприятием.
Система управления предприятием Облик-ERP.Конфигурация Оперативное управление предприятием. Эмоции эмпатии и вины
Эмоции эмпатии и вины Особенности формирования производственного плана в лесной отрасли
Особенности формирования производственного плана в лесной отрасли Презентация на тему Биологическое действие радиоактивных излучений
Презентация на тему Биологическое действие радиоактивных излучений Школа молодого политика Лидер
Школа молодого политика Лидер