Содержание
- 2. Написание двух полуреакций и получение затем путем их суммирования общего уравнения, называется метод полуреакций. Одна из
- 3. На примере реакции между перманганат - ионом и ионом железа (II) в кислом растворе, проиллюстрируем последовательность
- 4. 1. Разделим это уравнение на два уравнения полуреакций: полуреакции окисления и полуреакции восстановления. восстановление (б) окисление
- 5. 3. В уравнении (б) число атомов марганца уже уравнено. Подсчитаем число атомов кислорода и водорода, уравняем
- 6. 5. Тоже самое проделываем для уравнения (в). Получим: (е) 6. Уравниваем число электронов в уравнениях (д)
- 7. 7. Сложим алгебраически оба уравнения: Перейдем от ионного уравнения к полному («молекулярному»):
- 8. Закрепление материала
- 9. Задание 1 Запишите окисление сульфита калия перманганатом калия в кислотной среде: Задание 2 Запишите процесс окисления
- 10. Схематическое уравнение для этой реакции: 1. Разделим это уравнение на два уравнения полуреакций: полуреакции окисления и
- 11. 3. В уравнении число атомов марганца уже уравнено. Подсчитаем число атомов кислорода и водорода, уравняем их:
- 12. 5. Тоже самое проделываем для уравнения. Получим: 6. Уравниваем число электронов в уравнениях. Оно должно быть
- 13. 7. Сложим алгебраически оба уравнения: Перейдем от ионного уравнения к полному: +
- 16. Скачать презентацию













 History of English I
History of English I Рассылки против блоговКирилл Чистов
Рассылки против блоговКирилл Чистов Способ фильтрования воды
Способ фильтрования воды How big am i
How big am i ПРОЕКТ "Сетевой Ресурсный центр
ПРОЕКТ "Сетевой Ресурсный центр Ажурные снежинки
Ажурные снежинки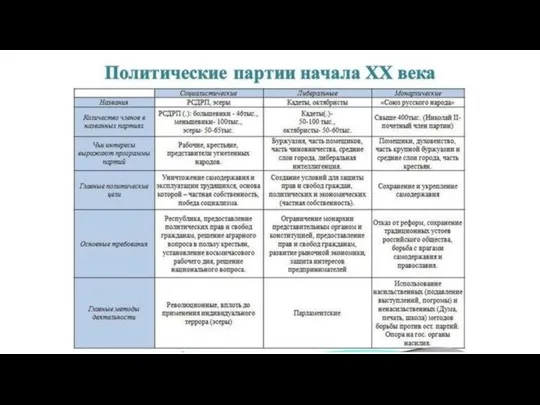 Политические партии начала ХХ века
Политические партии начала ХХ века Жить в Сибири. Сельский воркаут. КРОО Новый день
Жить в Сибири. Сельский воркаут. КРОО Новый день Презентация на тему Политические системы
Презентация на тему Политические системы О РАЗРАБОТКЕ СОДЕРЖАНИЯ ПРОФИЛЬНОЙ ПОДГОТОВКИ БАКАЛАВРОВ С ИСПОЛЬЗОВАНИЕМ ПРОФЕССИОНАЛЬНЫХ СТАНДАРТОВ ИТ-ОТРАСЛИ
О РАЗРАБОТКЕ СОДЕРЖАНИЯ ПРОФИЛЬНОЙ ПОДГОТОВКИ БАКАЛАВРОВ С ИСПОЛЬЗОВАНИЕМ ПРОФЕССИОНАЛЬНЫХ СТАНДАРТОВ ИТ-ОТРАСЛИ АМЕРИКАНСКИЕ УРОКИ
АМЕРИКАНСКИЕ УРОКИ Занятие 10
Занятие 10 С праздником. День Защиты детей
С праздником. День Защиты детей Ошибки в формах числа имен существительных
Ошибки в формах числа имен существительных Проект «Мобильные платежи»
Проект «Мобильные платежи» Презентация на тему строение скелета человека 4 класс
Презентация на тему строение скелета человека 4 класс  ИНСТРУМЕНТАРИЙДЛЯ ПЛАНИРОВАНИЯ И РЕШЕНИЯ СОЦИАЛЬНО-ЭКОНОМИЧЕСКИХ ПРОБЛЕМ РЕГИОНАЛЬНОГО РАЗВИТИЯ И ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ
ИНСТРУМЕНТАРИЙДЛЯ ПЛАНИРОВАНИЯ И РЕШЕНИЯ СОЦИАЛЬНО-ЭКОНОМИЧЕСКИХ ПРОБЛЕМ РЕГИОНАЛЬНОГО РАЗВИТИЯ И ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ История физики в вопросах
История физики в вопросах План на 2023 год
План на 2023 год 单词卡
单词卡 Гражданское законодательство
Гражданское законодательство Галактика ERP
Галактика ERP -1945 Презентацию подготовила Ларионова Е.Н. Учитель начальных классов МОУ «Гимназия» № 9
-1945 Презентацию подготовила Ларионова Е.Н. Учитель начальных классов МОУ «Гимназия» № 9 И как в рай, в Божий храм Запросилась душа
И как в рай, в Божий храм Запросилась душа GAP-анализ
GAP-анализ Ваша безопасность в наших руках
Ваша безопасность в наших руках Простые механизмы
Простые механизмы ЭЛЕКТИВНЫЕ КУРСЫ
ЭЛЕКТИВНЫЕ КУРСЫ