Содержание
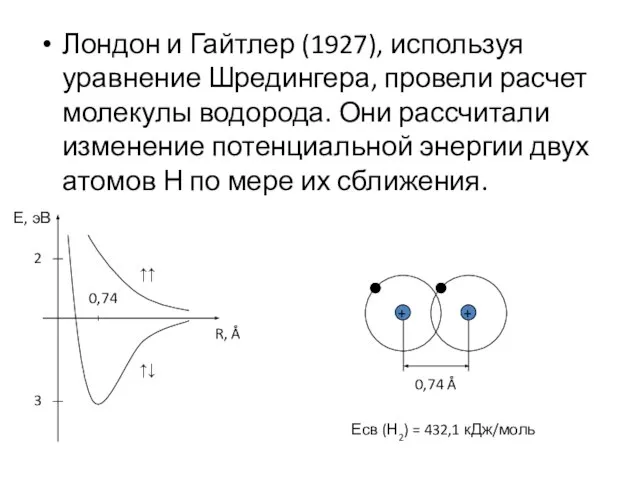
- 2. Лондон и Гайтлер (1927), используя уравнение Шредингера, провели расчет молекулы водорода. Они рассчитали изменение потенциальной энергии
- 4. Образование хими-ческой связи всегда сопровождается выделением энергии
- 5. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ КОВАЛЕНТНАЯ ИОННАЯ МЕТАЛЛИЧЕСКАЯ ВОДОРОДНАЯ
- 6. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
- 7. Свойства ковалентной связи: насыщаемость, направленность, поляризуемость.
- 8. Насыщаемость – способ-ность атомов образовывать ограниченное число кова-лентных связей в соответ-ствии с числом его внешних атомных
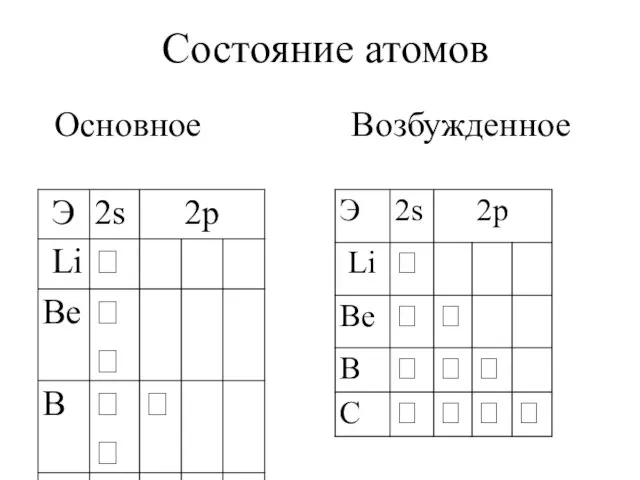
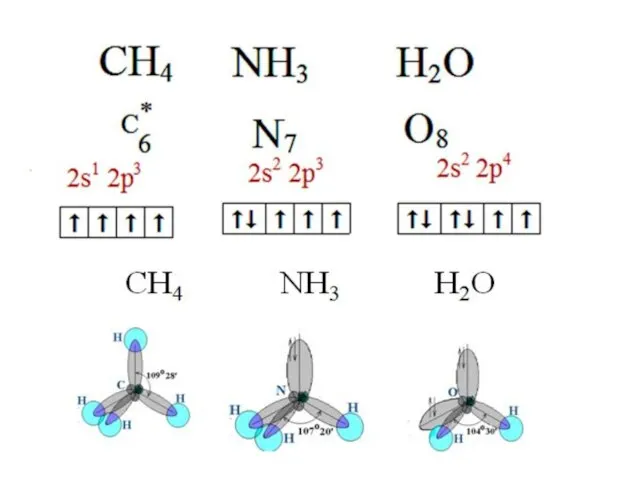
- 9. Состояние атомов Основное Возбужденное
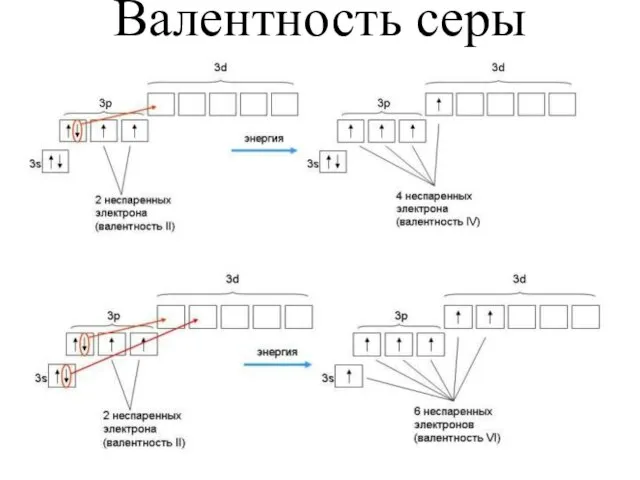
- 10. Валентность серы
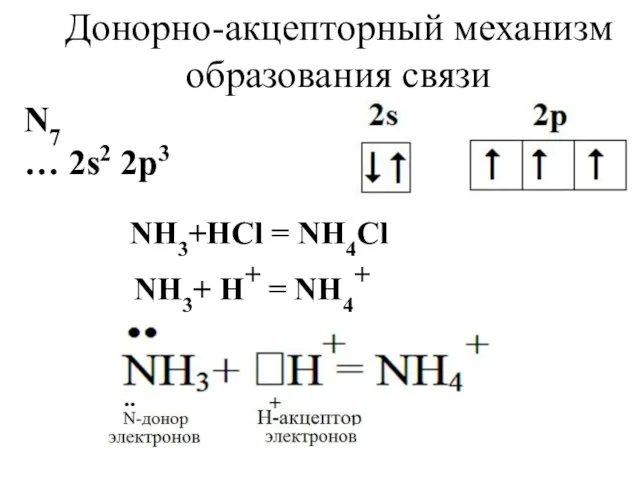
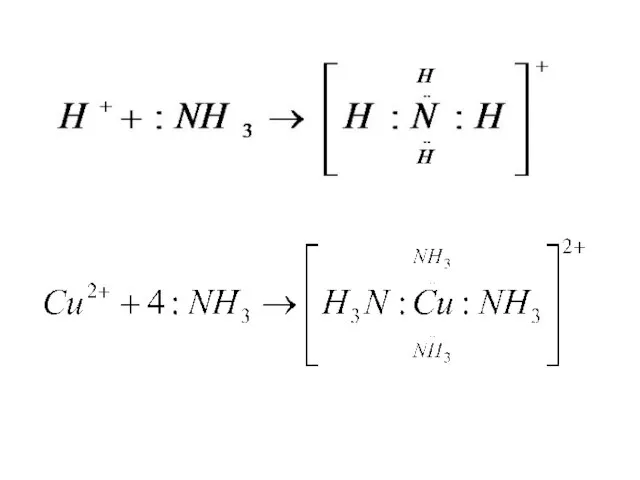
- 11. Донорно-акцепторный механизм образования связи N7 … 2s2 2p3 NH3+HCl = NH4Cl NH3+ H+ = NH4+
- 13. 29Cu2+ 1s2 2s2 2p6 3s2 3p6 3d8 4s? 4p??? 29Cu 1s2 2s2 2p6 3s2 3p6 3d94s1
- 14. Направленность ковалентной связи обусловлена тем, что р-, d- и f-орбитали имеют различную конфи-гурацию, и перекрывание электронных
- 15. Гибридизация- это смешивание электронных облаков и образование новых облаков равной формы и равной энергии. Если атом
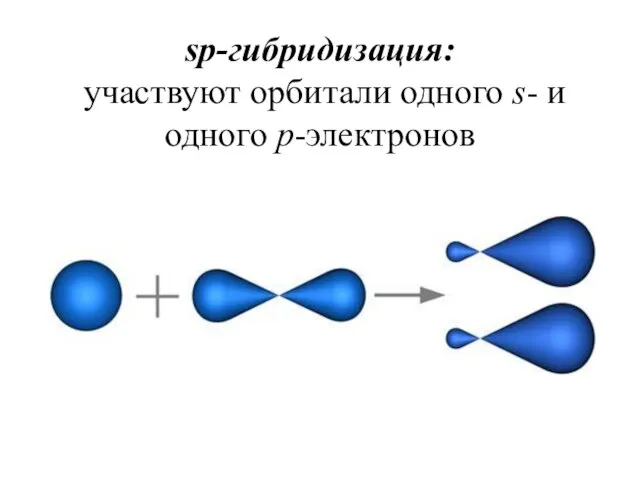
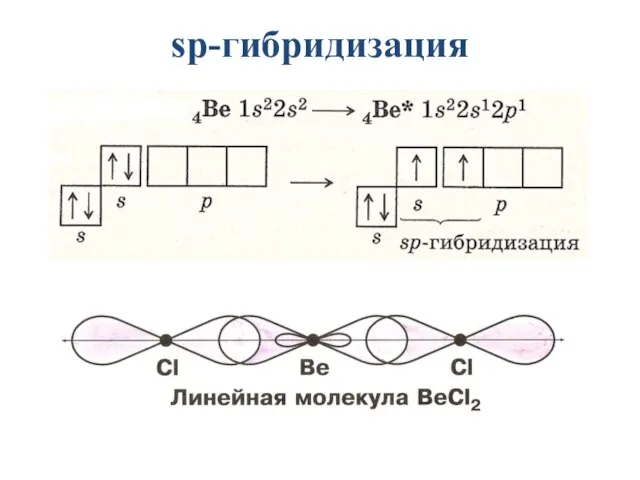
- 16. sp-гибридизация: участвуют орбитали одного s- и одного p-электронов
- 17. Образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180° 2 sp-гибридные орбитали
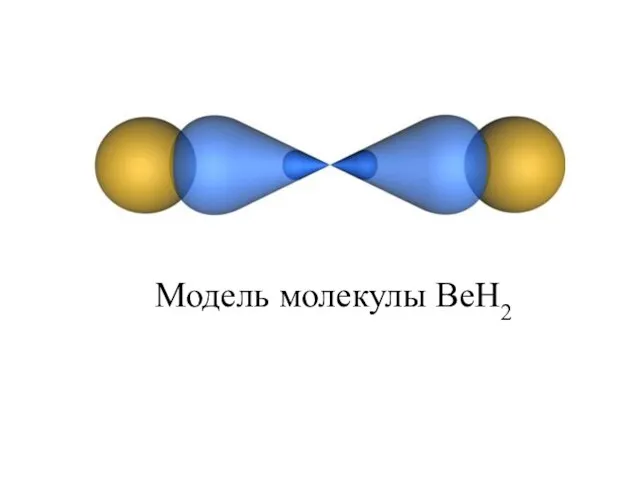
- 18. рис. 4. Модель молекулы BeH2
- 19. sp-гибридизация
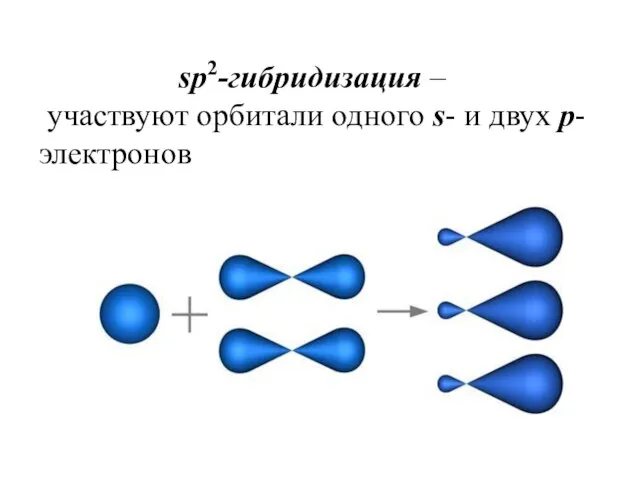
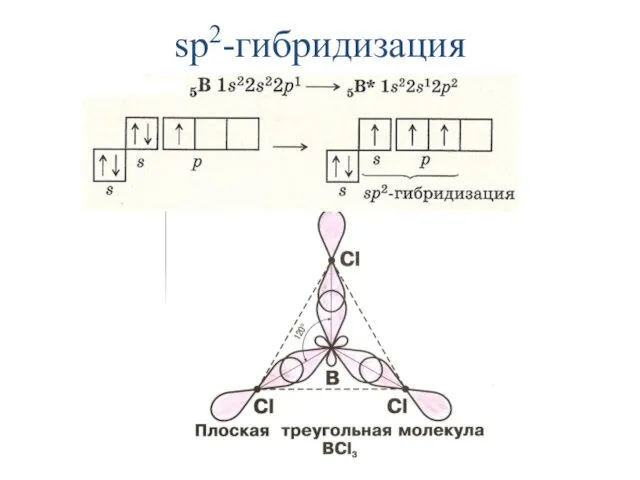
- 20. одного s- и двух p-электронов (рис. 1). sp2-гибридизация – участвуют орбитали одного s- и двух p-электронов
- 21. Образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
- 22. sp2-гибридизация
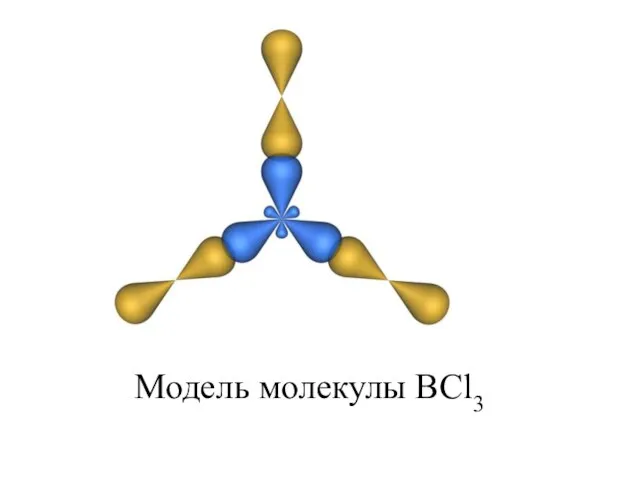
- 23. Модель молекулы BCl3
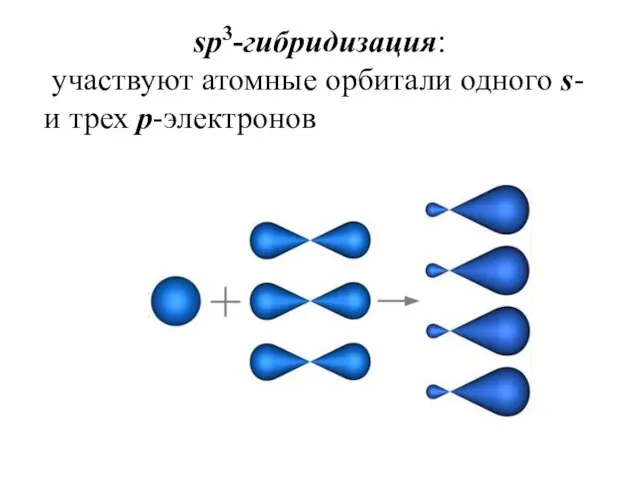
- 24. sp3-гибридизация: участвуют атомные орбитали одного s- и трех p-электронов
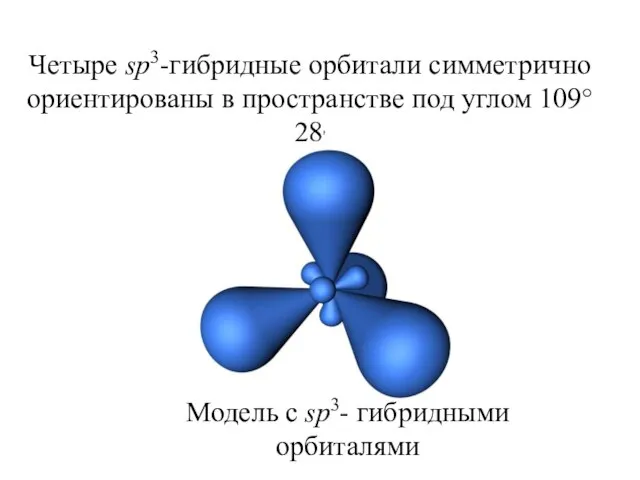
- 25. Модель с sp3- гибридными орбиталями Четыре sp3-гибридные орбитали симметрично ориентированы в пространстве под углом 109°28'
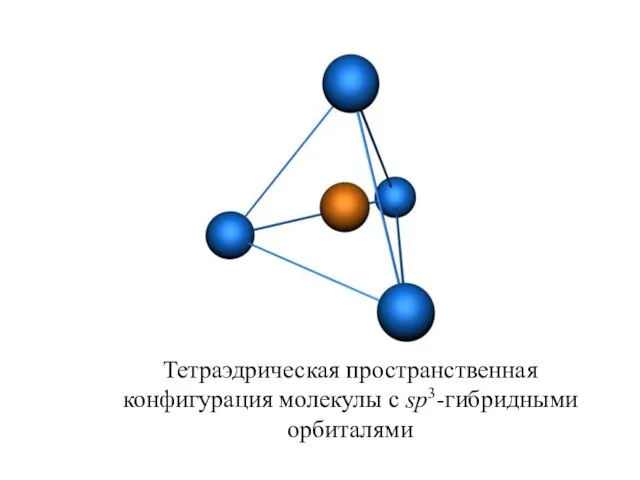
- 26. Тетраэдрическая пространственная конфигурация молекулы с sp3-гибридными орбиталями
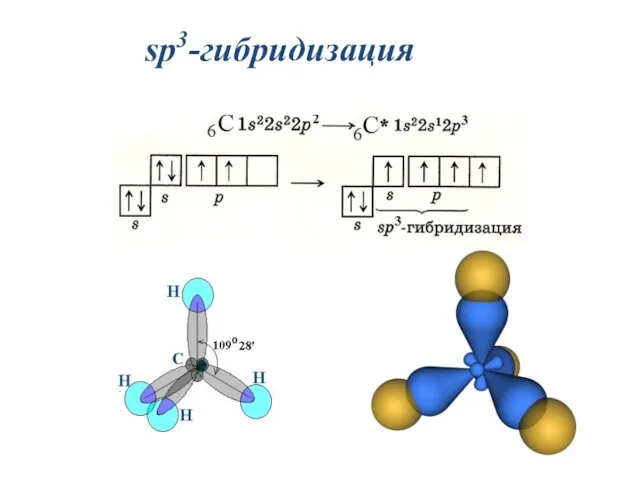
- 27. sp3-гибридизация
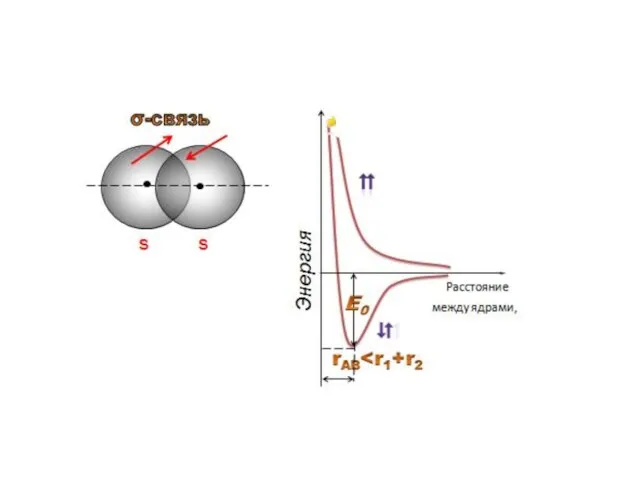
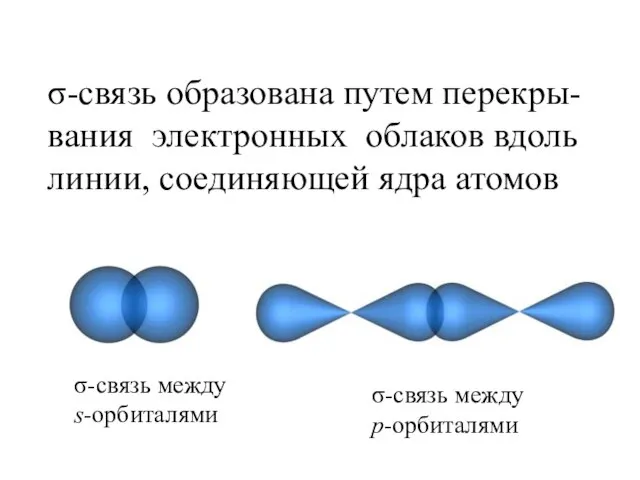
- 29. σ-связь образована путем перекры- вания электронных облаков вдоль линии, соединяющей ядра атомов σ-связь между p-орбиталями σ-связь
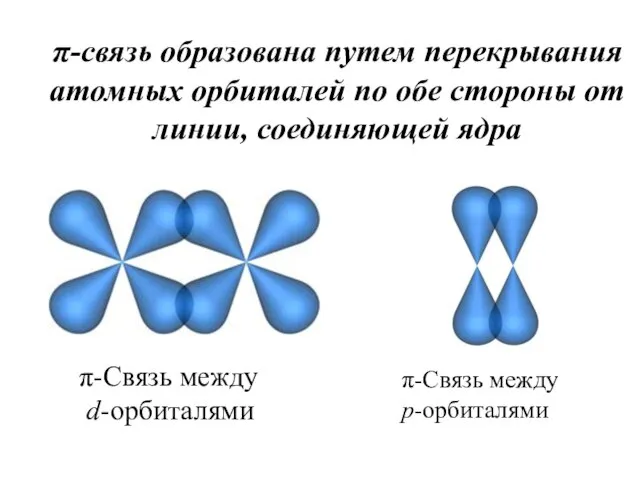
- 30. π-связь образована путем перекрывания атомных орбиталей по обе стороны от линии, соединяющей ядра π-Связь между d-орбиталями
- 31. Неполярная ковалентной связь образуется между атомами одного и того же элемента (Н2, N2 и т.д.) или
- 32. Между атомами разных элементов происходит смещение электронного облака в сторону более электроотри-цательного атома , что называется
- 33. Дипольный момент – количественная характеристика полярности связи: μ = qэфф⋅lдип qэфф– эффект. заряд, lдип – длина
- 34. Дипольный момент – векторная величина, направленная от (+) к (–) . Различают дипольные моменты химической связи
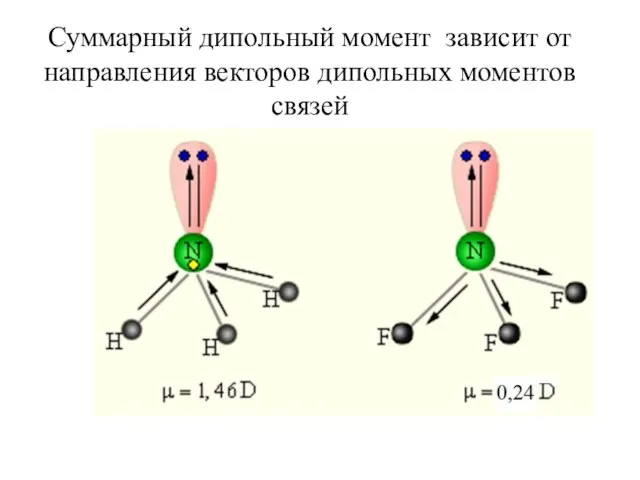
- 35. Суммарный дипольный момент зависит от направления векторов дипольных моментов связей
- 37. Скачать презентацию














 Презентация на тему Элементы человеческой психики и сознания
Презентация на тему Элементы человеческой психики и сознания НСО Актуальные проблемы лингвистической экспертизы
НСО Актуальные проблемы лингвистической экспертизы Презентация на тему Перикл (др.-греч. «окружённый славой»
Презентация на тему Перикл (др.-греч. «окружённый славой» Презентация на тему Детский сад глазами ребенка
Презентация на тему Детский сад глазами ребенка Презентация на тему Энергетические напитки Энергетические напитки (энергетики, энерготоники)
Презентация на тему Энергетические напитки Энергетические напитки (энергетики, энерготоники)  Презентация на тему Профессия программист
Презентация на тему Профессия программист  Креационизм
Креационизм Российские рекомендации качественной рекламы. Версия 1
Российские рекомендации качественной рекламы. Версия 1 Разработка уникальных продуктов для мобильных устройств
Разработка уникальных продуктов для мобильных устройств Как грамотно устроиться на работу
Как грамотно устроиться на работу Академия здоровья
Академия здоровья Информационно-новостной портал www.SEGODNYA.ua
Информационно-новостной портал www.SEGODNYA.ua «Лицевой счет. Управление дебиторской задолженностью»
«Лицевой счет. Управление дебиторской задолженностью» Life Club - возможность заработка
Life Club - возможность заработка Портфолио
Портфолио Формирование читательской компетентности младших школьников
Формирование читательской компетентности младших школьников Зоология 3 урок Губки
Зоология 3 урок Губки Святой, воспетый бояном
Святой, воспетый бояном Федеральная стажировочная площадка по теме «Обеспечение доступности дошкольного образования через организацию вариативных форм
Федеральная стажировочная площадка по теме «Обеспечение доступности дошкольного образования через организацию вариативных форм السلطات الحكوميّة؛ وذلك من أجل قبول الودائع
السلطات الحكوميّة؛ وذلك من أجل قبول الودائع Портретная фотография
Портретная фотография Договор страхования имущества
Договор страхования имущества Когда не видишь свет
Когда не видишь свет Using novels in the classroom
Using novels in the classroom Пасха - Великий праздник
Пасха - Великий праздник Ссылки должны работать!
Ссылки должны работать! Финансовый менеджмент в иностранных компаниях
Финансовый менеджмент в иностранных компаниях