Содержание
- 2. Современная фармакотерапия: высокоактивная («агрессивная», но много ОТС), обезличенная (официнальная, «перегрузка» MR), вариабельная (старение популяции, экофакторы), комбинированная
- 3. Масштаб проблем безопасности ЛС оценивается результатами фармако-эпидемиологических исследований: В США: 3,5-8,8 млн. пациентов ежегодно госпитализируется вследствие
- 4. Контроль безопасности ЛС – это выявление, анализ и предупреждение любых возможных проблем, связанных с ЛС (медицинских
- 5. Медицинские проблемы, связанные с ЛС. 1. Нежелательные побочные реакции (НПР). 2. Off-label (не по инструкции); и
- 6. Типы НПР (классификация ВОЗ)
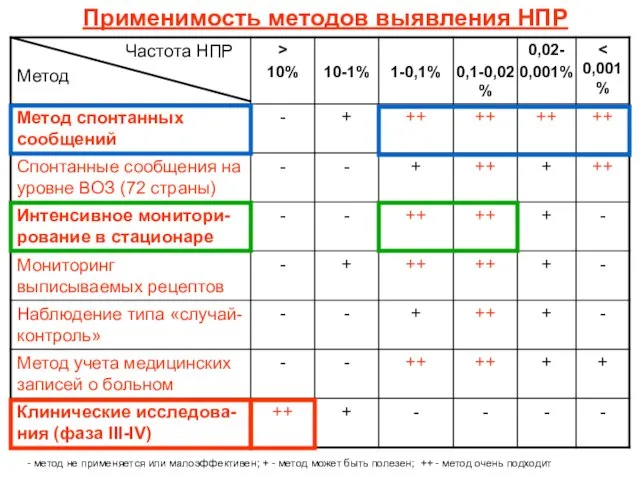
- 7. Применимость методов выявления НПР - метод не применяется или малоэффективен; + - метод может быть полезен;
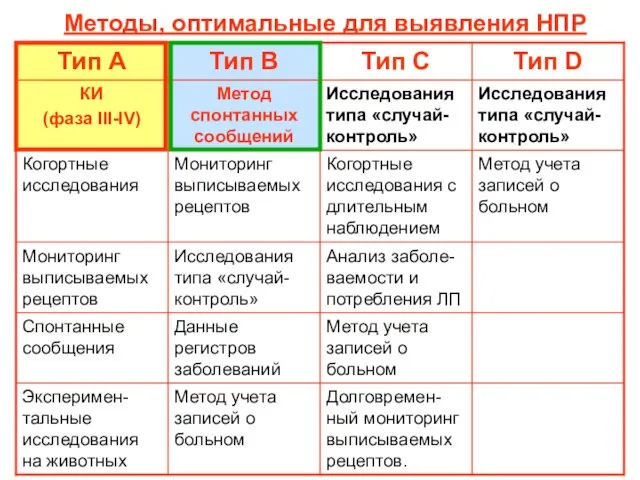
- 8. Методы, оптимальные для выявления НПР
- 9. Цель системы контроля безопасности – это снижение заболеваемости и смертности, вызываемых ЛС. Безопасность ЛП должна изучаться
- 10. Этапы исследования безопасности ЛС: ДКИ (вероятность предсказания переносимости человеком – 65-70%) КИ (выявляют риск НПР ⊇1%)
- 11. Для чего нужна фаза-4 ? В связи с тем, что ДКИ и КИ не позволяют выявить
- 12. Развитие систем контроля безопасности ЛС США: 1906 г. - Харли Вашингтон Вайли - “Бюро Химии” (с
- 13. Национальные центры контроля безопасности Включенные в структуру контрольно-разрешительных систем, регламентирующих обращение ЛС: США, Канада, Австралия, ФРГ,
- 14. Международное сотрудничество в области контроля безопасности ЛС 1962 г. (через 9 месяцев после выявления «талидомидовой эпидемии»)
- 15. Рекомендации по совершенствованию службы контроля безопасности ЛП Повышение уровня компетенции мед.и фарм.работников – введение в программы
- 17. Скачать презентацию












 Водорастворимые витамины
Водорастворимые витамины Занятия Мои друзья. Мое увлечение
Занятия Мои друзья. Мое увлечение Сладкие шляпки
Сладкие шляпки Открытый и закрытый слоги Eve Ken
Открытый и закрытый слоги Eve Ken ГЕОМЕТРИЯ
ГЕОМЕТРИЯ Обзор системы и процесса усыновления
Обзор системы и процесса усыновления Презентация на тему Литр (1 класс)
Презентация на тему Литр (1 класс) Презентация на тему Токсикомания
Презентация на тему Токсикомания JUVENILE justice
JUVENILE justice Что мы знаем о птицах
Что мы знаем о птицах Источники права периода централизации государства
Источники права периода централизации государства Презентация по теме: Химические реакции
Презентация по теме: Химические реакции Внутренняя модель данных
Внутренняя модель данных Местечко Ажерово и его обитатели
Местечко Ажерово и его обитатели Управление инвестиционно-строительным проектом в области складской логистики
Управление инвестиционно-строительным проектом в области складской логистики Бордюры
Бордюры Легко ли быть режиссером?
Легко ли быть режиссером? Менеджмент в ресторанном бизнесе
Менеджмент в ресторанном бизнесе Правоотношения
Правоотношения БЭСТ-5. АПТЕКАТо, что доктор прописал!
БЭСТ-5. АПТЕКАТо, что доктор прописал! Разработка и написание проекта
Разработка и написание проекта С днём рождения друг
С днём рождения друг Презентация на тему Линзы Оптика 8 класс
Презентация на тему Линзы Оптика 8 класс  ФГОС НОО (Выполнила Кибиткина С.В., учитель СОШ № 2 г. Ершова
ФГОС НОО (Выполнила Кибиткина С.В., учитель СОШ № 2 г. Ершова Духовно-нравственное становление личности
Духовно-нравственное становление личности Презентация на тему Кто что ест
Презентация на тему Кто что ест Организация и управление закупочной деятельностью
Организация и управление закупочной деятельностью Простые механизмы. Применение в быту, технике и живой природе
Простые механизмы. Применение в быту, технике и живой природе