Содержание
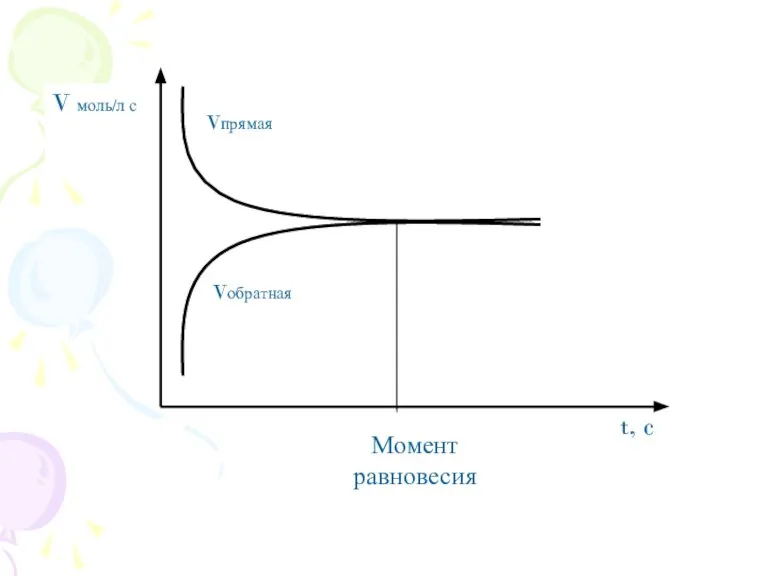
- 2. Углубить и обобщить знания о состоянии химического равновесия, условиях его смещения. Дать понятие о константе равновесия.
- 3. Какие из химических реакций являются обратимыми? 1. NaOH + HCl ? NaCl + H2O 2. N2
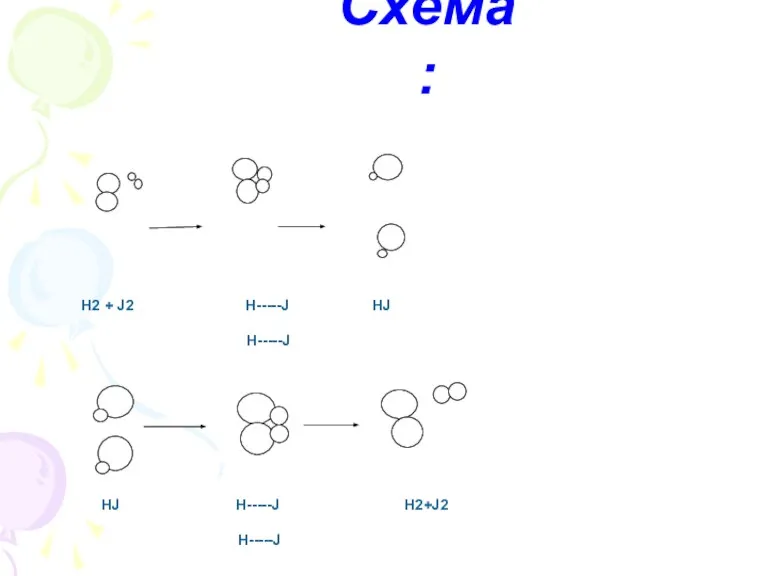
- 4. Схема: Н2 + J2 Н-----J HJ Н-----J HJ Н-----J H2+J2 Н-----J
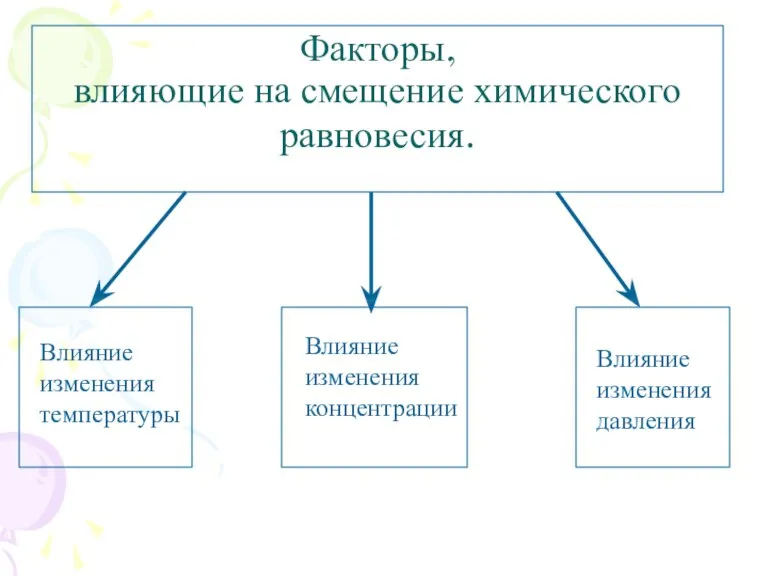
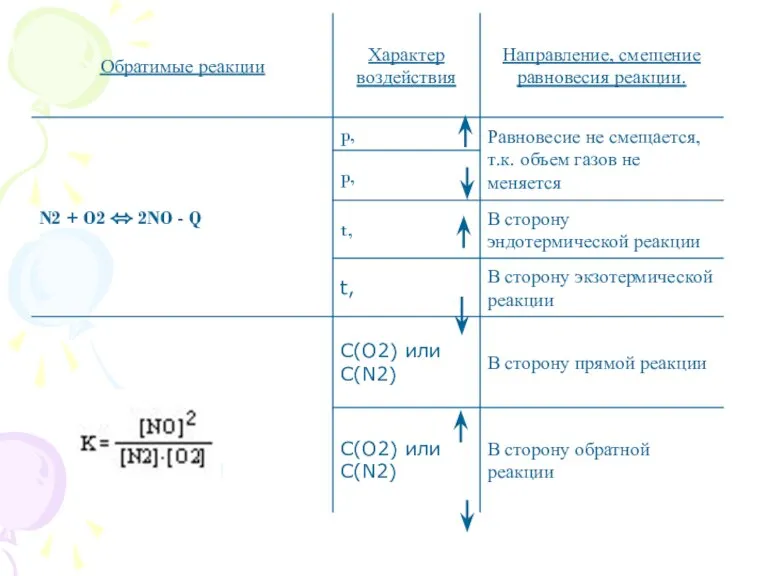
- 6. Факторы, влияющие на смещение химического равновесия.
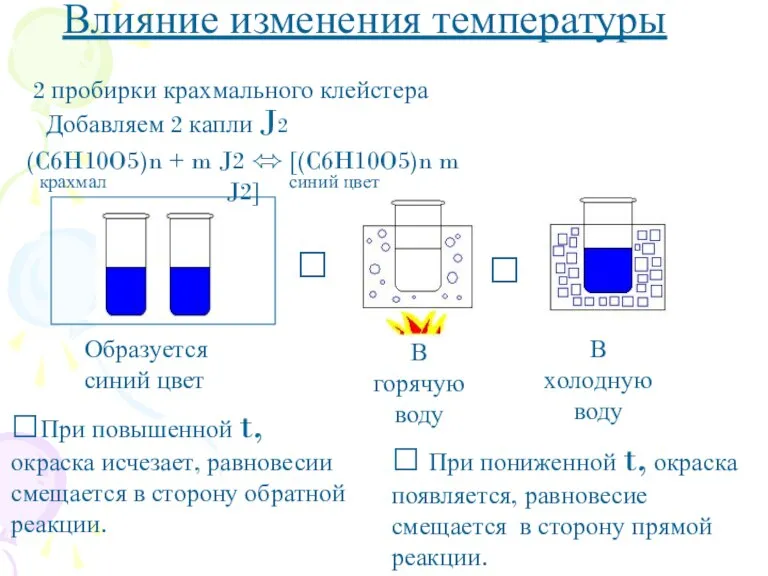
- 7. ? ? Влияние изменения температуры 2 пробирки крахмального клейстера Добавляем 2 капли J2 ?При повышенной t,
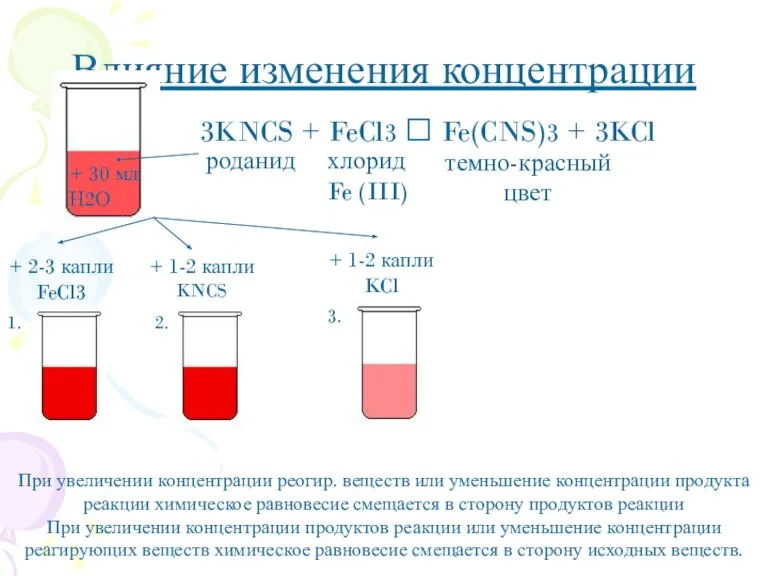
- 8. Влияние изменения концентрации + 2-3 капли FeCl3 + 1-2 капли KNCS + 1-2 капли KCl При
- 9. Влияние изменения давления 2NO2 ⬄ N2O4 + Q При расширении цвет газа стал темно-бурым, а равновесие
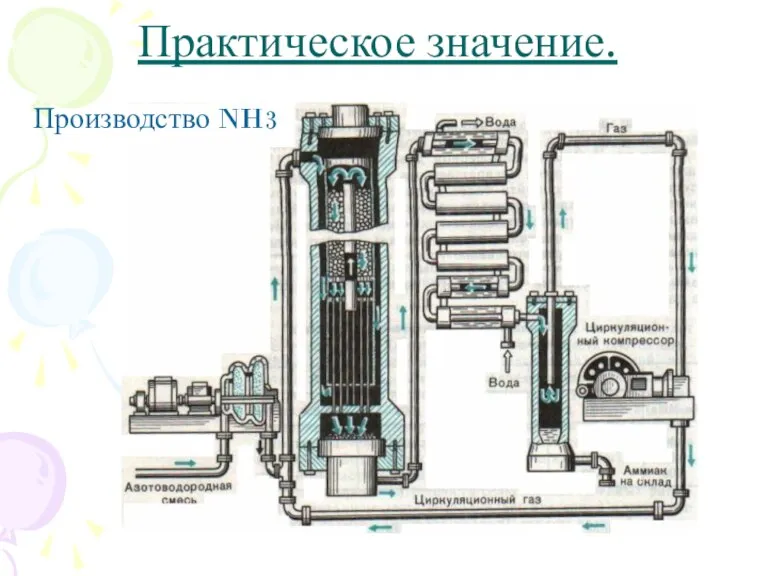
- 10. Практическое значение. Производство NH3
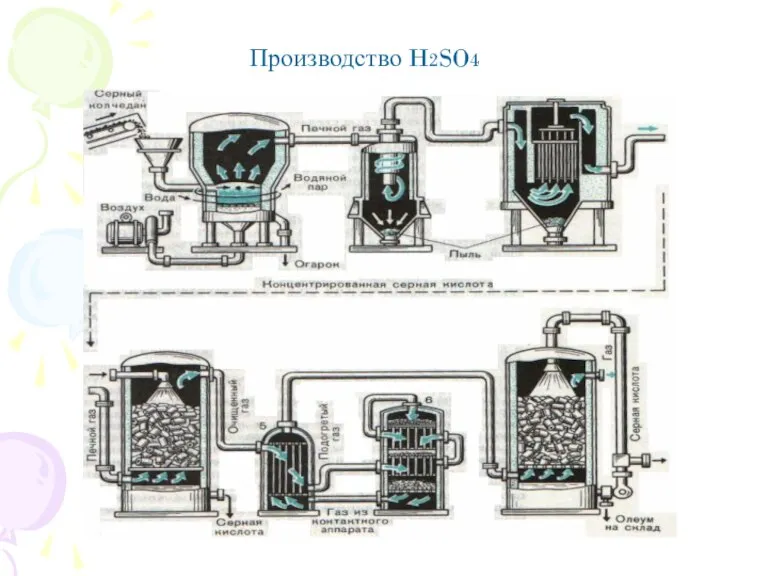
- 11. Производство H2SO4
- 12. Производство HNO3
- 13. 1.Смещение химического равновесия обеспечивает высокий выход желаемого продукта. 2. Открывает путь к управлению химическими реакциями.
- 16. Скачать презентацию





 Проект линии по выработке булки ярославской сдобной
Проект линии по выработке булки ярославской сдобной Заимствования в русском языке из английского
Заимствования в русском языке из английского Концепция электронной библиотеки лучших практик работы некоммерческого сектора в Свердловской области
Концепция электронной библиотеки лучших практик работы некоммерческого сектора в Свердловской области Презентация на тему Романтические произведения М. Горького
Презентация на тему Романтические произведения М. Горького  Издержки фирмы в долгосрочном периоде
Издержки фирмы в долгосрочном периоде Современные средства поражения (продолжение). Занятие №10, часть 2
Современные средства поражения (продолжение). Занятие №10, часть 2 кп.ppt
кп.ppt Как открыть брокерский счет
Как открыть брокерский счет Режиссер-постановщик: Владимир Бортко. Автор сценария: Наталия Бортко. По одноименной повести Михаила Афанасьевича Булгакова Опе
Режиссер-постановщик: Владимир Бортко. Автор сценария: Наталия Бортко. По одноименной повести Михаила Афанасьевича Булгакова Опе Welcome программа
Welcome программа МЕЖДУНАРОДНАЯ ЭКОНОМИЧЕСКАЯ ИНТЕГРАЦИЯ
МЕЖДУНАРОДНАЯ ЭКОНОМИЧЕСКАЯ ИНТЕГРАЦИЯ  Компьютерное моделирование
Компьютерное моделирование Презентация на тему Обзор программ по музыкальному воспитанию детей дошкольного возраста
Презентация на тему Обзор программ по музыкальному воспитанию детей дошкольного возраста Типовое проектирование ИС
Типовое проектирование ИС Памятка застройщику по вопросам размещения информации в ЕИСЖС_pptx (1)
Памятка застройщику по вопросам размещения информации в ЕИСЖС_pptx (1) Рисунок дает форму существам, а цвет дает им жизнь
Рисунок дает форму существам, а цвет дает им жизнь Возможности первичной профсоюзной организации студентов в вопросах назначения академической и государственной стипендий
Возможности первичной профсоюзной организации студентов в вопросах назначения академической и государственной стипендий Historisches Foto
Historisches Foto Музей почетных граждан Санкт-Петербурга и истории микрорайона Коломяги
Музей почетных граждан Санкт-Петербурга и истории микрорайона Коломяги Управление персоналом
Управление персоналом Жостово. Роспись по металлу
Жостово. Роспись по металлу Международный маркетинг
Международный маркетинг Рекомендация родителям: как правильно воспринимать отметки
Рекомендация родителям: как правильно воспринимать отметки Инвентаризация НЗП и расходов будущих периодов. Тема 3.4
Инвентаризация НЗП и расходов будущих периодов. Тема 3.4 СОВЕТ СТАРШЕКЛАССНИКОВ«ЛИДЕР»
СОВЕТ СТАРШЕКЛАССНИКОВ«ЛИДЕР» Явления природы (1 класс)
Явления природы (1 класс) Зимние забавы (сочинение)
Зимние забавы (сочинение) Построение чертежа клиньевой юбки
Построение чертежа клиньевой юбки