Содержание
- 2. Классификация неорганических веществ; Классификация оксидов; Получение оксидов; Получение пероксида водорода; Химические свойства пероксида водорода. Содержание:
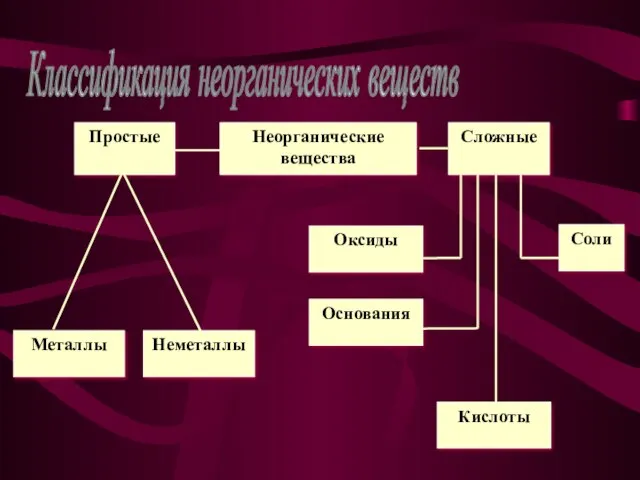
- 3. Классификация неорганических веществ
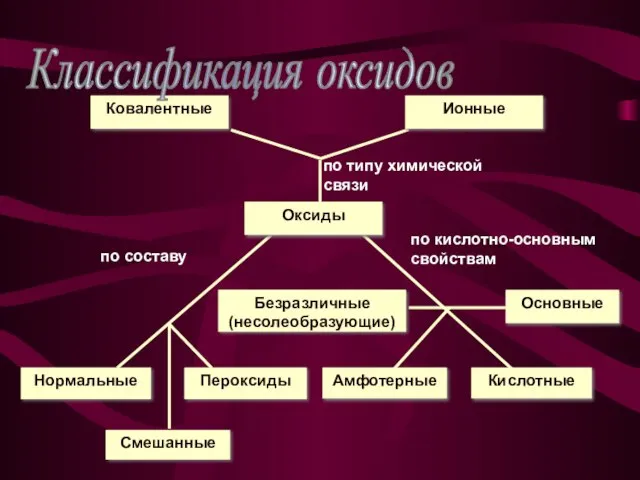
- 4. Классификация оксидов
- 5. Нормальные оксиды – оксиды, в которых есть только связи между кислородом и каким-нибудь элементом. Примеры: MgO,
- 6. Основные оксиды – оксиды, которые реагируют с водой, образуя основания; с кислотами и кислотными оксидами образуют
- 7. Оксид хрома и периклаз
- 8. Циркон
- 9. Взаимодействие простых веществ с кислородом. Примеры: S + O2—› SO2; 4Al + 3O2 —› 2Al2O3; Термическое
- 10. Получение оксидов металлов (установка)
- 11. Взаимодействие пероксида бария с разбавленной серной кислотой. Примеры: BaO2 +H2SO4 —› BaSO4 + H2O2; Взаимодействие надсерной
- 12. Получение пероксида водорода
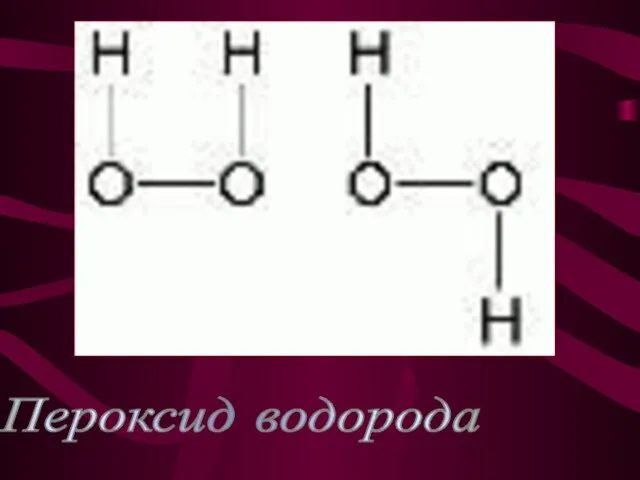
- 13. Пероксид водорода
- 14. Разложение. Пример: H2O —› H2O + 1/2O2; Окисление. Пример: PbS + 4H2O2 —› PbSO4 + 4H2O;
- 16. Скачать презентацию









 Презентация на тему Водные ресурсы. Безопасное использование и охрана
Презентация на тему Водные ресурсы. Безопасное использование и охрана Презентация на тему Физика твердого тела. Рост и дефекты кристаллов
Презентация на тему Физика твердого тела. Рост и дефекты кристаллов
 Презентация на тему Технология моделирования в начальной школе
Презентация на тему Технология моделирования в начальной школе Самостоятельные занятия физическими упражнениями
Самостоятельные занятия физическими упражнениями Права ребёнка
Права ребёнка Риск и промышленная безопасность
Риск и промышленная безопасность  Фрукты, которые растут на деревьях
Фрукты, которые растут на деревьях Какие бывают дома?
Какие бывают дома? Устройство и техническое обслуживание автомобилей классификация грузовых автомобилей
Устройство и техническое обслуживание автомобилей классификация грузовых автомобилей Лес Инвест Трейдинг
Лес Инвест Трейдинг Отцовская доблесть. Семья Канчуриных
Отцовская доблесть. Семья Канчуриных Воздействие тепловых двигателей на окружающую среду
Воздействие тепловых двигателей на окружающую среду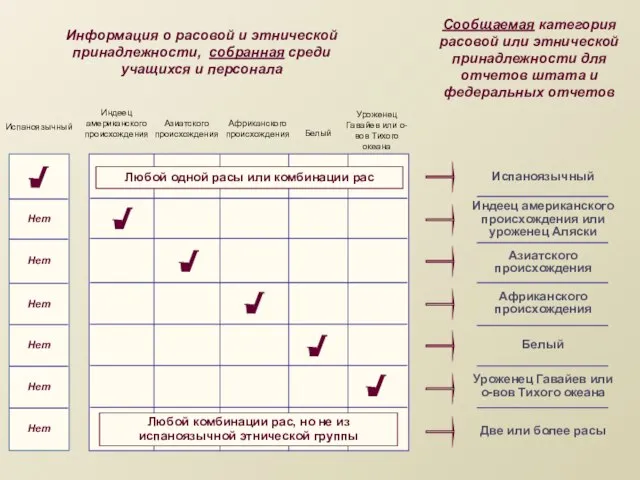 Информация о расовой и этнической принадлежности, собранная среди учащихся и персонала
Информация о расовой и этнической принадлежности, собранная среди учащихся и персонала Бизнес-модель Остервальдера как основной инструмент бизнес-моделирования
Бизнес-модель Остервальдера как основной инструмент бизнес-моделирования Экономия с лампочкой Ilumia Classical
Экономия с лампочкой Ilumia Classical Города РоссииНовосибирск
Города РоссииНовосибирск Решение уравнений высоких степеней
Решение уравнений высоких степеней Слова с сочетаниями ЖИ-ШИ
Слова с сочетаниями ЖИ-ШИ Социальная карта Башкортостана
Социальная карта Башкортостана Викторина
Викторина «Цветок. Строение и функции цветка и его частей»
«Цветок. Строение и функции цветка и его частей» Понятие об общении
Понятие об общении Заочная экскурсия по мемориальному комплексу «ХАТЫНЬ»
Заочная экскурсия по мемориальному комплексу «ХАТЫНЬ» Инструменты автоматизации форматирования. Перекрестные ссылки. Сортировка
Инструменты автоматизации форматирования. Перекрестные ссылки. Сортировка Бюджетная система
Бюджетная система ООО «ЯнаулВодоканал»РБ г. Янаул, ул. Обьездная,17тел. (34760)
ООО «ЯнаулВодоканал»РБ г. Янаул, ул. Обьездная,17тел. (34760) HP StorageWorksX9000 Network Storage Systems
HP StorageWorksX9000 Network Storage Systems Окружность и круг (9 класс)
Окружность и круг (9 класс)