Содержание
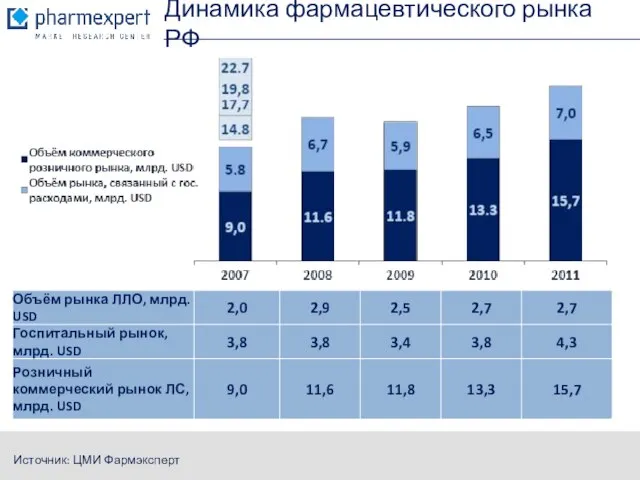
- 2. Динамика фармацевтического рынка РФ Источник: ЦМИ Фармэксперт
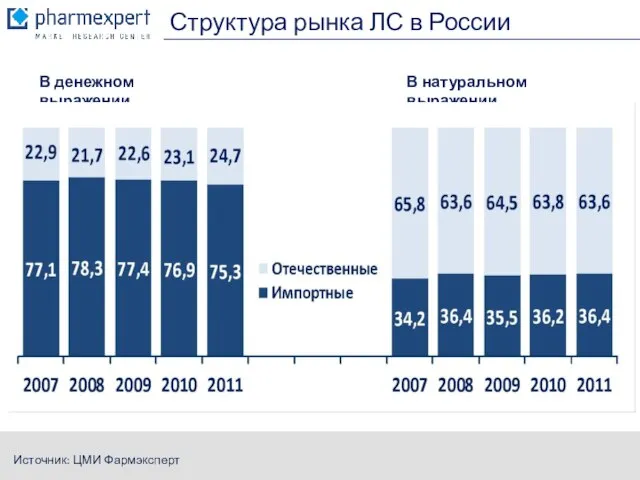
- 3. Структура рынка ЛС в России Источник: ЦМИ Фармэксперт В денежном выражении В натуральном выражении
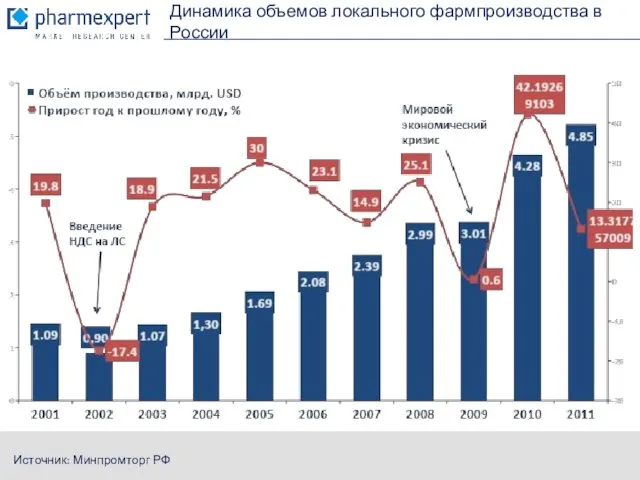
- 4. Динамика объемов локального фармпроизводства в России Источник: Минпромторг РФ
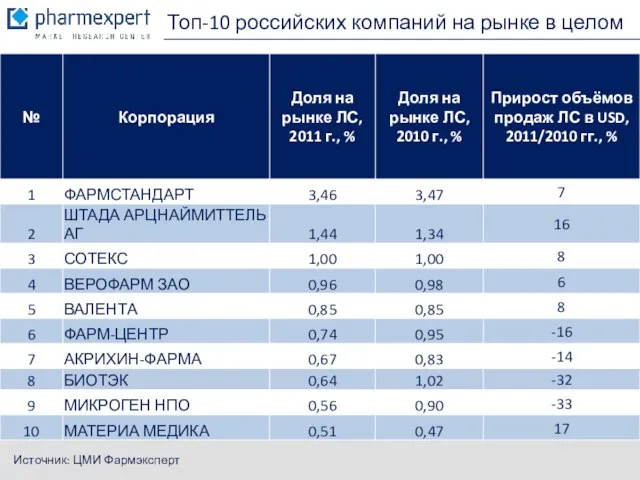
- 5. Топ-10 российских компаний на рынке в целом Источник: ЦМИ Фармэксперт
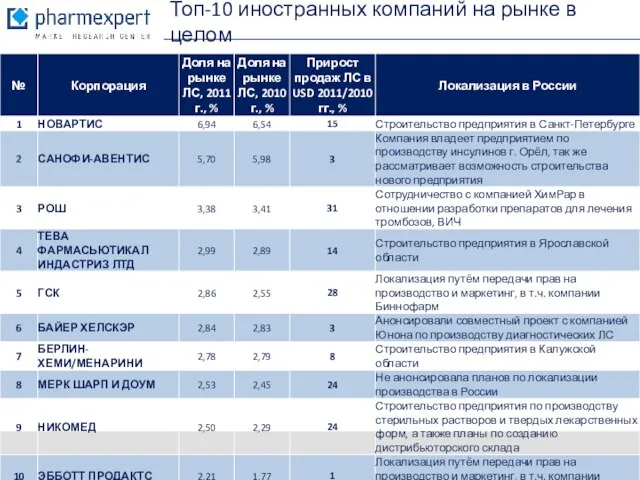
- 6. Топ-10 иностранных компаний на рынке в целом Источник: ЦМИ Фармэксперт
- 7. ФЦП «Фарма 2020» Источник: ЦМИ Фармэксперт Цели ФЦП «Фарма 2020» Общий объём финансирования в размере 188
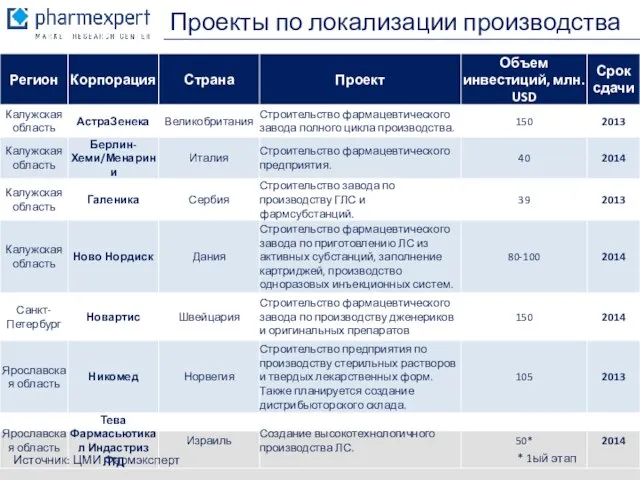
- 8. Проекты по локализации производства Источник: ЦМИ Фармэксперт * 1ый этап
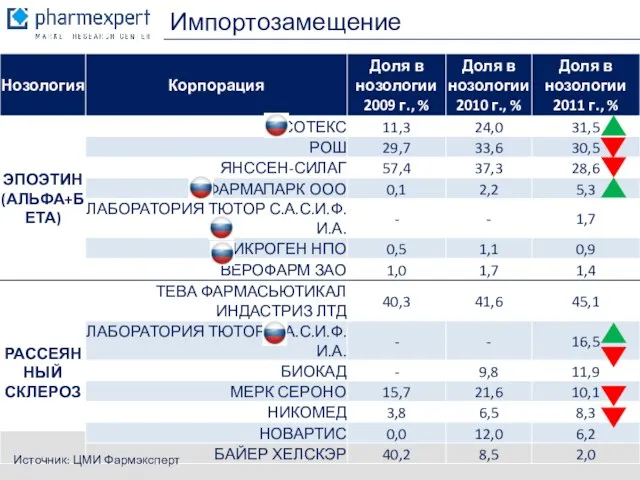
- 9. Импортозамещение Источник: ЦМИ Фармэксперт
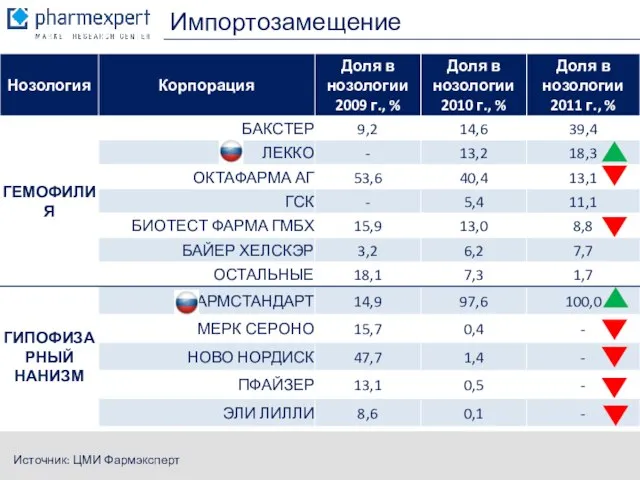
- 10. Импортозамещение Источник: ЦМИ Фармэксперт
- 11. GMP: История вопроса в России В соответствии с 71 статьей Закона «Об основах охраны здоровья» к
- 12. Необходимость перехода на GMP Внутренний рынок РФ Реализация целей стратегии «Фарма 2020». Обеспечение населения РФ лекарственными
- 13. Развитие экспортных отношений Примеры успешного выхода отечественных ЛС на международные рынки Энтеросгель (ТНК Силма) - зарегистрирован
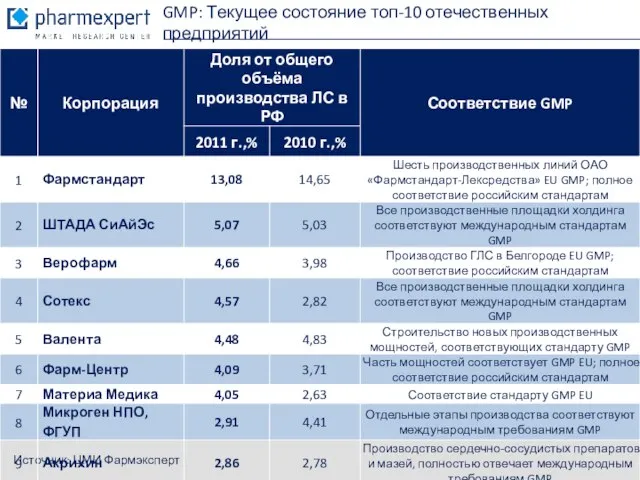
- 14. Источник: ЦМИ Фармэксперт GMP: Текущее состояние топ-10 отечественных предприятий
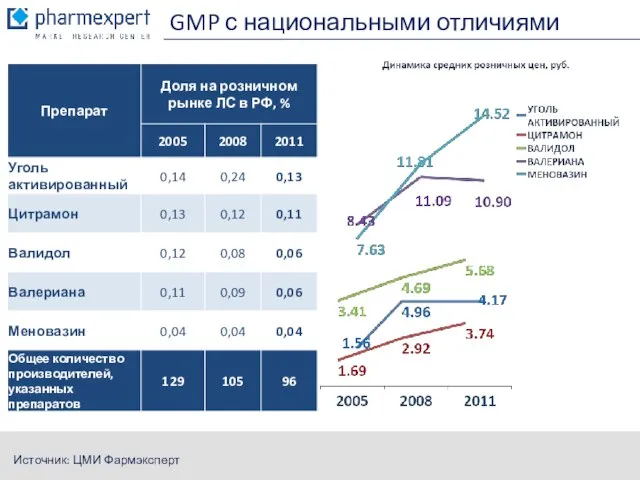
- 15. GMP с национальными отличиями Источник: ЦМИ Фармэксперт
- 16. Внимание к стандартам GxP Для обеспечения качества лекарственных средств на всех этапах жизненного цикла внедрение стандарта
- 18. Скачать презентацию





 Фестиваль успехаВыступление 23. 04. 2012
Фестиваль успехаВыступление 23. 04. 2012 Состояние и показатели тренированности спортсмена
Состояние и показатели тренированности спортсмена Состав предметов
Состав предметов Сделаем нашу планету чистой!
Сделаем нашу планету чистой! Стресс – разрушитель нашего организма
Стресс – разрушитель нашего организма Психологическая подготовка боксеров-юношей
Психологическая подготовка боксеров-юношей День Хлеба! 4 класс
День Хлеба! 4 класс Исследовательское обучение учащихся во внеурочной деятельности по ФГОС - презентация для начальной школы_
Исследовательское обучение учащихся во внеурочной деятельности по ФГОС - презентация для начальной школы_ Город-герой Киев
Город-герой Киев ОРГАНИЗАЦИЯ СЛУЖБЫ ЭКСТРАКОРПОРАЛЬНОЙ КОРРЕКЦИИ ГОМЕОСТАЗА ВВ МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ
ОРГАНИЗАЦИЯ СЛУЖБЫ ЭКСТРАКОРПОРАЛЬНОЙ КОРРЕКЦИИ ГОМЕОСТАЗА ВВ МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ The Police in Britain
The Police in Britain Викторина по финансовой грамотности
Викторина по финансовой грамотности Публичный отчёт о работе ГОУ СОШ «Школа здоровья» № 568 за 2009 -2010 учебный год
Публичный отчёт о работе ГОУ СОШ «Школа здоровья» № 568 за 2009 -2010 учебный год Презентация на тему ПРОИСХОЖДЕНИЕ СОЛНЕЧНОЙ СИСТЕМЫ ПЕРВЫЕ РАЗМЫШЛЕНИЯ И НАУЧНОЕ ОБЪЯСНЕНИЕ
Презентация на тему ПРОИСХОЖДЕНИЕ СОЛНЕЧНОЙ СИСТЕМЫ ПЕРВЫЕ РАЗМЫШЛЕНИЯ И НАУЧНОЕ ОБЪЯСНЕНИЕ  Методические проблемы проектирования образовательной среды ВУЗа
Методические проблемы проектирования образовательной среды ВУЗа Подзаконные акты, действующие в сфере туризма
Подзаконные акты, действующие в сфере туризма Информационное обеспечение арбитражных судов и участников судебного процесса
Информационное обеспечение арбитражных судов и участников судебного процесса Народный промысел – Гжель
Народный промысел – Гжель Международный опыт реформы организации управления общественными финансами
Международный опыт реформы организации управления общественными финансами ШКОЛЬНОЕ МЕТОДИЧЕСКОЕ ОБЪЕДИНЕНИЕ УЧИТЕЛЕЙ ТЕХНОЛОГИИ И ЧЕРЧЕНИЯ
ШКОЛЬНОЕ МЕТОДИЧЕСКОЕ ОБЪЕДИНЕНИЕ УЧИТЕЛЕЙ ТЕХНОЛОГИИ И ЧЕРЧЕНИЯ Внутриорганизационные конфликты
Внутриорганизационные конфликты Период развития италийских племён
Период развития италийских племён  Система работы с текстом на уроках русского языка как средство формирования коммуникативной компетентности
Система работы с текстом на уроках русского языка как средство формирования коммуникативной компетентности День Святого Миколая
День Святого Миколая Проект “На одной волне”
Проект “На одной волне” Урок по истории Древнего мира в 5 классе.
Урок по истории Древнего мира в 5 классе. Литургия Преждеосвящённых Даров
Литургия Преждеосвящённых Даров Паломничества и святыни (4 класс)
Паломничества и святыни (4 класс)