Содержание
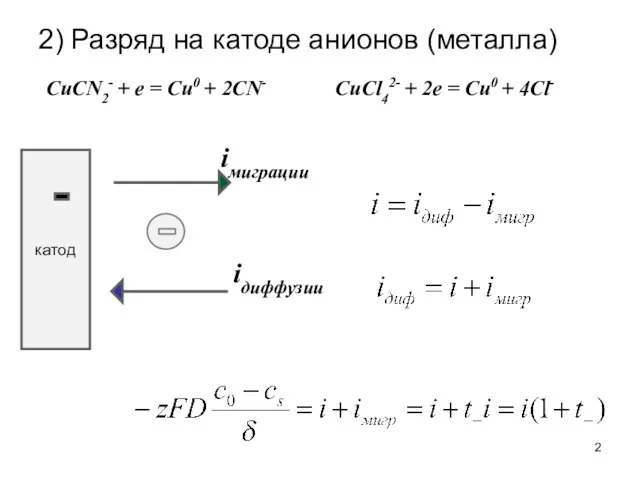
- 2. 2) Разряд на катоде анионов (металла) катод iдиффузии iмиграции CuСl42- + 2e = Cu0 + 4Cl-
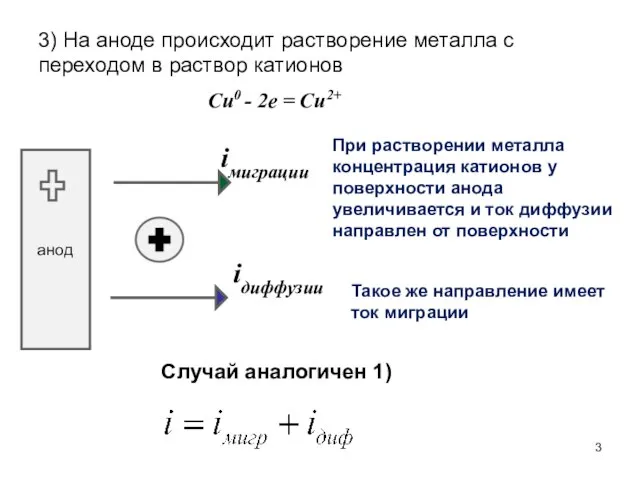
- 3. 3) На аноде происходит растворение металла с переходом в раствор катионов Cu0 - 2e = Cu2+
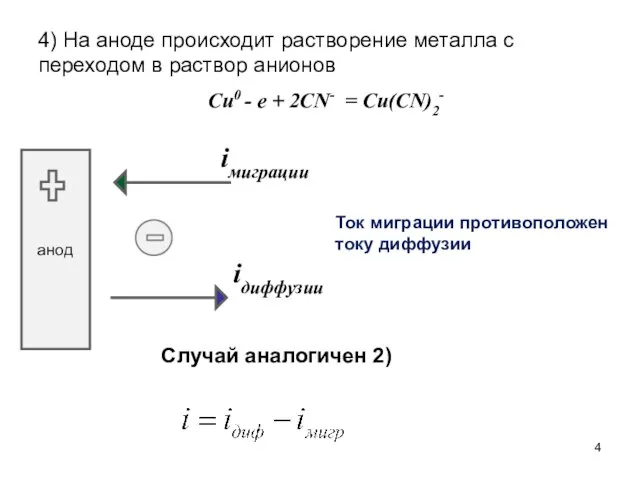
- 4. 4) На аноде происходит растворение металла с переходом в раствор анионов Cu0 - e + 2CN-
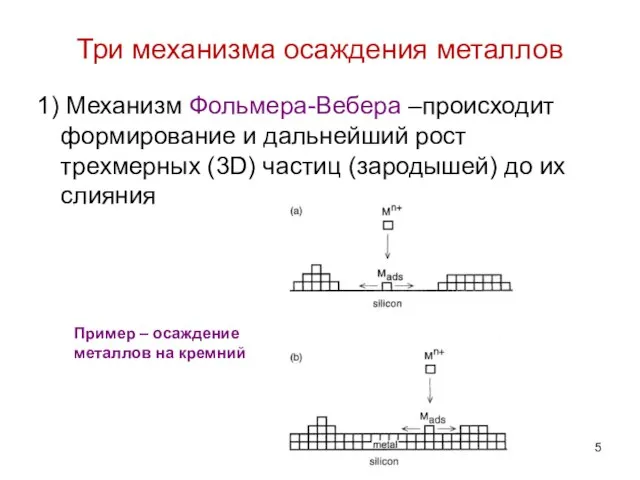
- 5. Три механизма осаждения металлов 1) Механизм Фольмера-Вебера –происходит формирование и дальнейший рост трехмерных (3D) частиц (зародышей)
- 6. Пример механизма Фольмера-Вебера – катодное осаждение меди на кремний
- 7. Три механизма осаждения металлов 2) Механизм Франка-Ван-дер-Мерве – происходит формирование и рост двумерных (2D) зародышей, которые
- 8. Три механизма осаждения металлов 3) Механизм Странского-Крастанова – вначале на инородной подложке происходит двумерная (2D) нуклеация
- 9. Кинетика зародышеобразования металлов при их катодном осаждении Два типа (вида) зародышеобразования: Мгновенное зародышеобразование (instantaneous nucleation) –
- 10. Прогрессирующее зародышеобразование Мгновенное зародышеобразование Осаждение платины на кремний
- 11. Электрокристаллизация PbSe на золоте – пример прогрессирующего зародышеобразования Streltsov E.A., Osipovich N.P., Ivashkevich L.S., Lyakhov A.S.
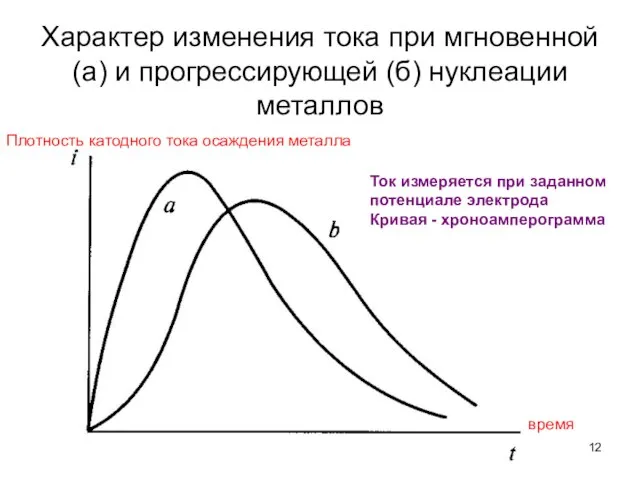
- 12. Характер изменения тока при мгновенной (а) и прогрессирующей (б) нуклеации металлов время Плотность катодного тока осаждения
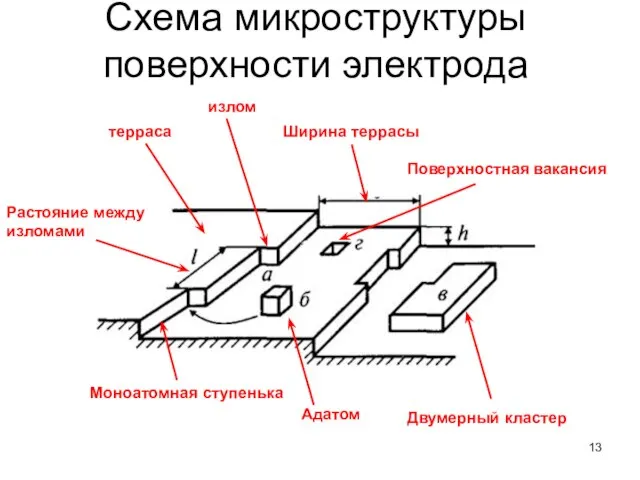
- 13. Схема микроструктуры поверхности электрода терраса Моноатомная ступенька Адатом Двумерный кластер Ширина террасы Поверхностная вакансия излом Растояние
- 15. Электрохимическая коррозия. Короткозамкнутые электрохимические системы. Обычные электрохимические системы, например типа — Zn|ZnSO4||СuSO4|Cu могут находиться либо в
- 16. Короткозамкнутые электрохимические системы Железная пластинка в растворе серной кислоты Цинковая пластинка в растворе сульфата меди
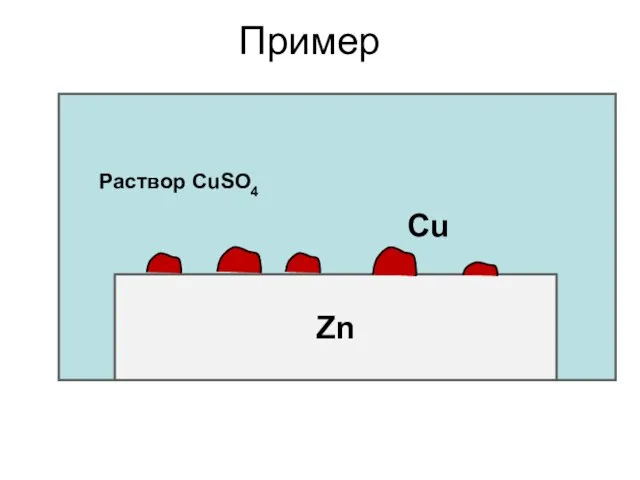
- 17. Пример Zn Раствор CuSO4 Cu
- 18. Короткозамкнутые электрохимические системы в которых анодным процессом является окисление металла и новая металлическая фаза не образуется,
- 19. Электрохимическая коррозия В коррозионной электрохимической системе идет процесс самопроизвольного разрушения металла (коррозия) при воздействии на него
- 20. Участки с более положительными потенциалами выступают в роли микроанодов, а участки с более отрицательными потенциалами выступают
- 21. Для начала коррозии необходимо, чтобы короткозамкнутая система не находилась в термодинамическом равновесии. Даже при наличии строго
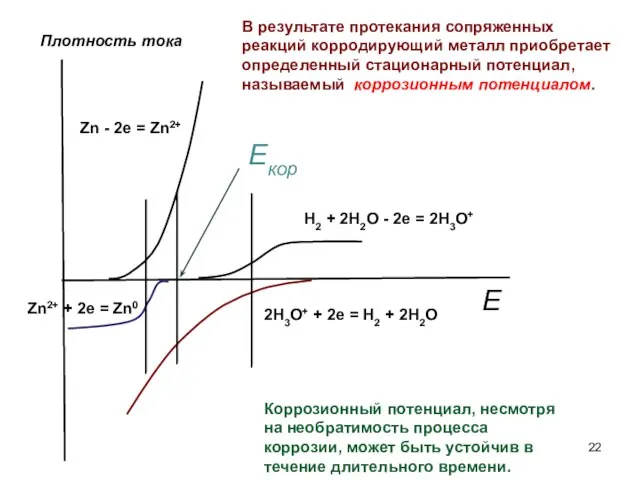
- 22. Zn - 2e = Zn2+ Zn2+ + 2e = Zn0 Плотность тока В результате протекания сопряженных
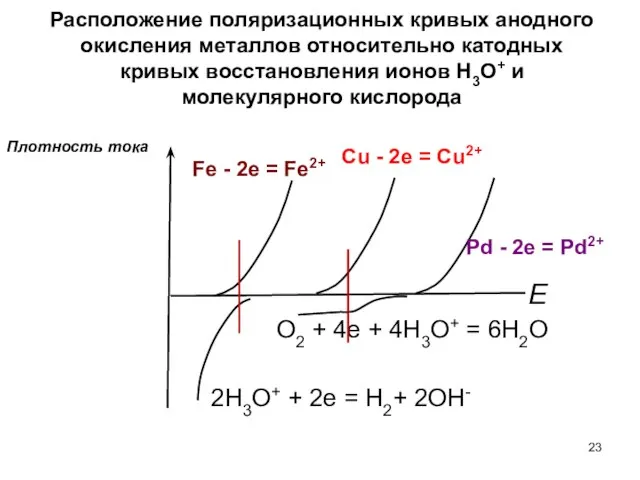
- 23. Расположение поляризационных кривых анодного окисления металлов относительно катодных кривых восстановления ионов H3O+ и молекулярного кислорода 2H3O+
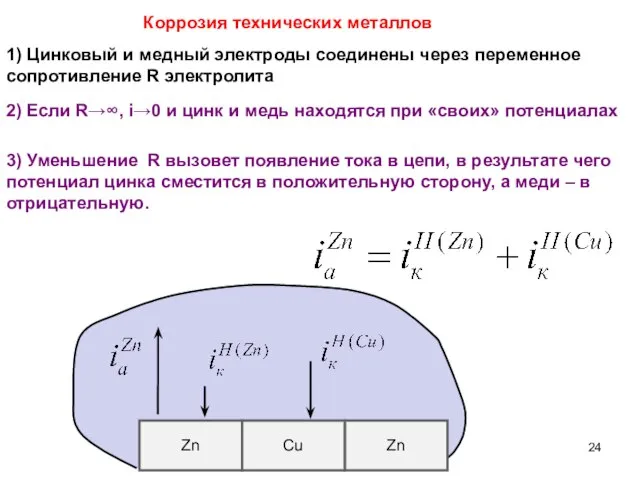
- 24. Коррозия технических металлов Zn Zn Cu 1) Цинковый и медный электроды соединены через переменное сопротивление R
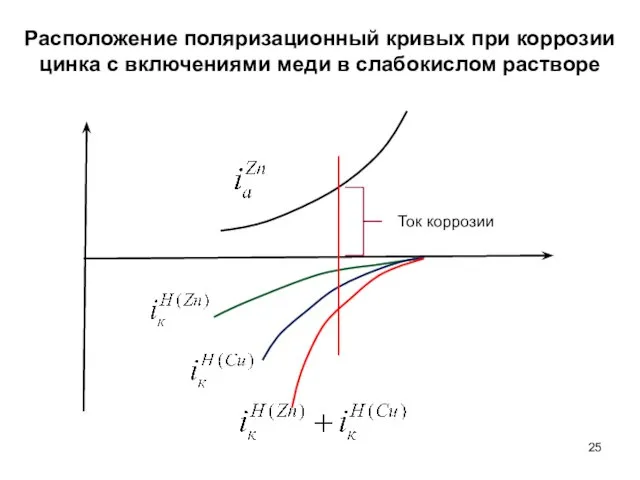
- 25. Расположение поляризационный кривых при коррозии цинка с включениями меди в слабокислом растворе Ток коррозии
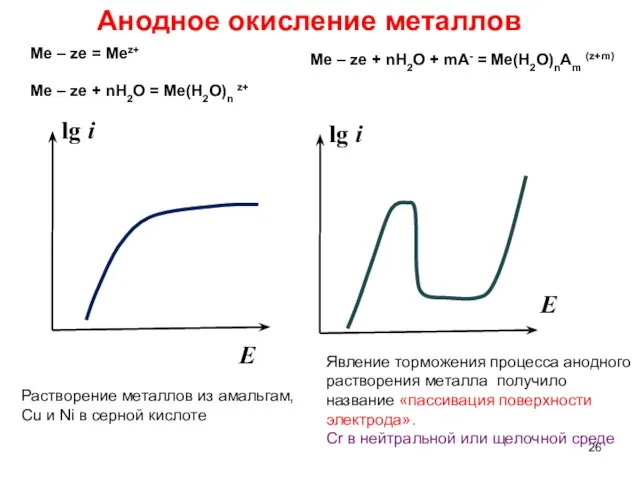
- 26. Анодное окисление металлов lg i E lg i E Растворение металлов из амальгам, Cu и Ni
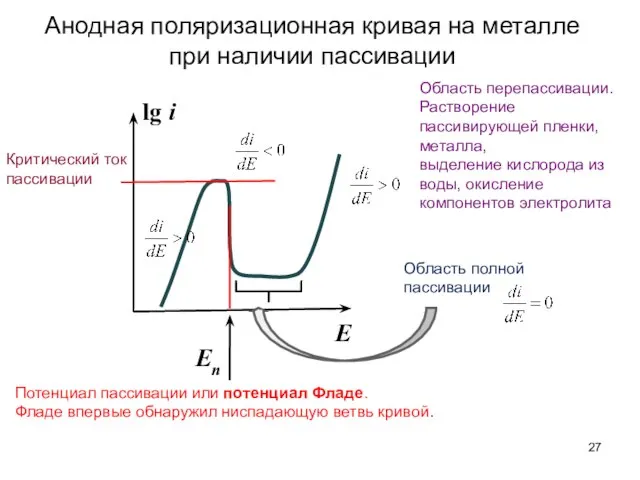
- 27. Анодная поляризационная кривая на металле при наличии пассивации lg i E Потенциал пассивации или потенциал Фладе.
- 28. Причины пассивации Теоретически пассивация объясняется с точки зрения либо фазовых, либо асорбционных монослойных пленок. Природа пленок:
- 29. Анодные пленки на металлах Анодные пленки оксида алюминия
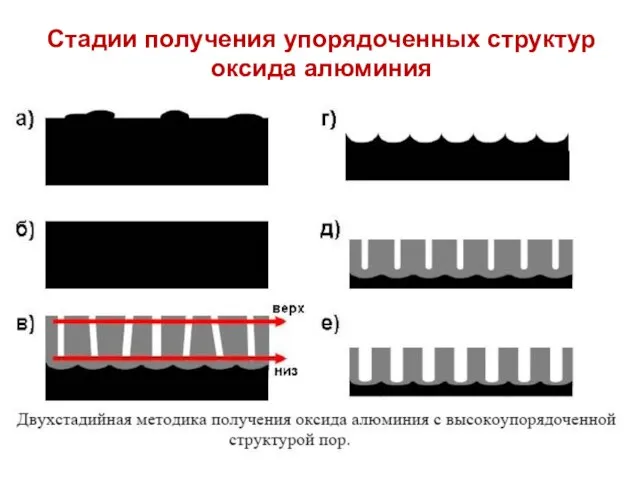
- 30. Стадии получения упорядоченных структур оксида алюминия
- 31. Анодные TiO2 пленки на титане TiO2 nanotube-arrays
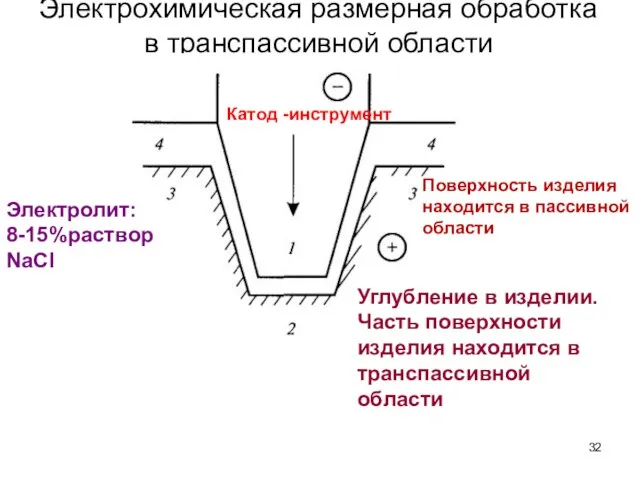
- 32. Электрохимическая размерная обработка в транспассивной области Катод -инструмент Углубление в изделии. Часть поверхности изделия находится в
- 33. Питинговое растворение металла (pit – точка) Растворение происходит на отдельных участках поверхности (Fe, Co, Ni, Al,…).
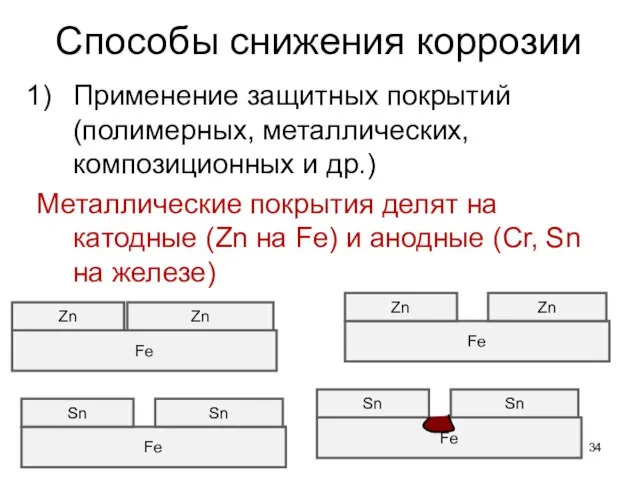
- 34. Способы снижения коррозии Применение защитных покрытий (полимерных, металлических, композиционных и др.) Металлические покрытия делят на катодные
- 35. 2) Катодная защита – осуществляется путем катодной поляризации защищаемого металла от внешнего источника
- 36. Способы снижения коррозии Протекторная защита (вариант катодной защиты) – защищаемый металл соединяют с массивным образцом металла
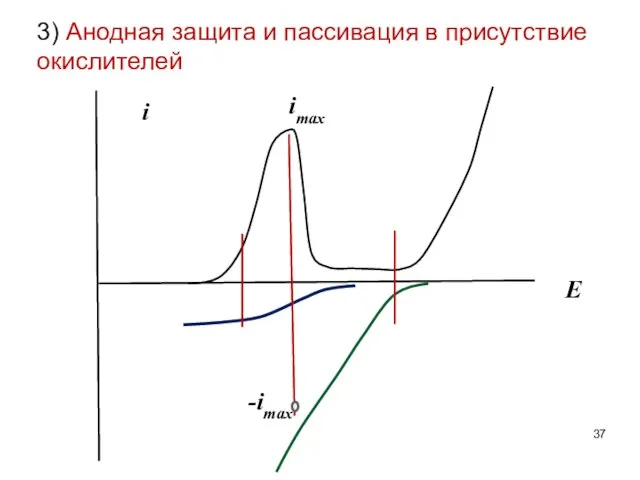
- 37. 3) Анодная защита и пассивация в присутствие окислителей i E imax -imax
- 38. 4) Предотвращение коррозии с помощью ингибиторов коррозии Суммарное производство всех ингибиторов, около 5 млн.т в год.
- 40. Скачать презентацию




















 Презентация к конспектуОткрытого комплексного занятияво второй младшей группеМДОУ детского сада №12 «Золотой Петушок»города
Презентация к конспектуОткрытого комплексного занятияво второй младшей группеМДОУ детского сада №12 «Золотой Петушок»города  Терраформирование
Терраформирование Своеобразие баллады ХХ века
Своеобразие баллады ХХ века Звіт про виховну роботу на кафедрі іноземних мов
Звіт про виховну роботу на кафедрі іноземних мов ИНФОРМАЦИОННОЕ ПРОСТРАНСТВО образовательного учреждения
ИНФОРМАЦИОННОЕ ПРОСТРАНСТВО образовательного учреждения Как формировать и развивать универсальные учебные действия у учащихся?
Как формировать и развивать универсальные учебные действия у учащихся? Устройства ввода графической информации
Устройства ввода графической информации 20140930_geo
20140930_geo «Веселый счет» С.Я. Маршак
«Веселый счет» С.Я. Маршак Метод проектов в начальной
Метод проектов в начальной Коммерческое предложение для toyota-shygys.kz
Коммерческое предложение для toyota-shygys.kz Интегрированный On-line конкурс рисунков и творческих работ, к Международному Дню 8-е Марта
Интегрированный On-line конкурс рисунков и творческих работ, к Международному Дню 8-е Марта Краны пролётного типа
Краны пролётного типа Древнерусское государство и общество
Древнерусское государство и общество Святитель Иов – первый Патриарх России
Святитель Иов – первый Патриарх России Экскурсия, выставка, Вернисаж
Экскурсия, выставка, Вернисаж Электронные тахеометры Leica TPS 1200+
Электронные тахеометры Leica TPS 1200+ ИНФОРМАТИКА
ИНФОРМАТИКА Презентация на тему Первобытное общество (10 класс)
Презентация на тему Первобытное общество (10 класс) Муниципального бюджетного общеобразовательного учреждения Политотдельской средней общеобразовательной школы Матвеево-Курганс
Муниципального бюджетного общеобразовательного учреждения Политотдельской средней общеобразовательной школы Матвеево-Курганс Презентация на тему Случайные события
Презентация на тему Случайные события  ИНФОРМАЦИЯ. ИНФОРМАТИКА.ИНФОРМАТИЗАЦИЯ.
ИНФОРМАЦИЯ. ИНФОРМАТИКА.ИНФОРМАТИЗАЦИЯ. ТАКАЯ ЖИЗНЬ ОПРЕДЕЛЯЕТСЯ БУДУЩИМ,
ТАКАЯ ЖИЗНЬ ОПРЕДЕЛЯЕТСЯ БУДУЩИМ, Роль технологии в современном мире
Роль технологии в современном мире Презентация к уроку по обществознанию _Правонаруше
Презентация к уроку по обществознанию _Правонаруше Псориаз
Псориаз МОУ «Богоявленская СОШ» Презентация к уроку русского языка в 6 классе Тема: « Правописание Н и НН в прилагательн
МОУ «Богоявленская СОШ» Презентация к уроку русского языка в 6 классе Тема: « Правописание Н и НН в прилагательн Горный поход. Приэльбрусье
Горный поход. Приэльбрусье