Слайд 2Цели и задачи урока:
Выяснить источник кислорода в природе; познакомиться с лабораторными и

промышленными способами получения кислорода
Познакомиться с понятием о катализаторе
Познакомиться с важнейшими химическими свойствами кислорода
Научиться давать названия оксидам
Слайд 3*
Способы получения кислорода
1) В природе кислород образуется в процессе фотосинтеза
2) В

промышленности его получают перегонкой сжиженного воздуха при t = - 1830 С
Слайд 4 3) В лаборатории кислород получают реакциями разложения:
а) воды под действием электрического

тока (электролиз):
2H2O → 2H2 + O2
б) пероксида водорода под действием MnO2:
MnO2
2Н2О2 → 2Н2О + О2
Слайд 5Разложение перекиси водорода в присутствии оксида марганца (IV)

Слайд 6! Катализатор – вещество, которое изменяет скорость реакции, но само при этом

не расходуется
Слайд 7*
в) перманганата калия при нагревании:
2KMnO4 → K2MnO4 + MnO2 + O2

Разложение этой соли идёт при нагревании её
выше 2000 С
Слайд 8Как проверить, собрался ли кислород в сосуде?
Подумайте …

Слайд 9*
Проверка собравшегося кислорода

Слайд 10*
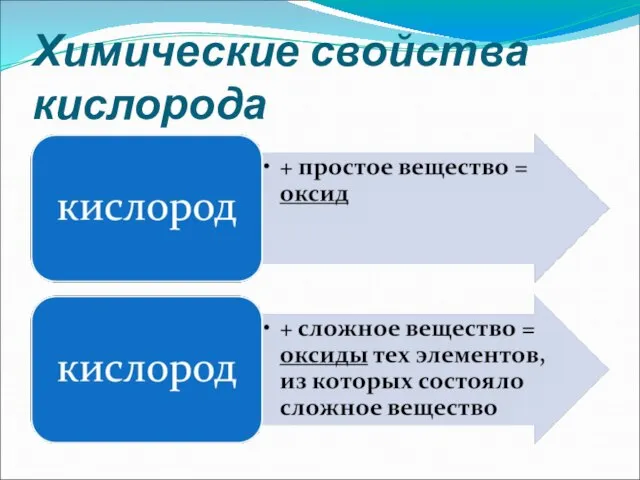
Химические свойства кислорода
Допишите уравнения реакций:
Ca + O2 →
Na + O2 →
Al

+ O2 →
S + O2 →
H2S + O2 →
CH4 + O2→
Слайд 12Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых

является кислород
Слайд 13Названия оксидов
Слово «оксид»
+ название элемента в родительном падеже
+ валентность элемента

в данном оксиде (если она переменная)
Слайд 14Реакции с участием кислорода
Реакции взаимодействия веществ с кислородом относятся к реакциям окисления
Реакции

взаимодействия веществ с кислородом, протекающие с выделением большого количества тепла и света, называются реакциями горения












 Презентация на тему Екатерина Великая
Презентация на тему Екатерина Великая  «Стимулирование экономической активности на 2012-2016 гг.»
«Стимулирование экономической активности на 2012-2016 гг.» Учет возрастных психологических особенностей детей и подростков
Учет возрастных психологических особенностей детей и подростков Презентация на тему Перевод чисел в десятичную систему счисления 11 класс
Презентация на тему Перевод чисел в десятичную систему счисления 11 класс  Требования к оформлению презентации
Требования к оформлению презентации Презентация на тему Лес - природное сообщество 3 класс
Презентация на тему Лес - природное сообщество 3 класс Биомедикал системс
Биомедикал системс Презентация на тему Блокада Ленинграда. Дети, война
Презентация на тему Блокада Ленинграда. Дети, война Кафедра лучевой диагностики и лучевой терапии
Кафедра лучевой диагностики и лучевой терапии Эксплуатация МТ. Основные задачи. Приемка в эксплуатацию
Эксплуатация МТ. Основные задачи. Приемка в эксплуатацию ООО ИнтерТех, Новосибирск. Проектирование, монтаж и комплексное обслуживание инженерных сетей
ООО ИнтерТех, Новосибирск. Проектирование, монтаж и комплексное обслуживание инженерных сетей Предоставление платных образовательных услуг
Предоставление платных образовательных услуг Профессия столяра
Профессия столяра Крылатые выражения
Крылатые выражения Мифологема Мировое Древо
Мифологема Мировое Древо Лизинговые продукты
Лизинговые продукты Справится ли местоимение с ролью обращения?
Справится ли местоимение с ролью обращения? Законы термодинамики
Законы термодинамики Ровеньковский горный колледж
Ровеньковский горный колледж 2ca34114d08bf472 (1)
2ca34114d08bf472 (1) Франція: пам’ятки архітектури
Франція: пам’ятки архітектури Метод проекций. Проекции точки. Лекция 1
Метод проекций. Проекции точки. Лекция 1 Удмуртское национальное блюдо шаньги
Удмуртское национальное блюдо шаньги Что такое бёрдинг?
Что такое бёрдинг? Гибриды больших кошек
Гибриды больших кошек Какой бывает транспорт? 2 класс
Какой бывает транспорт? 2 класс «Масленица…»
«Масленица…» Модулі нагріву МН-500 Укрінтерм на базі конденсаційного теплообмінника
Модулі нагріву МН-500 Укрінтерм на базі конденсаційного теплообмінника