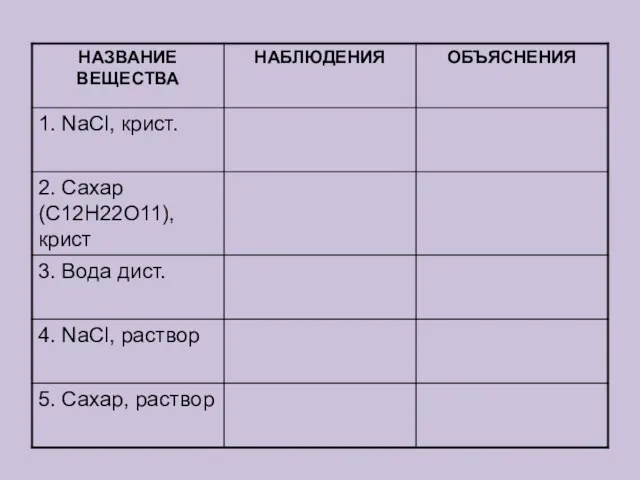
Содержание
- 2. Тест 1. Выберите вещество с ковалентной неполярной связью: А) NaCl; б) О2; в) AlCl3; г) H2O
- 4. Строение молекулы воды Связь Н-О ковалентная полярная
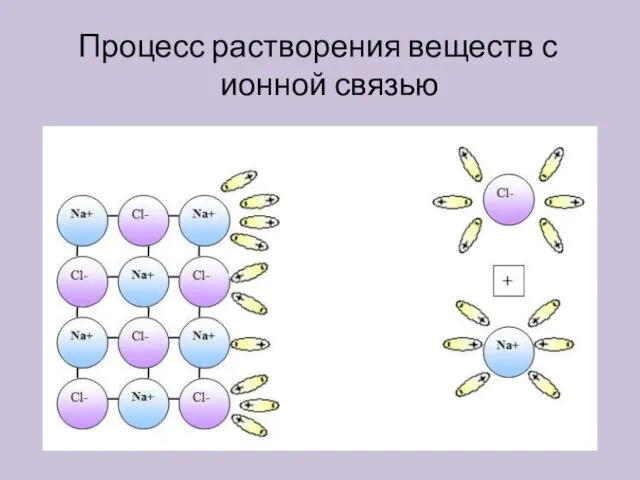
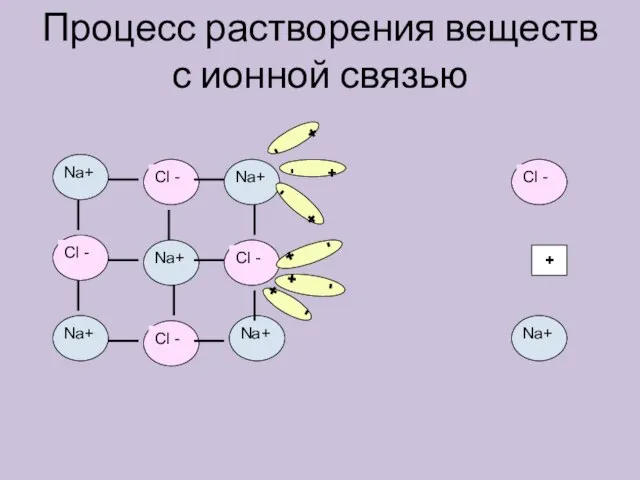
- 6. Процесс растворения веществ с ионной связью
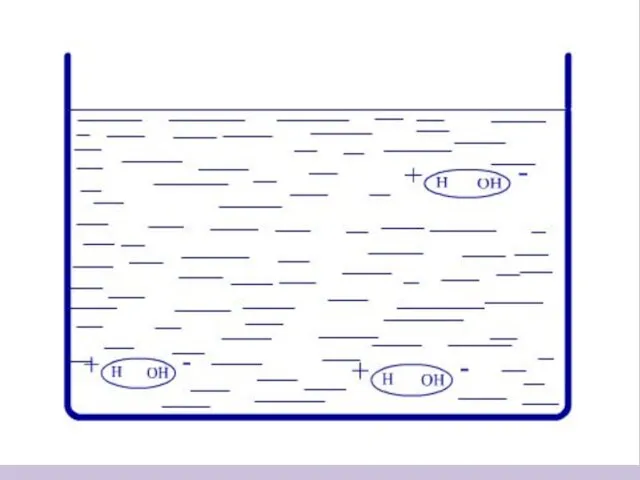
- 7. Процесс растворения веществ с ионной связью + - + - + - + - + -
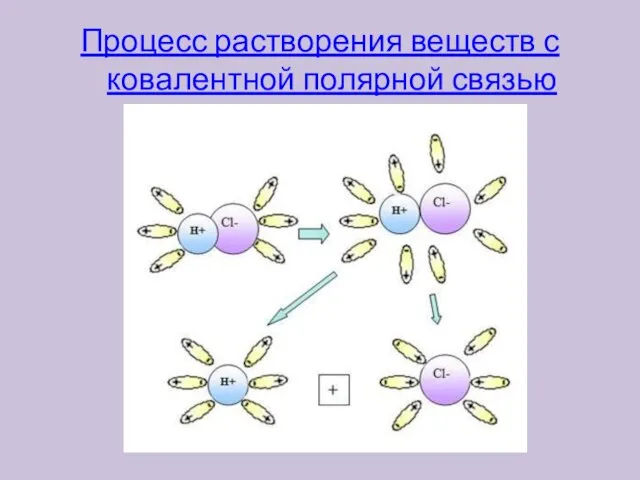
- 8. Процесс растворения веществ с ковалентной полярной связью
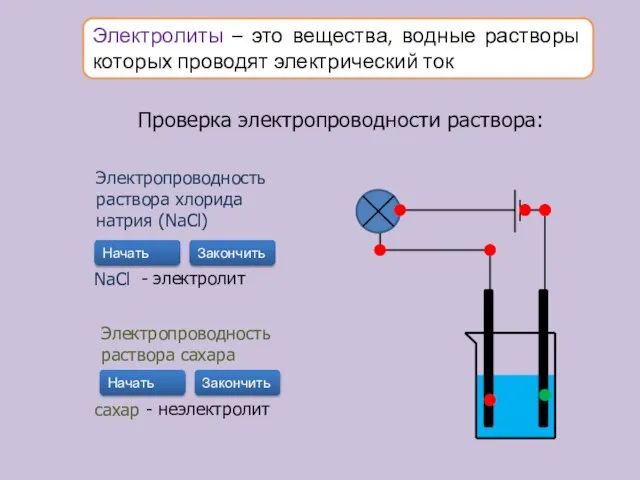
- 10. Электролиты – это вещества, водные растворы которых проводят электрический ток Проверка электропроводности раствора: Электропроводность раствора хлорида
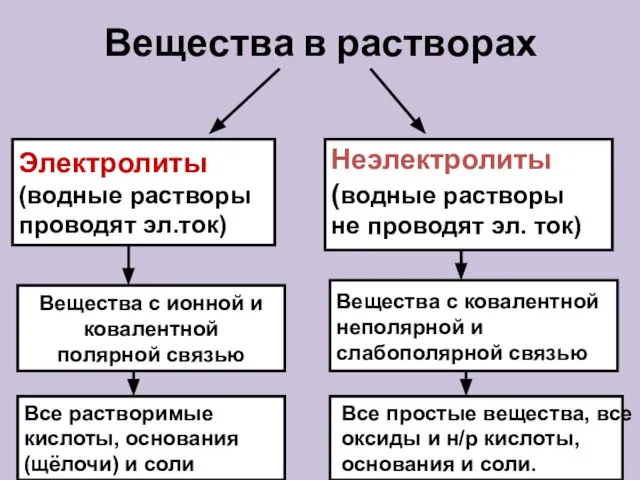
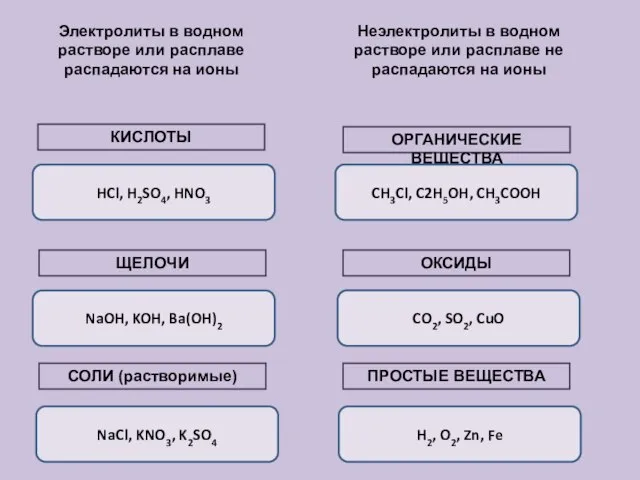
- 11. Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 12. Электролиты в водном растворе или расплаве распадаются на ионы Неэлектролиты в водном растворе или расплаве не
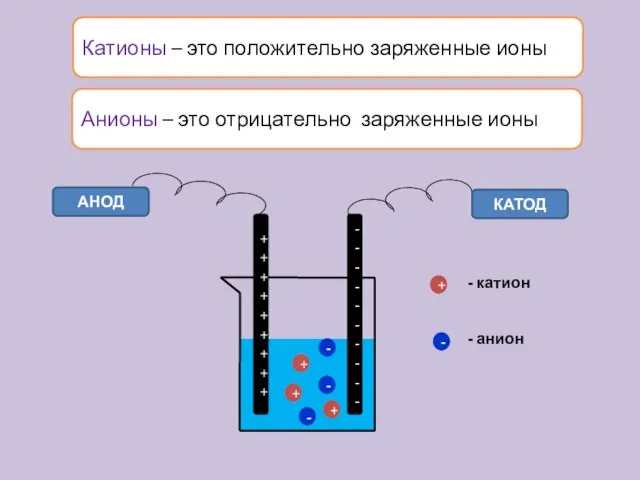
- 13. Катионы – это положительно заряженные ионы АНОД КАТОД + + + - - - + -
- 14. Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные
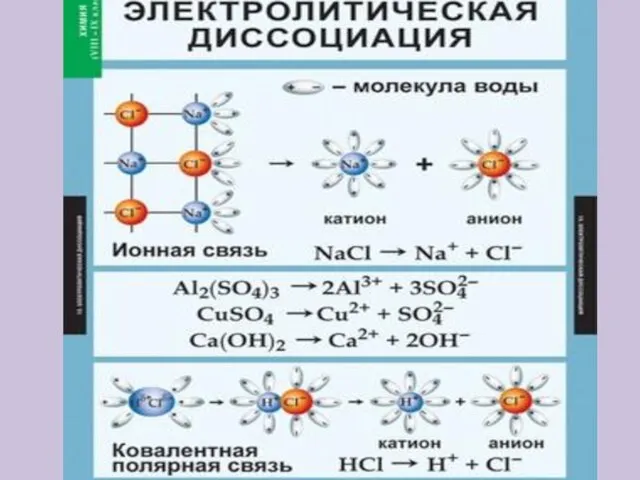
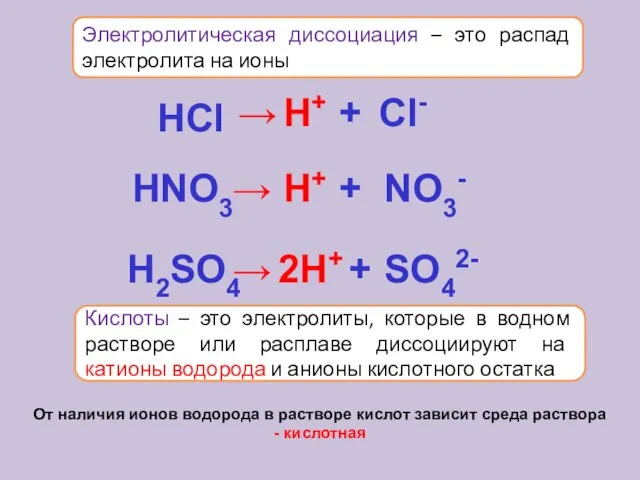
- 15. Электролитическая диссоциация – это распад электролита на ионы Кислоты – это электролиты, которые в водном растворе
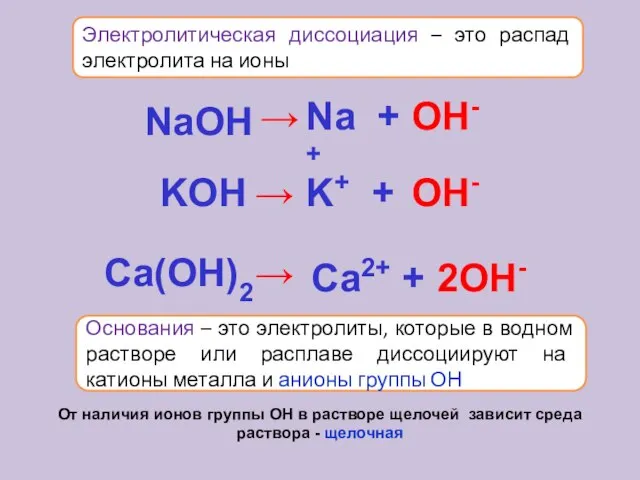
- 16. Электролитическая диссоциация – это распад электролита на ионы Основания – это электролиты, которые в водном растворе
- 17. Электролитическая диссоциация – это распад электролита на ионы Соли – это электролиты, которые в водном растворе
- 18. Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+
- 20. Скачать презентацию





 Источники энергии
Источники энергии Растения и животные луга
Растения и животные луга Теория и методология политической науки
Теория и методология политической науки Витамины, БАД
Витамины, БАД 4. Одежда. Классификация и ассортимент
4. Одежда. Классификация и ассортимент «Развитие исследовательской культуры учителя»
«Развитие исследовательской культуры учителя» Анализ современных отечественных схем уклонения от уплаты налогов
Анализ современных отечественных схем уклонения от уплаты налогов Конфликт. Его виды, примеры
Конфликт. Его виды, примеры Быт и обычаи. Жилище крестьян
Быт и обычаи. Жилище крестьян 20161223_strany_mira1
20161223_strany_mira1 Декоративно-прикладное искусство и дизайн
Декоративно-прикладное искусство и дизайн SWsoft – мировой лидерв области автоматизации хостинга
SWsoft – мировой лидерв области автоматизации хостинга Особенности южно-американской кухни
Особенности южно-американской кухни Профессия: Электромонтажник электрических сетей и электрооборудования»
Профессия: Электромонтажник электрических сетей и электрооборудования» Музыкальные способности
Музыкальные способности Движение крови и лимфы в организме. Органы кровообращения
Движение крови и лимфы в организме. Органы кровообращения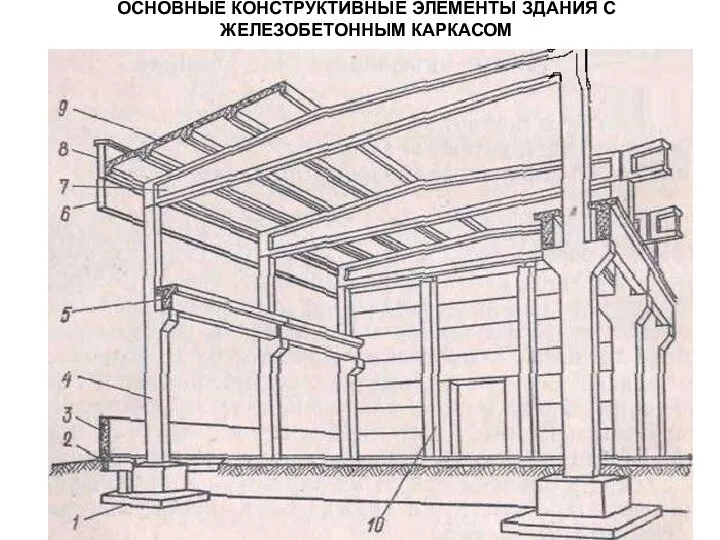 Основные конструктивные элементы здания с железобетонным каркасом
Основные конструктивные элементы здания с железобетонным каркасом Как сохранить голос ?
Как сохранить голос ? Матрица Эйзенхауэра. Пример
Матрица Эйзенхауэра. Пример 1С-Рейтинг: Больничная аптекадля 1С:Предприятие 8.2Учет лекарственных средств и аптечных товаров в организациях здравоохранения
1С-Рейтинг: Больничная аптекадля 1С:Предприятие 8.2Учет лекарственных средств и аптечных товаров в организациях здравоохранения Почему Куликовская битва не решила вопроса освобождения Руси от монголо- татарского ига.
Почему Куликовская битва не решила вопроса освобождения Руси от монголо- татарского ига. Хлеб всему голова
Хлеб всему голова Культурные особенности XIX и XX веков
Культурные особенности XIX и XX веков ПРОДЕЛАННАЯ РАБОТА 2011 год
ПРОДЕЛАННАЯ РАБОТА 2011 год Презентация на тему "Проектная деятельность на уроках в начальной школе" - скачать презентации по Педагогике
Презентация на тему "Проектная деятельность на уроках в начальной школе" - скачать презентации по Педагогике Презентация на тему Пётр Климук Первый космонавт в Беларуси
Презентация на тему Пётр Климук Первый космонавт в Беларуси  Мир кошек
Мир кошек Война глазами детей
Война глазами детей