Содержание
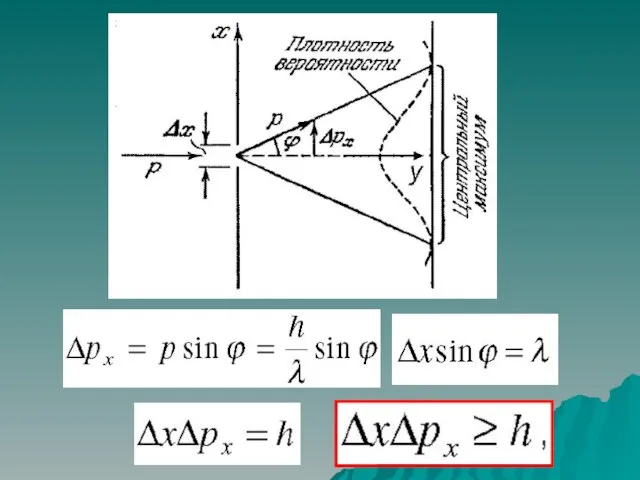
- 5. § 9.2. Уравнение Шредингера. Волновая функция. плотность вероятности: условие нормировки вероятности:
- 6. Уравнение Шредингера для стационарных состояний.
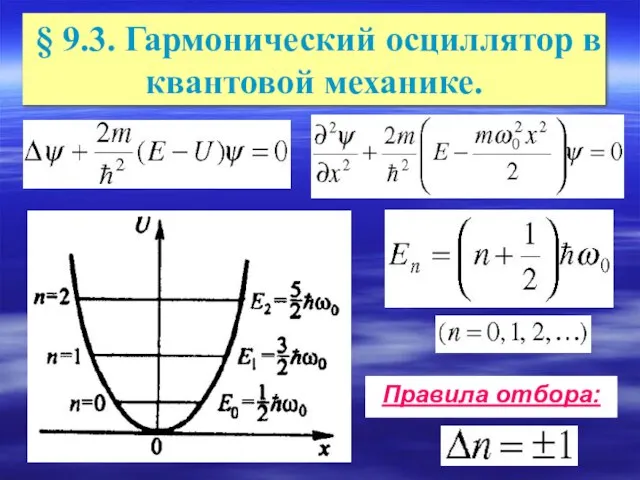
- 7. § 9.3. Гармонический осциллятор в квантовой механике. Правила отбора:
- 8. § 9.4. Атом водорода в квантовой механике. Уравнение Шредингера :
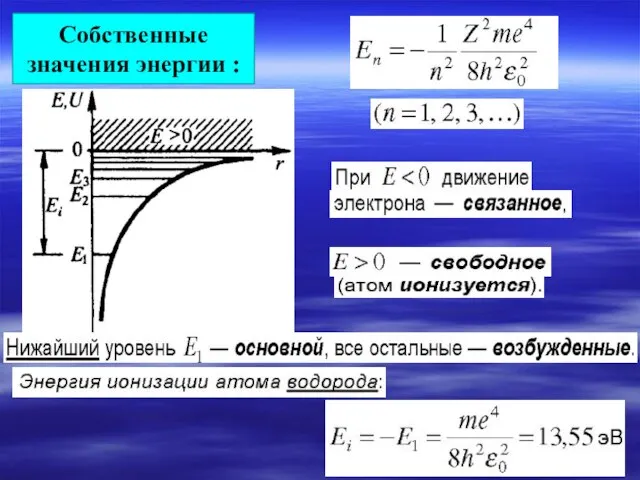
- 9. Собственные значения энергии :
- 10. § 9.5. Квантовые числа.
- 11. Эффект Зеемана – расщепление в магнитном поле уровня с главным квантовым числом n на 2l+1 подуровней.
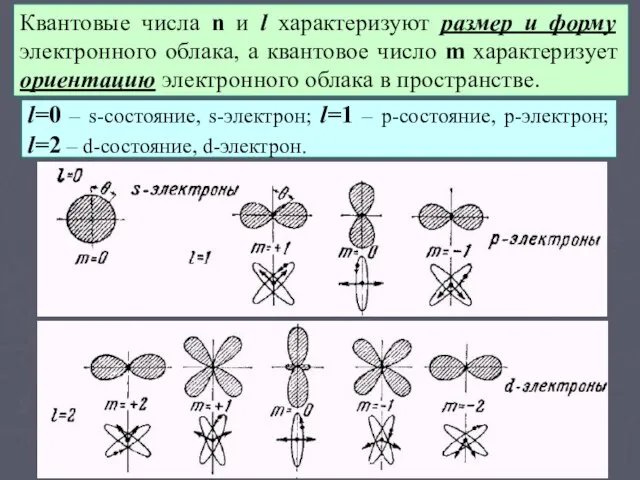
- 12. Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число m характеризует
- 13. Правила отбора: Для электрона существуют такие переходы, для которых : изменение Δl орбитального квантового числа l
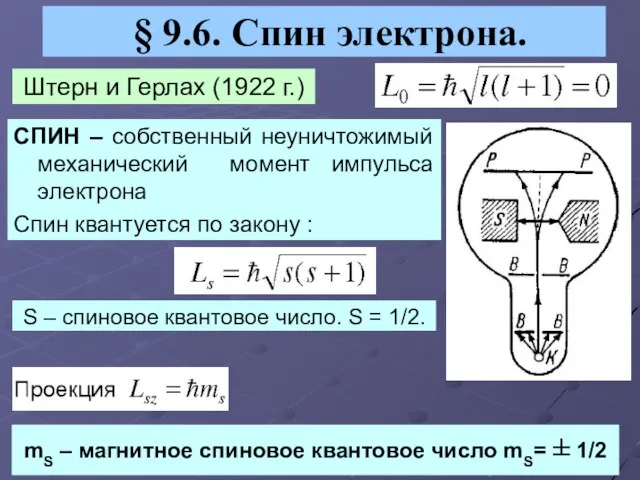
- 14. § 9.6. Спин электрона. Штерн и Герлах (1922 г.) СПИН – собственный неуничтожимый механический момент импульса
- 15. Состояние электрона в атоме определяется набором четырех квантовых чисел: главного n (n=1, 2, 3, …) орбитального
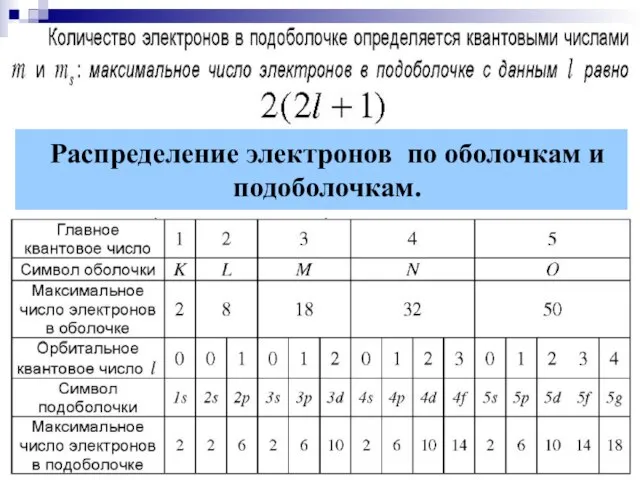
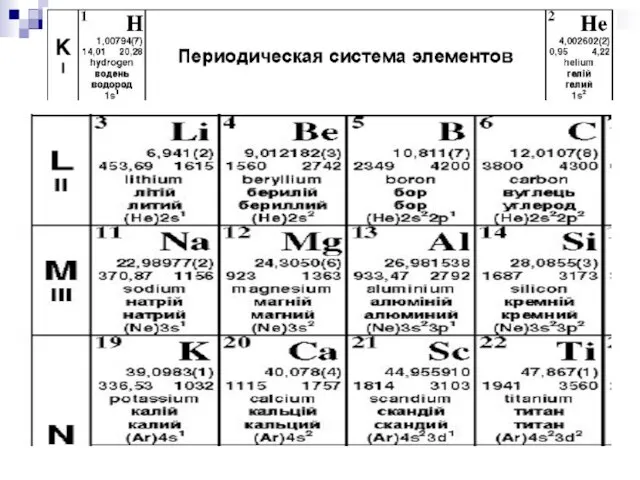
- 16. § 9.9. Распределение электронов в атоме по состояниям. ПРИНЦИП ПАУЛИ: В одном и том же атоме
- 17. Распределение электронов по оболочкам и подоболочкам.
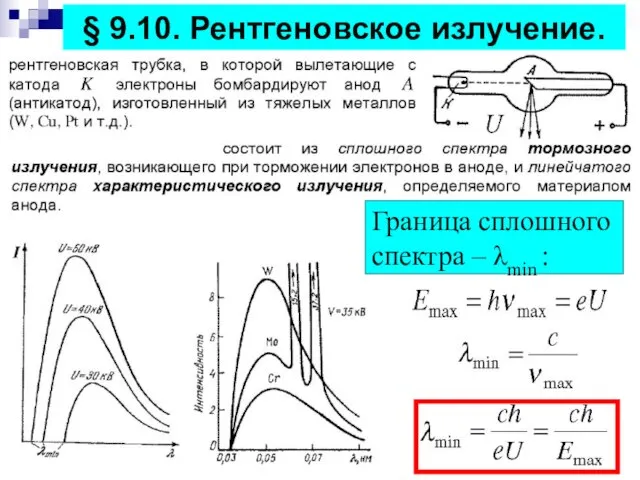
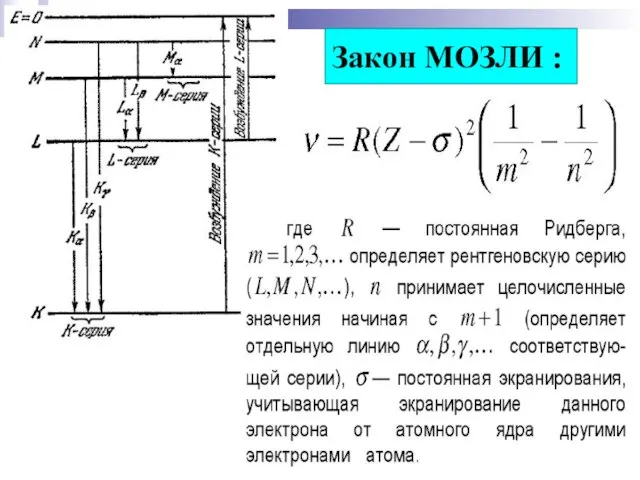
- 19. § 9.10. Рентгеновское излучение. Граница сплошного спектра – λmin :
- 20. Закон МОЗЛИ :
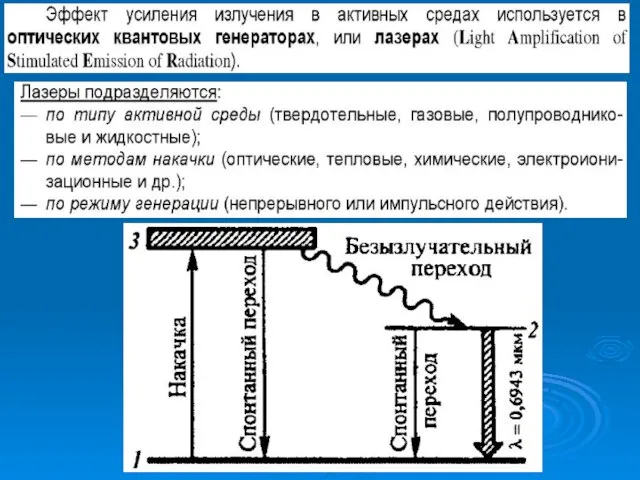
- 21. § 9.12. Поглощение. Спонтанное и вынужденное излучение.
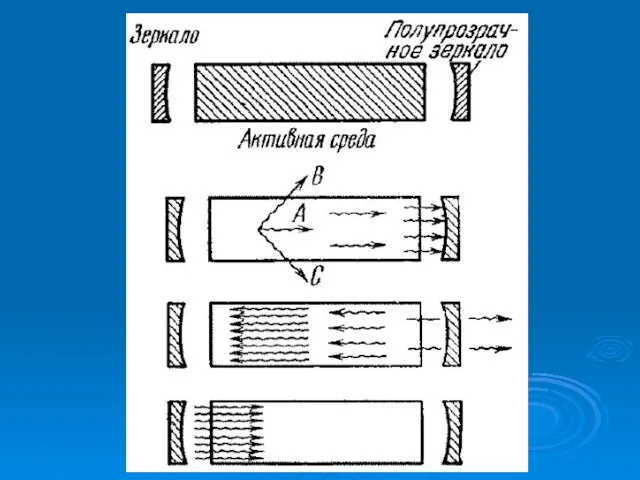
- 22. § 9.13. ЛАЗЕРЫ.
- 26. Скачать презентацию












 Услуга «Персональный ассистент»
Услуга «Персональный ассистент» Возможные дефекты облицовывания, их предупреждение и устранение
Возможные дефекты облицовывания, их предупреждение и устранение Основы проектной деятельности
Основы проектной деятельности Беспилотная доставка
Беспилотная доставка Картинг, от макета к реальности
Картинг, от макета к реальности Подготовка учащихся к олимпиадам по обществознанию праву, ЕГЭ и ОГЭ
Подготовка учащихся к олимпиадам по обществознанию праву, ЕГЭ и ОГЭ Уважаемые партнеры! Мы рады представить эксклюзивную новинку Color Symphony винил вспененный на флизелине1,06*10m
Уважаемые партнеры! Мы рады представить эксклюзивную новинку Color Symphony винил вспененный на флизелине1,06*10m Очищение и кондиционирование. Предложение для клиента
Очищение и кондиционирование. Предложение для клиента Разработка блок-схем в программе Microsoft Office Visio 2007
Разработка блок-схем в программе Microsoft Office Visio 2007 Вероятность прогноза температур рельсов
Вероятность прогноза температур рельсов Приемная кампания 2012
Приемная кампания 2012 Запрос и предложение - способ коммуникации между заказчиком и исследовательским агентством
Запрос и предложение - способ коммуникации между заказчиком и исследовательским агентством Развитие речи. Заметка. Герои Алтайской земли.
Развитие речи. Заметка. Герои Алтайской земли. Презентация на тему Формирование универсальных учебных действий в образовательном пространстве начальной школы в условиях внедр
Презентация на тему Формирование универсальных учебных действий в образовательном пространстве начальной школы в условиях внедр Презентация по информатике на тему: Поколение третье. Интегральные схемы.
Презентация по информатике на тему: Поколение третье. Интегральные схемы. Цех по изготовлению металлоконструкций п. Балезино. Бизнес-план
Цех по изготовлению металлоконструкций п. Балезино. Бизнес-план Презентация
Презентация Эмоционально-волевая реакция. Психофизиологические качества водителя
Эмоционально-волевая реакция. Психофизиологические качества водителя Создание изображения для фона презентации
Создание изображения для фона презентации Восстановление славянских государств
Восстановление славянских государств Масла индустриальные ГОСТ 17479.4-87
Масла индустриальные ГОСТ 17479.4-87 Симметрия в живой и неживой природе Выполнили: студенты 1-го курса Факультет: Таможенное дело Группа: Т-116с. Уваров Антон, Панкрат
Симметрия в живой и неживой природе Выполнили: студенты 1-го курса Факультет: Таможенное дело Группа: Т-116с. Уваров Антон, Панкрат МОУ Медведская ООШ ФГОС начальная школа
МОУ Медведская ООШ ФГОС начальная школа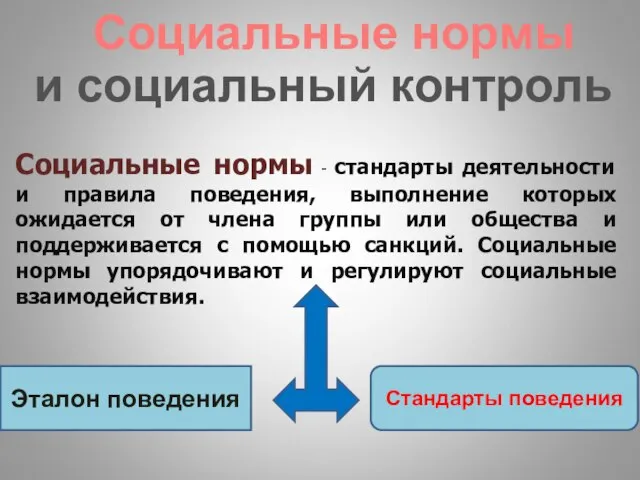 Социальные нормы и социальный контроль
Социальные нормы и социальный контроль .
. Презентация
Презентация Самая большая ошибка человека
Самая большая ошибка человека Neizvedannye_zemli
Neizvedannye_zemli