Содержание
- 4. § 9.2. Уравнение Шредингера. Волновая функция. плотность вероятности: условие нормировки вероятности:
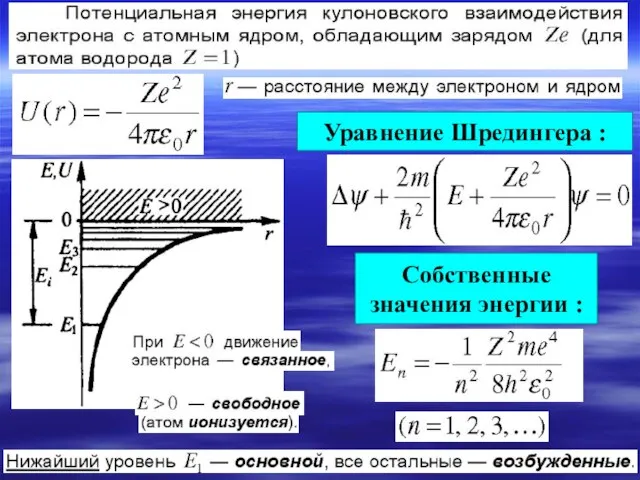
- 5. Уравнение Шредингера для стационарных состояний.
- 6. Уравнение Шредингера : Собственные значения энергии :
- 7. § 9.3. Квантовые числа.
- 8. Эффект Зеемана – расщепление в магнитном поле уровня с главным квантовым числом n на 2l+1 подуровней.
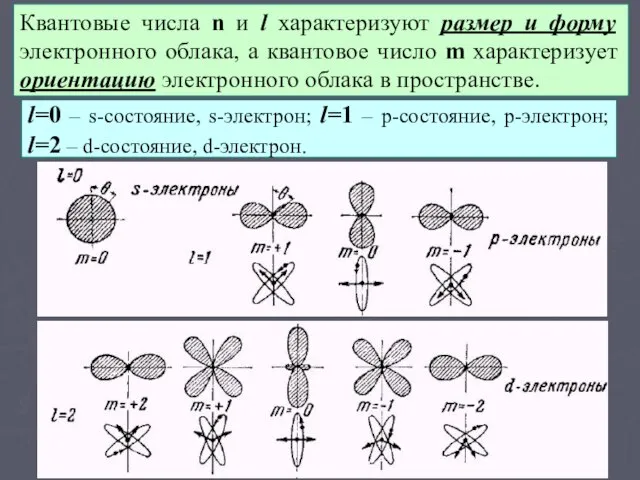
- 9. Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число m характеризует
- 10. Правила отбора: Для электрона существуют такие переходы, для которых : изменение Δl орбитального квантового числа l
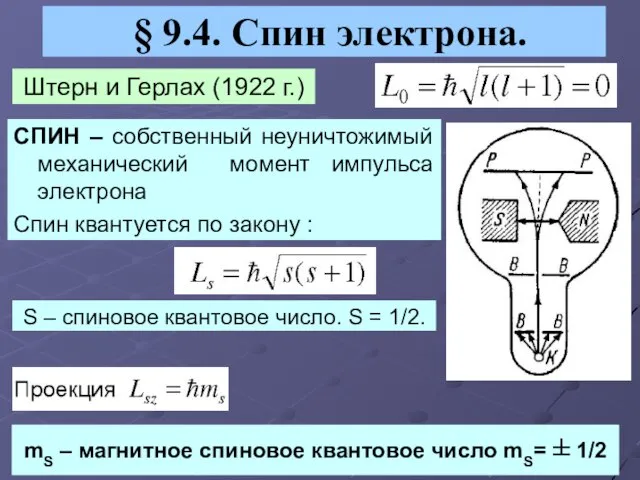
- 11. § 9.4. Спин электрона. Штерн и Герлах (1922 г.) СПИН – собственный неуничтожимый механический момент импульса
- 12. Состояние электрона в атоме определяется набором четырех квантовых чисел: главного n (n=1, 2, 3, …) орбитального
- 13. § 9.5. Распределение электронов в атоме по состояниям. ПРИНЦИП ПАУЛИ: В одном и том же атоме
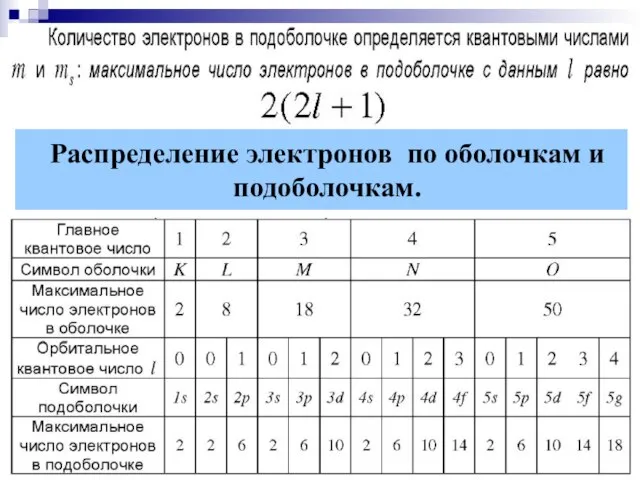
- 14. Распределение электронов по оболочкам и подоболочкам.
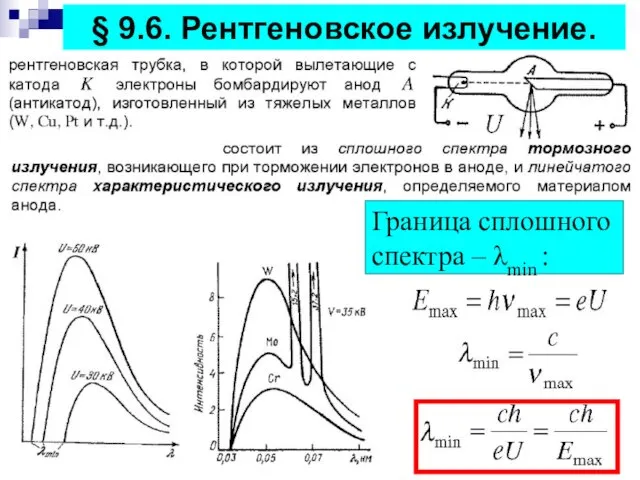
- 16. § 9.6. Рентгеновское излучение. Граница сплошного спектра – λmin :
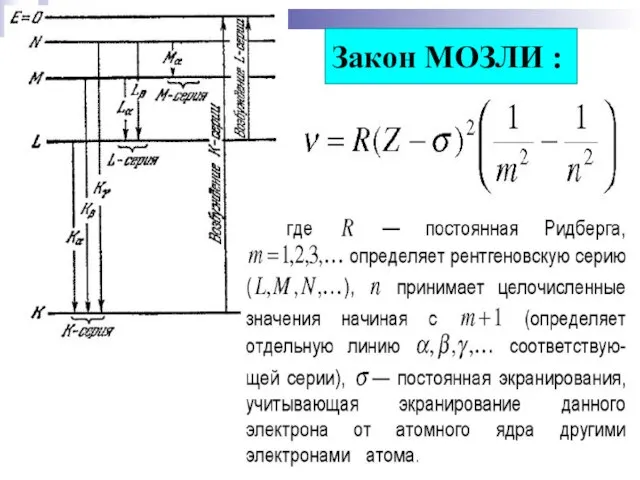
- 17. Закон МОЗЛИ :
- 18. § 9.7. Поглощение. Спонтанное и вынужденное излучение.
- 20. Скачать презентацию










 Презентация(проект) на тему:
Презентация(проект) на тему: Юридический клуб Екатеринбурга. Правовая просвещенность. Профессиональный выбор. Гражданская позиция
Юридический клуб Екатеринбурга. Правовая просвещенность. Профессиональный выбор. Гражданская позиция 1 признак
1 признак Права собственников участков земли
Права собственников участков земли Автомобилизация России и проблемы регулирования
Автомобилизация России и проблемы регулирования Сиропы. Помада. Кандир. Фруктово-ягодные полуфабрикаты
Сиропы. Помада. Кандир. Фруктово-ягодные полуфабрикаты Презентация на тему Биогеоценоз как особый уровень организации жизни
Презентация на тему Биогеоценоз как особый уровень организации жизни Владимир Иванов, ген. директор PM Consulting Services. - презентация
Владимир Иванов, ген. директор PM Consulting Services. - презентация Пирожное "Пасхальное яйцо"
Пирожное "Пасхальное яйцо" СВЕТЛОЕ ХРИСТОВО ВОСКРЕСЕНИЕ
СВЕТЛОЕ ХРИСТОВО ВОСКРЕСЕНИЕ Редкие насекомые нуждающиеся в охране
Редкие насекомые нуждающиеся в охране Нагрев проводников и электрических аппаратов. Лекция 11
Нагрев проводников и электрических аппаратов. Лекция 11 PCI DSS в Украине К чему готовиться?
PCI DSS в Украине К чему готовиться? Dima_Maria - Use case application of SU2 soft package
Dima_Maria - Use case application of SU2 soft package Формирование ключевых компетенций учащихся начальной школы
Формирование ключевых компетенций учащихся начальной школы Внеземная жизнь в кинематографе
Внеземная жизнь в кинематографе Орфографический практикум
Орфографический практикум Lipatova_MA_Prezentatsia (1)
Lipatova_MA_Prezentatsia (1) Семинар «Поиск инвестора и подготовка документов для встречи с ним»
Семинар «Поиск инвестора и подготовка документов для встречи с ним» Возникновение культуры (первобытное общество) (Тема 3)
Возникновение культуры (первобытное общество) (Тема 3) Презентация на тему "УРОК ЗНО Інтернет і ЗНО-2014" - скачать презентации по Педагогике
Презентация на тему "УРОК ЗНО Інтернет і ЗНО-2014" - скачать презентации по Педагогике Отчёт директора МБУ ДО ДШИ №1
Отчёт директора МБУ ДО ДШИ №1 The balance sheet
The balance sheet Практика внедрения систем безналичного расчёта питания в школах. Создание единой городской информационной системы
Практика внедрения систем безналичного расчёта питания в школах. Создание единой городской информационной системы Какого цвета небо?
Какого цвета небо? Многокомпонентный динамометр
Многокомпонентный динамометр Робер Кампен (1378 – 1444)
Робер Кампен (1378 – 1444) Презентация на тему: Обезьянка-воровка
Презентация на тему: Обезьянка-воровка