Содержание
- 2. содержание Введение……………………………………………………………………………. История развития фосфора………………………………………………………... Природные соединения и получение фосфора…………………………………... Химические свойства……………………………………………………………… Аллотропные изменения…………………………………………………………... а) белый……………………………………………………………………………..
- 3. Введение: Пятая группа Периодической системы включает два типических элемента азот и фосфор – и подгруппы мышьяка
- 4. История открытия фосфора По иронии судьбы фосфор открывался несколько раз. Причем всякий раз получали его из
- 5. Природные соединения и получение фосфора По распространенности в земной коре фосфор опережает азот, серу и хлор.
- 6. Химические свойства Электронная конфигурация атома фосфора 1s22s22p63s23p3 Наружный электронный слой содержит 5 электронов. Наличием трех неспаренных
- 7. S P D Переход атома фосфора в возбужденное состояние
- 9. Белый фосфор Белая модификация фосфора, получающаяся при конденсации паров, имеет молекулярную кристаллическую решетку, в узлах которой
- 10. Красный и черный фосфор Красный фосфор находит применение в металлургии, производстве полупроводниковых материалов и ламп накаливания,
- 11. Опыт, иллюстрирующий переход красного фосфора в белый 1-молекулы белого фосфора; 2-кристаллическая. решетка черного фосфора 3
- 12. Оксид фосфора (V) - Р2О5 Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V)
- 13. Ортофосфорная кислота. Известно несколько кислот, содержащих фосфор. Важнейшая из них — ортофосфорная кислота Н3РО4 Безводная ортофосфорная
- 14. Ортофосфорная кислота.
- 15. Физические свойства Н3РО4 Ортофосфорная кислота в чистом виде при обычных условиях представляет бесцветные кристаллы ромбической формы,
- 17. Химические свойства Н3РО4 При нейтрализации фосфорной кислоты щелочами образуются соли: дигидрофосфаты, гидрофосфаты, а также фосфаты, например:
- 18. Фосфор в организме человека В теле человека массой 70 кг. Содержится около 780 г. фосфора. В
- 19. Спички Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав спичечной головки
- 24. Значение фосфора Фосфорная кислота имеет большое значение как один из важнейших компонентов питания растений. Фосфор используется
- 25. Применение фосфора Применяют ортофосфорную кислоту в настоящее время довольно широко. Основным ее потребителем служит производство фосфорных
- 26. Задания Фосфор 1. Составьте электронную формулу атома фосфора. Объясните, что происходит с электронной конфигурацией атома, когда
- 27. Ортофосфорная кислота и ее соли 1. Напишите уравнения реакций между ортофосфорной кислотой и следующими веществами: а)
- 29. Скачать презентацию
Слайд 2содержание
Введение…………………………………………………………………………….
История развития фосфора………………………………………………………...
Природные соединения и получение фосфора…………………………………...
Химические свойства………………………………………………………………
Аллотропные изменения…………………………………………………………...
а)
содержание
Введение…………………………………………………………………………….
История развития фосфора………………………………………………………...
Природные соединения и получение фосфора…………………………………...
Химические свойства………………………………………………………………
Аллотропные изменения…………………………………………………………...
а)

б) красный……………………………………………………………
в) черный…………………………………………………………………………….
Оксиды фосфора……………………………………………………………………
Ортофосфорная кислота…………………………………………………………...
Ортофосфаты……………………………………………………………………….
Фосфор в организме человека……………………………………………………..
Спички……………………………………………………………………………….
Фосфорные удобрения……………………………………………………………..
Заключение………………………………………………………………………….
1. Значение фосфора………………………………………………………………..
2. Применение фосфора……………………………………………………………
Список используемой литературы………………………………………………..
Слайд 3Введение:
Пятая группа Периодической системы включает два типических элемента азот и фосфор –
Введение:
Пятая группа Периодической системы включает два типических элемента азот и фосфор –

В состоянии простых веществ азот – газ, а фосфор – твердое вещество.
Эти два вещества получили большую область применения, хотя когда азот впервые был выделен из воздуха его посчитали вредным газом, а на продаже фосфора удавалось заработать большое количество денег (в фосфоре ценили его способность светиться в темноте).
Слайд 4История открытия фосфора
По иронии судьбы фосфор открывался несколько раз. Причем всякий
История открытия фосфора
По иронии судьбы фосфор открывался несколько раз. Причем всякий

Альхильд Бехиль (XII век) открыл фосфор при перегонке мочи в смеси с глиной, известью и углем. Однако датой открытия фосфора считается 1669 год.
Гамбургский алхимик-любитель Хеннинг Бранд, разорившийся купец, мечтавший с помощью алхимии поправить свои дела, подвергал обработке самые разнообразные продукты. Предполагая, что физиологические продукты могут содержать «первичную материю», считавшейся основой философского камня,
Бранд заинтересовался человеческой мочей.
Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту жидкость он вновь дистиллировал и получил тяжелое красное «уринное масло», которое перегонялось с образованием твердого остатка. Нагревая последний, без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившего в темноте. Бранд назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
Несколько лет «рецепт приготовления» фосфора хранился в строжайшем секрете и был известен лишь нескольким алхимикам. В третий раз фосфор открыл Р.Бойль в 1680 году.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергали смесь мочи с оксидом свинца (PbO), поваренной солью (NaCl), поташом (K2CO3) и углем (C). Лишь к 1777 году К.В.Шееле заработал способ получения фосфора из рога и костей животных.
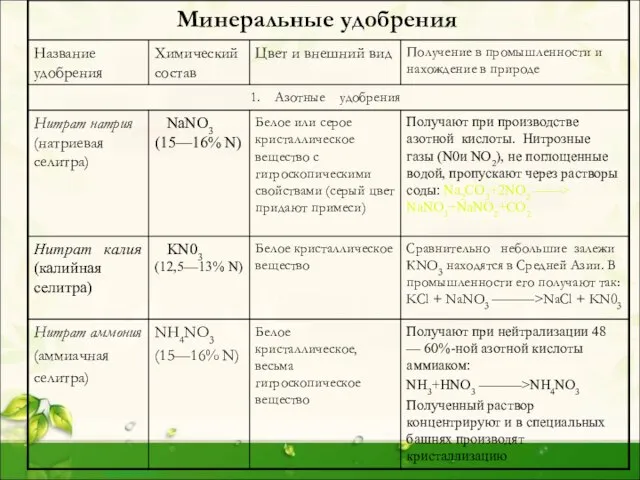
Слайд 5Природные соединения и получение фосфора
По распространенности в земной коре фосфор опережает
Природные соединения и получение фосфора
По распространенности в земной коре фосфор опережает

В наши дни фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема:
Ca3(PO4)2+3SiO2+5C 3CaSiO3+5CO+2P
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
Слайд 6 Химические свойства
Электронная конфигурация атома фосфора
1s22s22p63s23p3
Наружный электронный слой содержит 5 электронов. Наличием
Химические свойства
Электронная конфигурация атома фосфора
1s22s22p63s23p3
Наружный электронный слой содержит 5 электронов. Наличием

Но на третьем энергетическом уровне имеются вакантные ячейки d- орбиталей, поэтому при переходе в возбужденное состояние 3S-электроны будут разъединяться, переходить на d подуровень, что приводит к образованию 5-ти неспаренных элементов.
Таким образом, валентность фосфора в возбужденном состоянии равна 5.
В соединениях фосфор обычно проявляет степень окисления +5(P2O5, H3PO4), реже +3(P2O3, PF3), -3(AlP, PH3, Na3P, Mg3P2).
Слайд 7 S P D
Переход атома фосфора в возбужденное состояние
S P D
Переход атома фосфора в возбужденное состояние

Слайд 9Белый фосфор
Белая модификация фосфора, получающаяся при конденсации паров, имеет молекулярную кристаллическую решетку,
Белый фосфор
Белая модификация фосфора, получающаяся при конденсации паров, имеет молекулярную кристаллическую решетку,

Он энергично взаимодействует с кислородом, галогенами, серой и металлами.
Окисление фосфора на воздухе сопровождается разогреванием и свечением.
Поэтому белый фосфор хранят под водой, с которой он не реагирует. Белый фосфор очень токсичен.
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
Техника безопасности. В производстве фосфора и его соединений требуется соблюдение особых мер предосторожности, т.к. белый фосфор – сильный яд.
Продолжительная работа в атмосфере белого фосфора может привести к заболеванию костных тканей, выпадению зубов, омертвению участков челюстей.
Воспламеняясь, белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белый фосфор следует под водой, в герметичных сосудах.
Горящий фосфор тушат двуокисью углерода, раствором CuSO4 или песком.
Обожженную кожу следует промыть раствором KMnO4 или CuSO4. Противоядием при отравлении фосфором является 2%-ый раствор CuSO4.
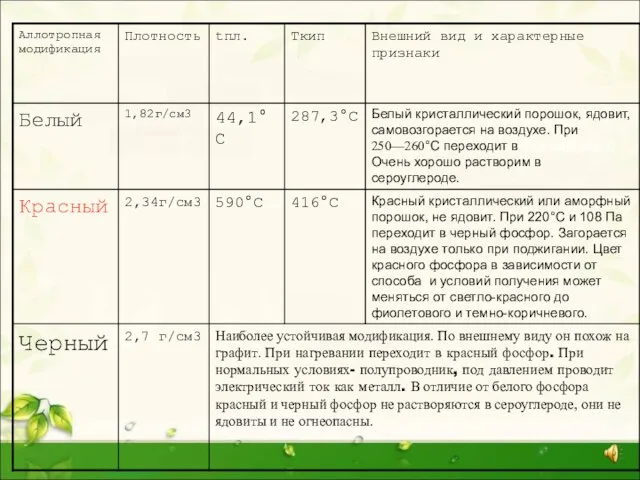
При длительном хранении, а также при нагревании белый фосфор переходит в красную модификацию (впервые его получили лишь 1847 году). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до темно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, и по сравнению с белым фосфором они менее реакционноспособны и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи.
Слайд 10Красный и черный фосфор
Красный фосфор находит применение в металлургии, производстве полупроводниковых материалов
Красный и черный фосфор
Красный фосфор находит применение в металлургии, производстве полупроводниковых материалов

Наиболее стабильной модификацией фосфора является черный фосфор. Его получают аллотропным превращением белого фосфора при t=2200C и повышенным давлением. По внешнему виду он напоминает графит. Кристаллическая структура черного фосфора слоистая, состоящая из гофрированных слоев (рис.2). Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется в белый фосфор.
Слайд 11Опыт, иллюстрирующий переход красного фосфора в белый
1-молекулы белого фосфора; 2-кристаллическая. решетка черного
Опыт, иллюстрирующий переход красного фосфора в белый
1-молекулы белого фосфора; 2-кристаллическая. решетка черного

3
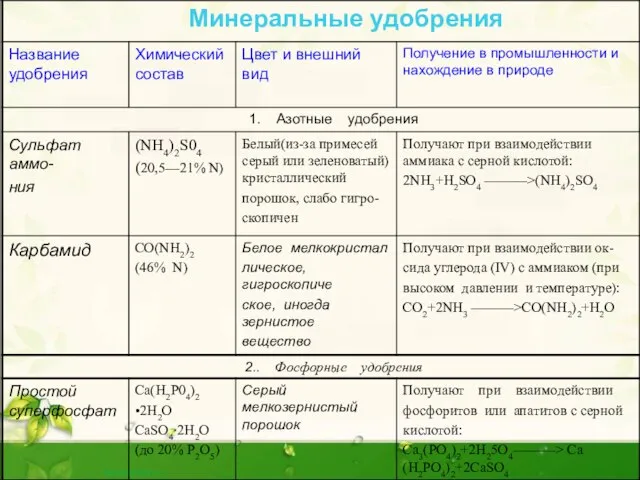
Слайд 12 Оксид фосфора (V) - Р2О5
Фосфор образует несколько оксидов.
Важнейшим из
Оксид фосфора (V) - Р2О5
Фосфор образует несколько оксидов.
Важнейшим из

Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора.
Белые кристаллы, t пл.= 5700оС, t кип.= 6000оC, ρ= 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение:
4P + 5O2 = 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O = H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO =Ba3(PO4)2
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества.
Слайд 13Ортофосфорная кислота.
Известно несколько кислот, содержащих фосфор.
Важнейшая из них — ортофосфорная кислота
Ортофосфорная кислота.
Известно несколько кислот, содержащих фосфор.
Важнейшая из них — ортофосфорная кислота

Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,35оС. С водой фосфорная кислота образует растворы любых концентраций.
Слайд 14Ортофосфорная кислота.
Ортофосфорная кислота.

Слайд 15Физические свойства Н3РО4
Ортофосфорная кислота в чистом виде при обычных условиях представляет
Физические свойства Н3РО4
Ортофосфорная кислота в чистом виде при обычных условиях представляет

Чистая Н3РО4 после плавления образует вязкую маслообразную жидкость с малой электрической проводимостью и сильно пониженной способностью к диффузии. Эти свойства, а также детальное изучение спектров показывают, молекулы Н3РО4 в данном случае практически не диссоциированы и объединены прочными водородными связями в единую макромолекулярную структуру. Как правило, молекулы связаны друг с другом одной, реже двумя и очень редко тремя водородными связями.
Если же кислоту разбавлять водой, то ее молекулы охотнее образуют водородные связи с водой, чем друг с другом. Из-за таких "симпатий" к воде кислота смешивается с ней в любых отношениях. Энергия гидратации здесь не так велика, как у серной кислоты, поэтому разогревание Н3РО4 при разбавлении не столь сильное и диссоциация выражена меньше. По первой ступени диссоциации ортофосфорная кислота считается электролитом средней силы (25 - 30%), по второй - слабым, по третьей - очень слабым.
Слайд 17 Химические свойства Н3РО4
При нейтрализации фосфорной кислоты щелочами образуются соли:
Химические свойства Н3РО4
При нейтрализации фосфорной кислоты щелочами образуются соли:

Н3РО4 + NaOH = NaH2PO4 + H2O
дигидрофосфат
натрия
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
гидрофосфат
натрия
H3PO4 + 3NaOH = Na3PO4 + 3H2O
фосфат
натрия
Слайд 18Фосфор в организме человека
В теле человека массой 70 кг. Содержится около 780
Фосфор в организме человека
В теле человека массой 70 кг. Содержится около 780

Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г.
Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлеба содержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль и некоторые виды сыра.
Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальцием: оптимальное соотношение в этих элементах пищи составляет 1,5/1. Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Слайд 19Спички
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В
Спички
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В

(PbO2, KСlO3, BaCrO4) и восстановители (S, Sb2S3). При трении от зажигательной поверхности смесь, нанесенная на спичку, воспламеняется.
Первые фосфорные спички – с головкой из белого фосфора – были созданы лишь 1827 г. 6P + 5KCLO3 = 5KCL + 3P2O5
Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками, как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX века.
Слайд 24Значение фосфора
Фосфорная кислота имеет большое значение как один из важнейших компонентов питания
Значение фосфора
Фосфорная кислота имеет большое значение как один из важнейших компонентов питания

Производные ортофосфорной кислоты очень нужны не только растениям, но и животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых организмов состоят, в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота, образуя различные соединения с органическими веществами, активно участвуют в процессах обмена веществ живого организма с окружающей средой. В результате этого производные фосфора содержатся в костях, мозге, крови, в мышечных и соединительных тканях организмов человека и животных. Особенно много ортофосфорной кислоты в составе нервных (мозговых) клеток, что позволило А.Е. Ферсману, известному геохимику, назвать фосфор "элементом мысли". Весьма отрицательно (заболевание животных рахитом, малокровие, и др.) сказывается на состоянии организма понижение содержания в рационе питания соединений фосфора или введение их в неусвояемой форме.
Слайд 25 Применение фосфора
Применяют ортофосфорную кислоту в настоящее время довольно широко.
Основным ее
Применение фосфора
Применяют ортофосфорную кислоту в настоящее время довольно широко.
Основным ее

Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны и другие применения ортофосфорной кислоты в промышленности.
Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков.
Слайд 26 Задания
Фосфор
1. Составьте электронную формулу атома фосфора. Объясните, что происходит с
Задания
Фосфор
1. Составьте электронную формулу атома фосфора. Объясните, что происходит с

2. Какие степени окисления может проявлять фосфор в соединениях? Приведите примеры этих соединений. Составьте электронную формулу атома фосфора в степени окисления +3.
3. В чем состоят основные различия физических и химических свойств красного и белого фосфора. Как можно отделить красный фосфор от примеси белого?
4. Рассчитайте относительную плотность фосфина по водороду и воздуху. Легче или тяжелее фосфин этих газов?
5. Как можно осуществить переход от красного фосфора к белому и обратно? Являются ли эти процессы химическими явлениями? Ответ поясните.
6. Вычислите массу фосфора, который надо сжечь в кислороде для получения оксида фосфора (V) массой 3,55 г?
7. Смесь красного и белого фосфора массой 20 г обработали сероуглеродом. Нерастворившийся остаток отделили и взвесили, его масса составила 12,6 г. Вычислите массовую долю белого фосфора в исходной смеси.
8. Каков тип химической связи в соединениях: а) РН3; б) РСl5; в) Li3Р. В полярных веществах укажите направление смещения общих электронных пар.
9. Фосфин можно получить действием соляной кислоты на фосфид кальция. Рассчитайте объем фосфина (нормальные условия), который образуется из 9,1 г фосфида кальция. Массовая доля выхода продукта составляет 90%.
Слайд 27 Ортофосфорная кислота и ее соли
1. Напишите уравнения реакций между ортофосфорной кислотой
Ортофосфорная кислота и ее соли
1. Напишите уравнения реакций между ортофосфорной кислотой

2. Составьте уравнения реакций между ортофосфорной кислотой и гидроксидом калия, в результате которых образуются 3 типа солей: средняя и две кислых.
3. Какая из кислот является более сильным окислителем: азотная или ортофосфорная? Ответ поясните.
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Р → Р205 →Н3Р04 →Nа3Р04 → Са3(Р04)2
5. С помощью каких реакций можно осуществить следующие превращения:
Р →Са3Р2 →РН3 →Р2О5 →К3Р04 →Са3(Р04)2→Са(Н2Р04)2
Напишите уравнения этих реакций.
6. Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций:
а) РНз + О2 →Р2О5 + Н2О б) Са3(РО4)2 + С + SiO2 →СаSiO3 + Р + СО
7. Какую массу раствора с массовой долей фосфорной кислоты 40% можно получить из фосфорита массой 100 кг с массовой долей Са3(РО4)2 93%?
8. Из природного фосфорита массой 310 кг получили фосфорную кислоту массой 195кг. Вычислите массовую долю Са3(РО4)2 в природном фосфорите.
9. Водный раствор, содержащий фосфорную кислоту массой 19,6 г, нейтрализовали гидроксидом кальция массой 18,5 г. Определите массу образовавшегося преципитата СаHРО4 • 2Н2О.
10. Имеется раствор фосфорной кислоты массой 150 г (массовая доля Н3РО4 24,5%). Рассчитайте объем аммиака (нормальные условия), который надо пропустить через раствор для получения дигидрофосфата аммония.
11. Какая соль образуется, если к раствору, содержащему Н3РО4 массой 4,9 г, добавили гидроксид калия массой 2,8 г? Рассчитайте массу полученной соли



 Дипломная работаинтерьеры коттеджа ,,SUMMER SKY”( Летнее небо)
Дипломная работаинтерьеры коттеджа ,,SUMMER SKY”( Летнее небо) «Об изменениях в законодательстве в области обязательного подтверждения соответствия товаров, ввозимых на таможенную территорию
«Об изменениях в законодательстве в области обязательного подтверждения соответствия товаров, ввозимых на таможенную территорию Договор подряда Бабарыкина Н. МЭ081
Договор подряда Бабарыкина Н. МЭ081 Статистика профсоюзной организации
Статистика профсоюзной организации Weather. Seasons
Weather. Seasons Вибрационная болезнь
Вибрационная болезнь Творческий отчет тимуровского отряда Горячие сердца
Творческий отчет тимуровского отряда Горячие сердца АО Кокшетауские Минеральные Воды
АО Кокшетауские Минеральные Воды Разложение многочленов на множители
Разложение многочленов на множители Enjoy English
Enjoy English ОбъектГод Финишное покрытие Генподрядчик Дом Татарской Кулинарии 2002- 2004 Capatect ЗАО "Фобос" Торговый центр "Модная семья" 2002 Muresko-PlusЗАО
ОбъектГод Финишное покрытие Генподрядчик Дом Татарской Кулинарии 2002- 2004 Capatect ЗАО "Фобос" Торговый центр "Модная семья" 2002 Muresko-PlusЗАО Technik reklamy
Technik reklamy ОП по Гагинскому району МО МВД России Большеболдинский: история, сегодняшнее состояние и перспективы развития
ОП по Гагинскому району МО МВД России Большеболдинский: история, сегодняшнее состояние и перспективы развития Реферат«Трудный путь к победе»(Великая Отечественная война 1941-1945)Выполнила:учащаяся 10 «А» классаМОУ СОШ №40Амелина М.И.Научны
Реферат«Трудный путь к победе»(Великая Отечественная война 1941-1945)Выполнила:учащаяся 10 «А» классаМОУ СОШ №40Амелина М.И.Научны Викторина по биологии (8 класс)
Викторина по биологии (8 класс) ГЛАДИЛИНА ОЛЬГА ВАЛЕРЬЕВНА
ГЛАДИЛИНА ОЛЬГА ВАЛЕРЬЕВНА Пример построения сочинения- рассуждения по предложенному тексту ЕГЭ – 2004, 2005Переходите к части С, даже если в школе Вам обычно н
Пример построения сочинения- рассуждения по предложенному тексту ЕГЭ – 2004, 2005Переходите к части С, даже если в школе Вам обычно н О предварительных итогах реализации приоритетного национального проекта «Здоровье» в 2006 – 2007 годах, мероприятиях и параметрах п
О предварительных итогах реализации приоритетного национального проекта «Здоровье» в 2006 – 2007 годах, мероприятиях и параметрах п Щенок из гофрокартона
Щенок из гофрокартона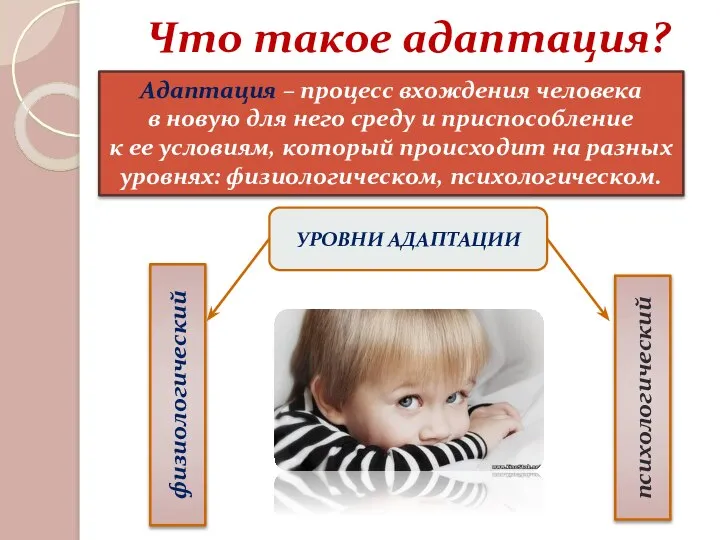 Адаптация. Степени тяжести адаптации
Адаптация. Степени тяжести адаптации Типовые менеджерские ошибки, совершаемые заказчиком при разработке сайта
Типовые менеджерские ошибки, совершаемые заказчиком при разработке сайта Структура специальностей подготовки аспирантов. Требования к кандидатским диссертациям
Структура специальностей подготовки аспирантов. Требования к кандидатским диссертациям Презентация на тему Крылатые выражения в речи
Презентация на тему Крылатые выражения в речи Структура персонала ПАО Аэрофлот
Структура персонала ПАО Аэрофлот Древнерусская культура 9 класс
Древнерусская культура 9 класс Общественная экологическая экспертиза
Общественная экологическая экспертиза ЭЛЕКТРОДВИГАТЕЛИ НА КУХНЕ
ЭЛЕКТРОДВИГАТЕЛИ НА КУХНЕ Парк мечты.
Парк мечты.