Содержание
- 2. Гидролиз – это реакции обменного Взаимодействия вещества с водой, приводящие к их разложению. Гидролизу подвергаются соединения
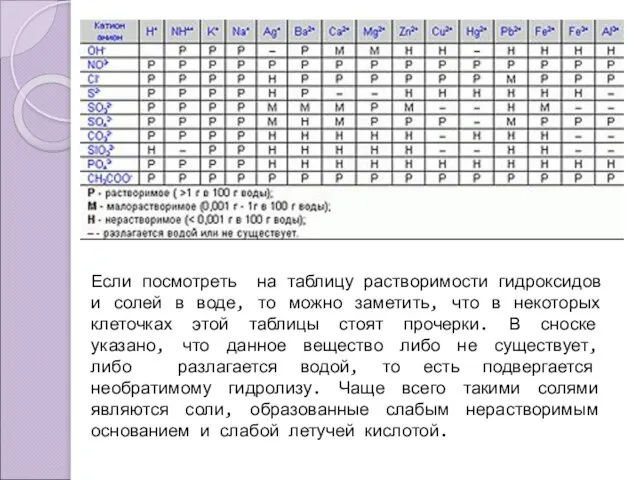
- 3. Если посмотреть на таблицу растворимости гидроксидов и солей в воде, то можно заметить, что в некоторых
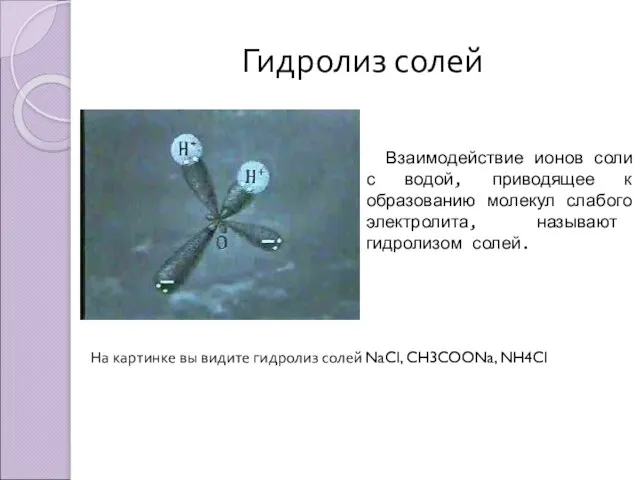
- 4. Гидролиз солей Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
- 5. Количественной характеристикой Гидролиза солей может служить степень гидролиза (a), определяемая отношением концентрации гидролизованной части молекул к
- 6. Частичный Гидролиз трёхкальциевого силиката является причиной выделения свободной извести при взаимодействии портландцемента с водой (см. Цемент).
- 7. Различают несколько вариантов гидролиза солей: 1. Гидролиз соли слабой кислоты и сильного основания: Na2CO3 + Н2О
- 8. Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно
- 9. При гидролизе жиров в присутствии щелочей получают мыла. Гидролиз жиров в присутствии катализаторов применяется для получения
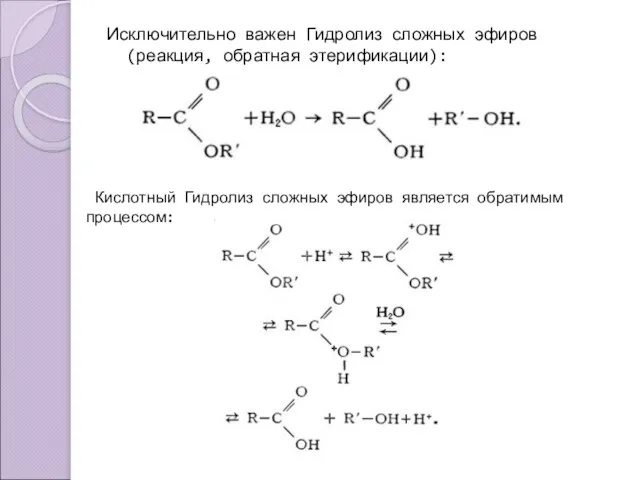
- 10. Исключительно важен Гидролиз сложных эфиров (реакция, обратная этерификации): Кислотный Гидролиз сложных эфиров является обратимым процессом:
- 11. Термин «Гидролиз» обычно применяется в органической химии также по отношению к некоторым процессам, которые более правильно
- 13. Скачать презентацию







 Современные возможности пробиотической терапии в клинике внутренних болезней
Современные возможности пробиотической терапии в клинике внутренних болезней Территория смыслов
Территория смыслов Карта пробных ароматов: Al Haramain/Aysha (милая)
Карта пробных ароматов: Al Haramain/Aysha (милая) Понятие мониторинга
Понятие мониторинга Прием письменного вычитания в случаях вида 50-24
Прием письменного вычитания в случаях вида 50-24 Акварельные зарисовки
Акварельные зарисовки Русские народные сказки
Русские народные сказки Красная книга растений
Красная книга растений Биография. Шаблон
Биография. Шаблон Дифференциальная диагностика и принципы лечения синдрома Корнелии Де ЛАНГЕ
Дифференциальная диагностика и принципы лечения синдрома Корнелии Де ЛАНГЕ Презентация на тему Телескоп
Презентация на тему Телескоп Презентация Сушильникова Н.И. Экологическая сказка
Презентация Сушильникова Н.И. Экологическая сказка Телеметрическая платформа M2MGate Solution
Телеметрическая платформа M2MGate Solution Китайский клуб МИИТа
Китайский клуб МИИТа Тема выпускной квалификационной работы. Шаблон
Тема выпускной квалификационной работы. Шаблон Морской порт Санкт-Петербург. Отчет по результатам линейного обхода
Морской порт Санкт-Петербург. Отчет по результатам линейного обхода С днем рождения!!!
С днем рождения!!! Муниципальное дошкольное образовательное учреждение «Детский сад № 15» г. Чебоксары
Муниципальное дошкольное образовательное учреждение «Детский сад № 15» г. Чебоксары Презентация на тему Климат Африки
Презентация на тему Климат Африки Коммуникативный практикум
Коммуникативный практикум Государство. Понятие. Теории происхождения
Государство. Понятие. Теории происхождения Жизнь прекрасна
Жизнь прекрасна Измерение расхода. FR — лидер в новейшей высокоточной технологии измерения расхода
Измерение расхода. FR — лидер в новейшей высокоточной технологии измерения расхода Венев
Венев ПУТЕШЕСТВИЕ ПО МАТЕРИКАМ
ПУТЕШЕСТВИЕ ПО МАТЕРИКАМ Экономия водоснабжения
Экономия водоснабжения Рифмоплёт
Рифмоплёт Вареники с картошкой
Вареники с картошкой