Содержание
- 2. превращение одних веществ в другие. Вещества, полученные в результате реакции, отличаются от исходных веществ составом, строением
- 3. Признаки химических реакций Появление запаха Выделение газа Изменение окраски Выпадение осадка Растворение осадка Образование воды Выделение
- 4. Классификация по тепловому эффекту Эндотермические – с поглощением тепла + Q Экзотермические – с выделением тепла
- 5. Классификация по числу и составу исходных и образующихся веществ Реакции соединения: А + В = АВ
- 6. Тестовое задание. 1. Соотнесите: Тип реакции Схема реакции 1. замещения; а) 2ΗgO → 2Ηg+O2 ; 2.
- 7. 3. Реакции, в результате которых из одного сложного вещества образуется несколько более простого состава относятся к:
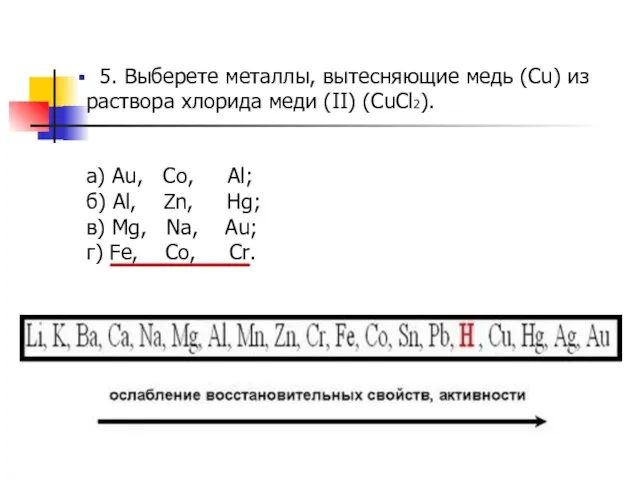
- 8. 5. Выберете металлы, вытесняющие медь (Cu) из раствора хлорида меди (II) (CuCl2). а) Au, Co, Al;
- 9. 6. По данным схемам реакций, запишите уравнения реакций. 1. Гидроксид меди (II) = оксид меди (II)
- 10. 6. Составьте уравнения последовательных реакций, используя подходящие реактивы: а) Ba → BaO → Ba(OH)2 → BaSO4
- 11. Домашнее задание Осуществите цепочку переходов S → SO2 → H2SO3 → Na2SO3 → SO2
- 13. Скачать презентацию









 GPS - навигаторы
GPS - навигаторы Куръон ва Мафхуми. Имомат
Куръон ва Мафхуми. Имомат Страхование политических рисков Подготовила : Клеутина Светлана ДС_01
Страхование политических рисков Подготовила : Клеутина Светлана ДС_01 Региональные праздники
Региональные праздники Документация педагогаСамообразованиеПортфолио
Документация педагогаСамообразованиеПортфолио Как общаться с подростком?
Как общаться с подростком? проект ИНДИbirds
проект ИНДИbirds 50 идей для контента
50 идей для контента Клеточный гуморальный иммунитет и их роль в защите от инфекций
Клеточный гуморальный иммунитет и их роль в защите от инфекций  е заседание РМО по профориентации
е заседание РМО по профориентации Мы будем продавать 3 продукта на тематику MARVEL. MVP
Мы будем продавать 3 продукта на тематику MARVEL. MVP Вправо или влево Вверх или вниз Тема: «Положительные и отрицательные числа» 6 класс.
Вправо или влево Вверх или вниз Тема: «Положительные и отрицательные числа» 6 класс. Я бы в тестеры пошел, пусть меня научат!
Я бы в тестеры пошел, пусть меня научат! Аполлон
Аполлон Железы внутренней секреции
Железы внутренней секреции Финансовая отчетность в соответствии с Международными стандартами финансовой отчетности (МСФО) за 2000 год
Финансовая отчетность в соответствии с Международными стандартами финансовой отчетности (МСФО) за 2000 год Конституция РФ
Конституция РФ Организационная структура Вооружённых сил. Виды Вооружённых сил. Рода войск. История их создания и предназначение
Организационная структура Вооружённых сил. Виды Вооружённых сил. Рода войск. История их создания и предназначение Методика маржинального анализа прибыли
Методика маржинального анализа прибыли Number shootout. Fun activities
Number shootout. Fun activities Старый Оскол во время Московской битвы
Старый Оскол во время Московской битвы Тема 16. Конфликты и методы их разрешения
Тема 16. Конфликты и методы их разрешения Liga robotov. 1 собрание
Liga robotov. 1 собрание Перформативность языка
Перформативность языка Оконное стекло. Технология изготовления.
Оконное стекло. Технология изготовления. Теория и практика аргументации
Теория и практика аргументации «1С-Битрикс: Управление сайтом ASP. NET 4.5»: новые возможности для созданиябезопасных и функциональных веб-проектов
«1С-Битрикс: Управление сайтом ASP. NET 4.5»: новые возможности для созданиябезопасных и функциональных веб-проектов Прямая и обратная пропорциональные зависимости
Прямая и обратная пропорциональные зависимости