Содержание
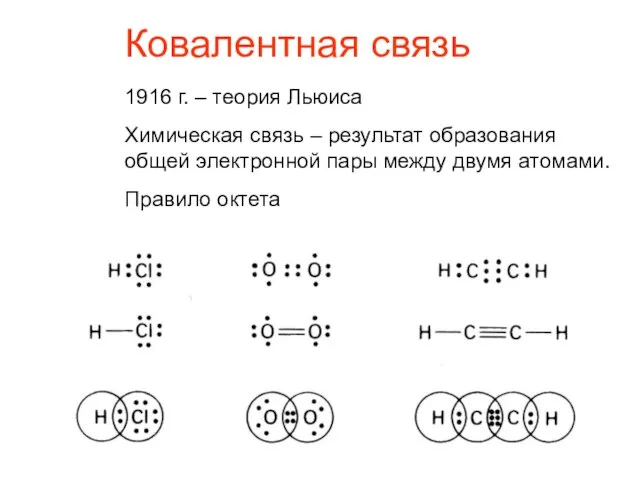
- 2. Ковалентная связь 1916 г. – теория Льюиса Химическая связь – результат образования общей электронной пары между
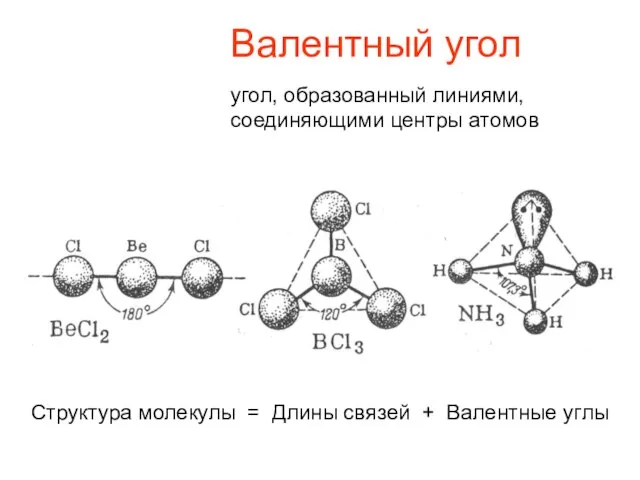
- 3. Валентный угол угол, образованный линиями, соединяющими центры атомов Структура молекулы = Длины связей + Валентные углы
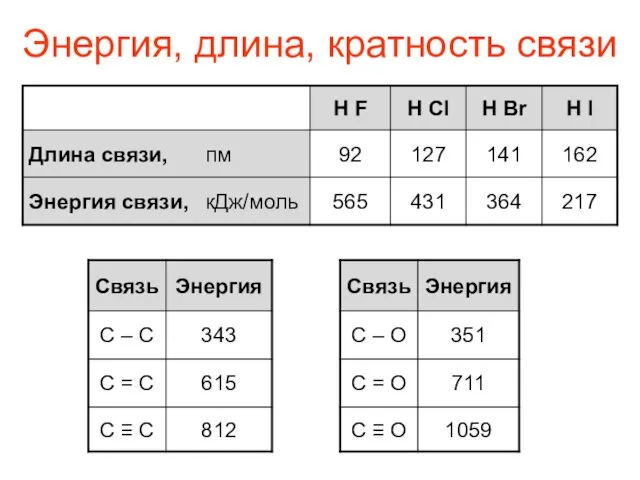
- 4. Энергия, длина, кратность связи
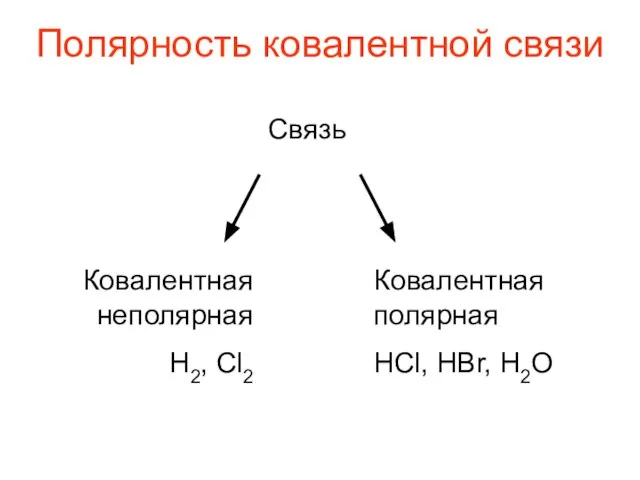
- 5. Полярность ковалентной связи Связь Ковалентная неполярная Н2, Cl2 Ковалентная полярная HCl, HBr, H2O
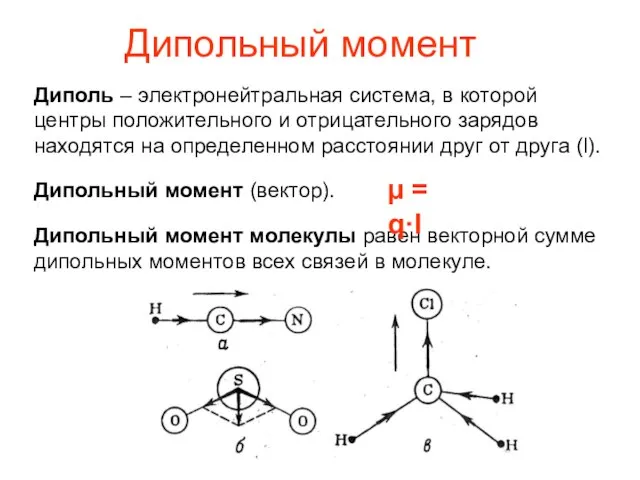
- 6. Дипольный момент Диполь – электронейтральная система, в которой центры положительного и отрицательного зарядов находятся на определенном
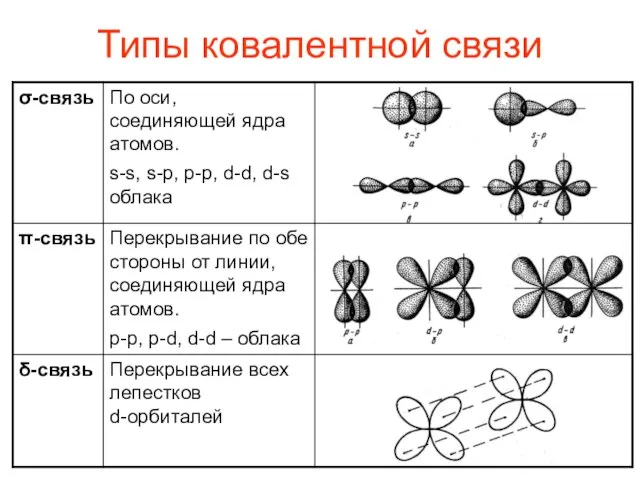
- 7. Типы ковалентной связи
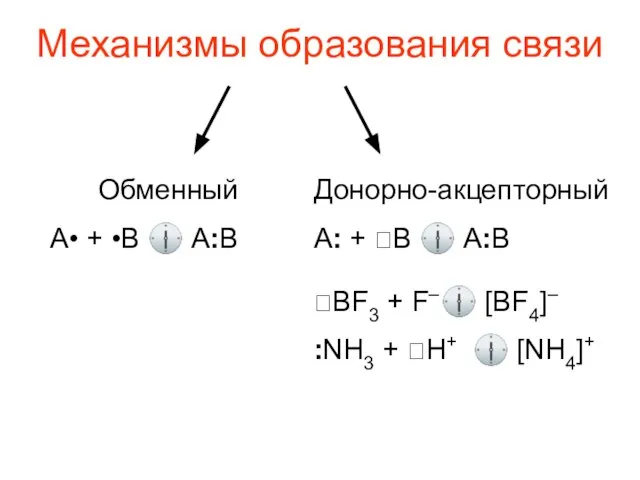
- 8. Механизмы образования связи
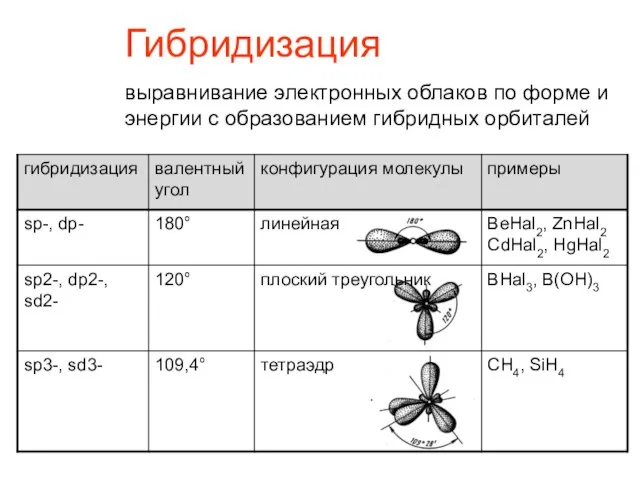
- 9. Гибридизация выравнивание электронных облаков по форме и энергии с образованием гибридных орбиталей
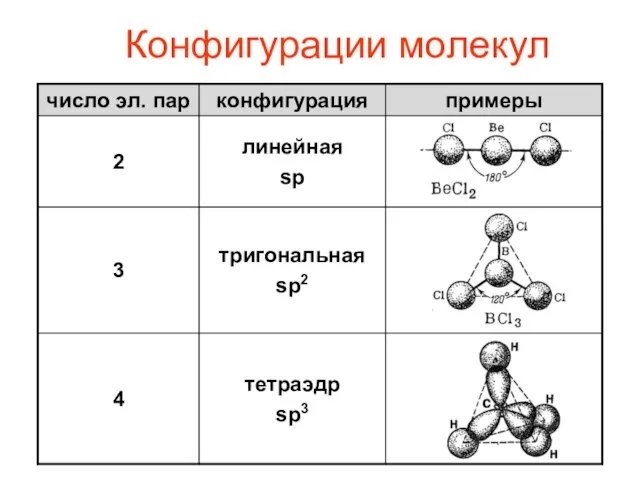
- 10. Конфигурации молекул
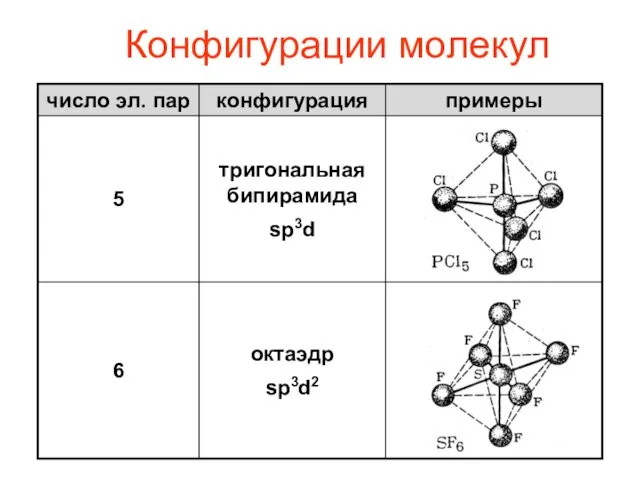
- 11. Конфигурации молекул
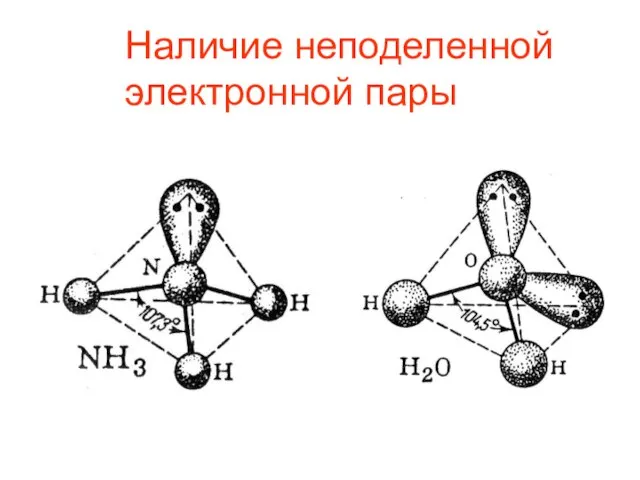
- 12. Наличие неподеленной электронной пары
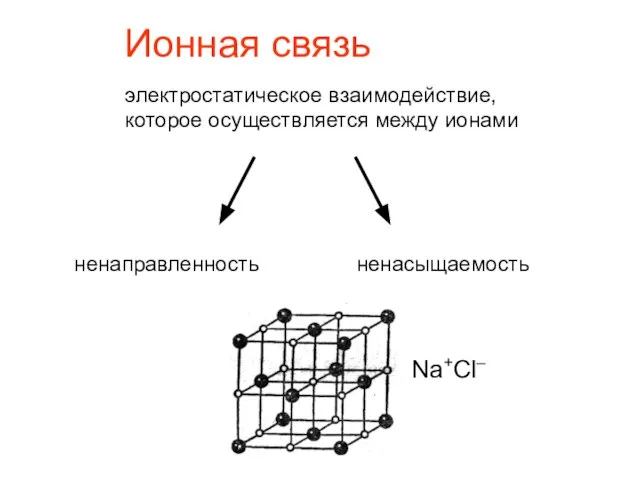
- 13. Ионная связь электростатическое взаимодействие, которое осуществляется между ионами ненаправленность ненасыщаемость Na+Cl–
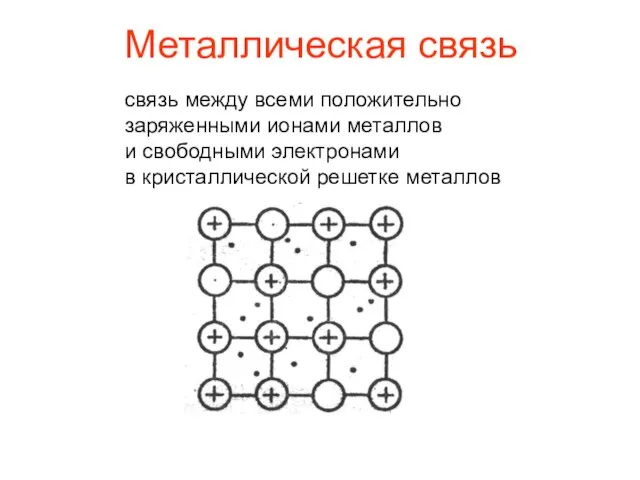
- 14. Металлическая связь связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов
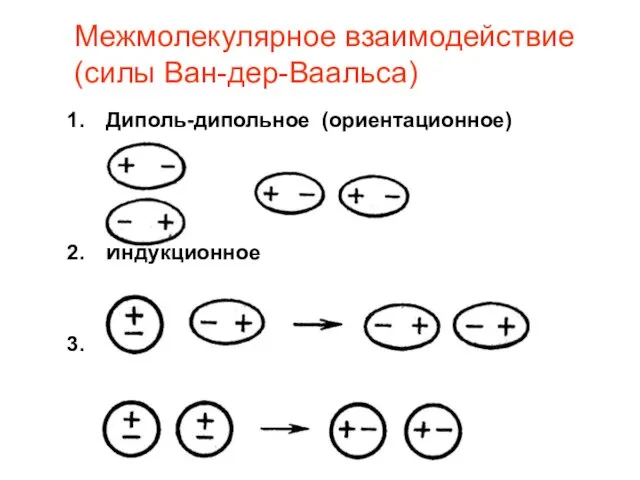
- 15. Межмолекулярное взаимодействие (силы Ван-дер-Ваальса) Диполь-дипольное (ориентационное) Индукционное Дисперсионное
- 17. Скачать презентацию
 Легкая атлетика. Гладкий Бег
Легкая атлетика. Гладкий Бег Презентация на тему Организм и его свойства
Презентация на тему Организм и его свойства Темперамент
Темперамент Выражение художником своего отношения к изображаемому
Выражение художником своего отношения к изображаемому Алгоритмы и исполнители
Алгоритмы и исполнители … OVA - это принципиально новый проект от компании InVision, предлагающий возможность готовых решений по созданию сайта и его дальнейш
… OVA - это принципиально новый проект от компании InVision, предлагающий возможность готовых решений по созданию сайта и его дальнейш 4D-моделирование в строительной отрасли
4D-моделирование в строительной отрасли Мышление. Формы мышления
Мышление. Формы мышления Правила поведения в ситуациях, связанных с терроризмом
Правила поведения в ситуациях, связанных с терроризмом Презентация на тему Русская литература начала 20 века 11 класс
Презентация на тему Русская литература начала 20 века 11 класс  Исследование верхнего и нижнего течения реки Охта в Санкт-Петербурге.Начало исторического исследования.
Исследование верхнего и нижнего течения реки Охта в Санкт-Петербурге.Начало исторического исследования. Презентация на тему Урок рисования бабочки
Презентация на тему Урок рисования бабочки Arbat Street
Arbat Street Выход из тупика. Что делать когда уже ничего не хочется и ничего не радует
Выход из тупика. Что делать когда уже ничего не хочется и ничего не радует Кем быть и какими нам быть?
Кем быть и какими нам быть? Нормативно-документальное обеспечение сетевого взаимодействия в МАДОУ № 83
Нормативно-документальное обеспечение сетевого взаимодействия в МАДОУ № 83 Дни недели
Дни недели Non stop original
Non stop original Презентация на тему ПИНГВИНЫ
Презентация на тему ПИНГВИНЫ  Девушки бывают разные
Девушки бывают разные Нижегородский народный костюм
Нижегородский народный костюм Социальные сети
Социальные сети  Танцы ХХ века
Танцы ХХ века ОДАРЁННЫЕ ДЕТИ. УЧЕБНЫЙ АСПЕКТ.
ОДАРЁННЫЕ ДЕТИ. УЧЕБНЫЙ АСПЕКТ. Устройство настольного горизонтально-фрезерного станка
Устройство настольного горизонтально-фрезерного станка Обсадная колонна для надежной фиксации скважин
Обсадная колонна для надежной фиксации скважин Кризис трёх лет
Кризис трёх лет Космические фантазии
Космические фантазии