Содержание
- 2. Поверхностная энергия и межмолекулярные взаимодействия в однокомпонентных системах WK = 2σ WK ≈ nsZs|u11| σ =
- 3. f" σ =k1(fm - f ') δ К = σ/δ = k1(fm - f ') К
- 4. K ~ E ~ Рид ~ Нсубл/ Vm ~ σ/b ~|pT,max| где рT тах - максимальное
- 5. где А11 — константа Гамакера (Дж), которая зависит от числа молекул п в единице объема взаимодействующих
- 6. σ = σd + σn (по Фоуксу) Можно разделить поверхностную энергию на дисперсионную σd и недисперсионную
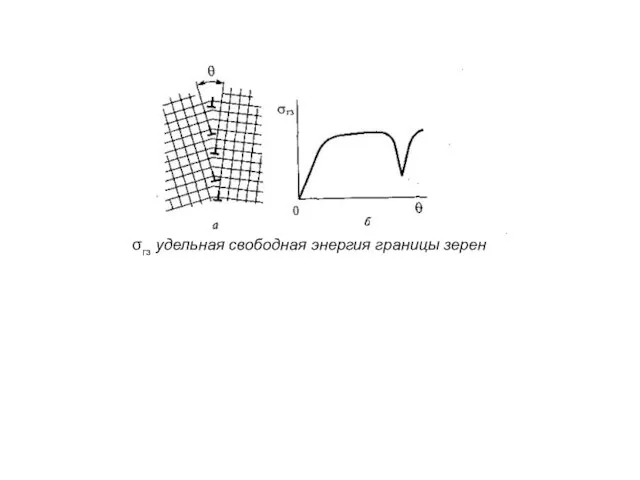
- 7. σгз удельная свободная энергия границы зерен
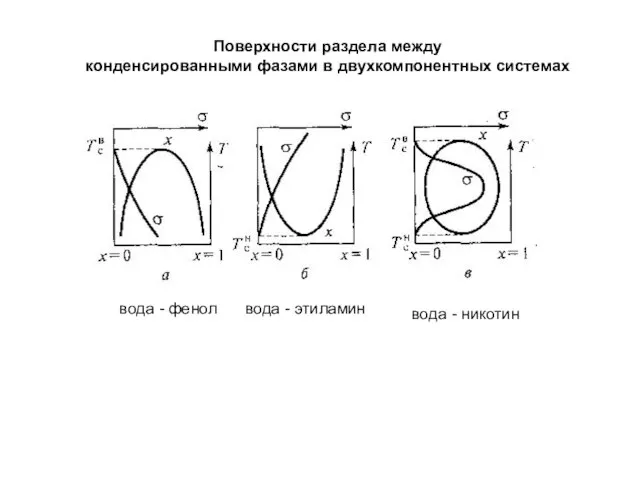
- 8. Поверхности раздела между конденсированными фазами в двухкомпонентных системах вода - фенол вода - этиламин вода -
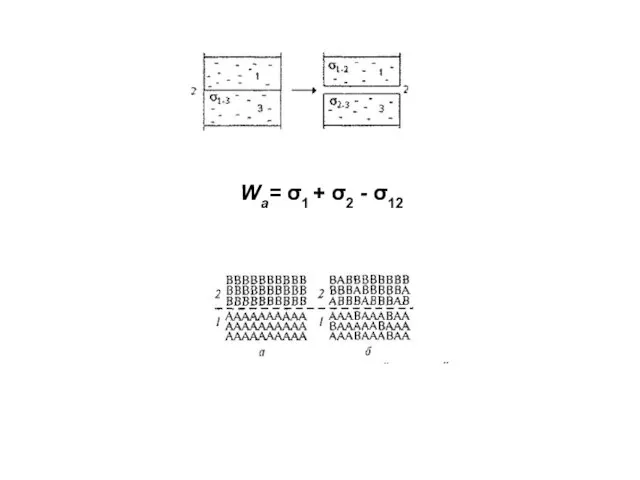
- 9. Wа= σ1 + σ2 - σ12
- 10. А* = АА + АВ - 2ААВ сложна константа Гамакера Согласно Ф. Фоуксу, Л. Джерифалко и
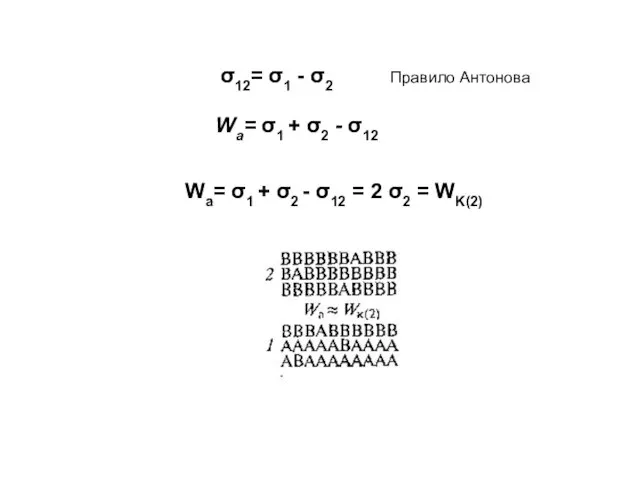
- 11. σ12= σ1 - σ2 Правило Антонова Wa= σ1 + σ2 - σ12 = 2 σ2 =
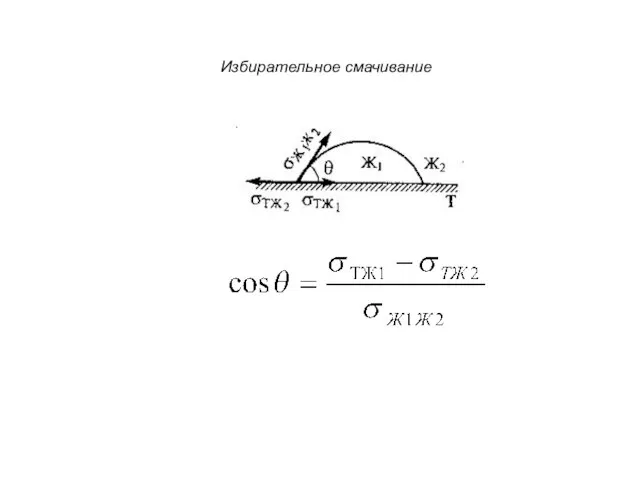
- 12. Смачивание и растекание σТГ = σТЖ + σЖГ cos θ Уравнение Юнга краевой угол острый: θ
- 13. Заменяя σЖГ на работу когезии WK = 2 σЖГ Несмачиванию отвечает условие Wa смачиванию 1/2 WK
- 14. Избирательное смачивание
- 15. β = НВ/НМ Для гидрофильных поверхностей β > 1 Для гидрофобных поверхностей β
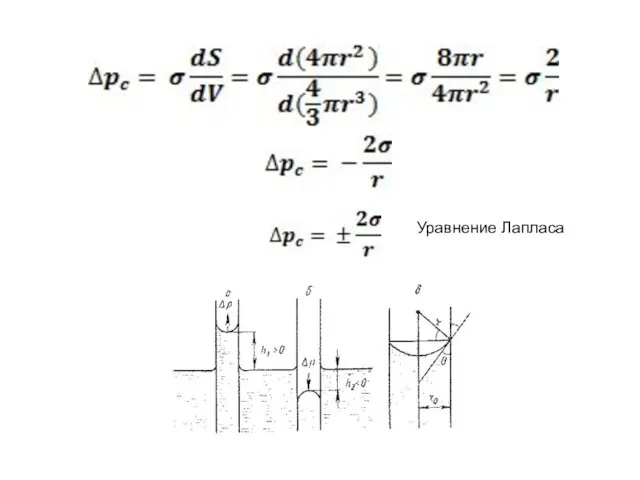
- 16. Капиллярное давление. Закон Лапласа. Δpc = ±(pr - p0) dG= pcdV + σdS При термодинамическом равновесии
- 17. Уравнение Лапласа
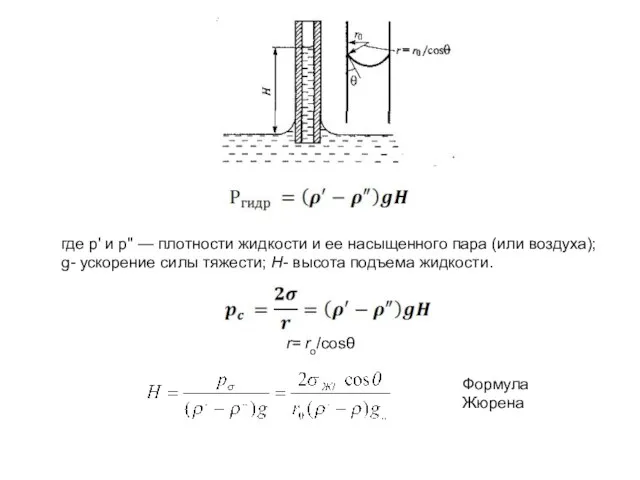
- 18. где р' и р" — плотности жидкости и ее насыщенного пара (или воздуха); g- ускорение силы
- 19. Уравнение Томсона (Кельвина) Δμ҆ = Δμ" Δμ' – приращение химпотенциале в жидкости Δμ" -приращение химпотенциале в
- 21. Скачать презентацию











 История чемпионатов Европы по футболу
История чемпионатов Европы по футболу Природа и проблемы Байкала
Природа и проблемы Байкала ТЕМНАЯ МАТЕРИЯ ВО ВСЕЛЕННОЙ
ТЕМНАЯ МАТЕРИЯ ВО ВСЕЛЕННОЙ Волхвы и маги
Волхвы и маги The Concept - Концепция Super Budget Hotel – Супер Бюджетной Гостиницы Clean, consistent, safe, low cost Чистота, постоянство, безопасность, низкая цена.
The Concept - Концепция Super Budget Hotel – Супер Бюджетной Гостиницы Clean, consistent, safe, low cost Чистота, постоянство, безопасность, низкая цена. История украшений
История украшений  Английский вокруг нас (11 класс)
Английский вокруг нас (11 класс) Муниципальный автоматизированный комплекс «МАК»Размещение заказов города Нижний Тагил с 01.07.2011 запущен в промышленную эксплуат
Муниципальный автоматизированный комплекс «МАК»Размещение заказов города Нижний Тагил с 01.07.2011 запущен в промышленную эксплуат Тема: Имя прилагательное(итоговое повторение) 6 классЗадачи: обобщение и систематизация знаний по теме;развитие мышления учащи
Тема: Имя прилагательное(итоговое повторение) 6 классЗадачи: обобщение и систематизация знаний по теме;развитие мышления учащи Закон всемирного тяготения (10 класс)
Закон всемирного тяготения (10 класс) М.Ю. Лермонтов. Биография. Ранняя лирика
М.Ю. Лермонтов. Биография. Ранняя лирика Презентация на тему От метапредметного обучения к метапредметным результатам
Презентация на тему От метапредметного обучения к метапредметным результатам  Нагрузки и воздействия
Нагрузки и воздействия Учебный проект на тему «Эффективные коммуникации - основа успеха организации»
Учебный проект на тему «Эффективные коммуникации - основа успеха организации» Конкурентоспособность регионов и развитие профессионального образования
Конкурентоспособность регионов и развитие профессионального образования Программа «Paint»
Программа «Paint» В мире животных
В мире животных The balance sheet
The balance sheet Prezentatsia_Kornaeva
Prezentatsia_Kornaeva Права человека и гражданина
Права человека и гражданина Презентация к уроку литературы.5 класс.Александр Сергеевич Пушкин.
Презентация к уроку литературы.5 класс.Александр Сергеевич Пушкин. Некрасов Николай Алексеевич
Некрасов Николай Алексеевич Приближенные значения чисел. Округление чисел
Приближенные значения чисел. Округление чисел Игристые вина
Игристые вина Образ Санкт-Петербурга в произведениях Достоевского
Образ Санкт-Петербурга в произведениях Достоевского 21 февраля - День родного языка
21 февраля - День родного языка Этикет театра
Этикет театра Эмблема ООН
Эмблема ООН