Содержание
- 2. Улучшить здоровье детей - задача для школы непосильная. Целью работы школьного коллектива может быть только охрана
- 3. Вопросы здоровьесбережения на уроках химии Задачи учителя: Помочь ученику сохранить свое здоровье Помочь приобрести знания об
- 4. Формы работы Введение вопросов здоровьесбережения в содержание урока: Уроки здоровья «Питание и здоровье», о наркотических веществах,
- 5. Задачи на основные понятия и законы химии Из приведенного ниже перечня выпишите отдельно названия веществ и
- 6. Задачи на основные понятия и законы химии Запишите русские названия химических элементов: Ba, Al, Ni, N,
- 7. Задачи на основные понятия и законы химии Определить в каком количестве вещества меди содержится 31• 10²³
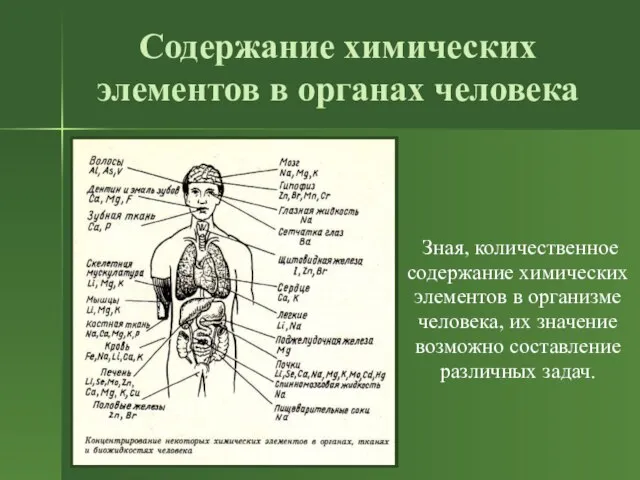
- 8. Содержание химических элементов в органах человека Зная, количественное содержание химических элементов в организме человека, их значение
- 9. Задачи на основные понятия и законы химии Какое количество вещества составляет углекислый газ, занимающий объем 134,4
- 10. Задачи на основные понятия и законы химии Величину шума в децибелах, ведущего к полной глухоте, если
- 11. Задачи на основные понятия и законы химии Вычислите, какое количество вещества составляет: а) вода массой 162
- 12. Многовариантные задачи Вычислите какое количество вещества составляет а) оксид кальция массой 5,6г б) оксид калия массой
- 13. Многовариантные задачи Вычислив массовые доли химических элементов в молекуле этилового спирта, вы узнаете, какие заболевания возникают
- 14. Многовариантные задачи Составьте уравнения химических реакций, и по количеству веществ, участвующих в реакции, вы сможете определить
- 15. Многовариантные задачи Запишите уравнения химических реакции и по числу электронов, участвующих в процессе окисления, определите, как
- 16. Многовариантные задачи Запишите уравнения химических реакции: а) окисления фосфора (V) б) горения аммиака в отсутствии катализатора
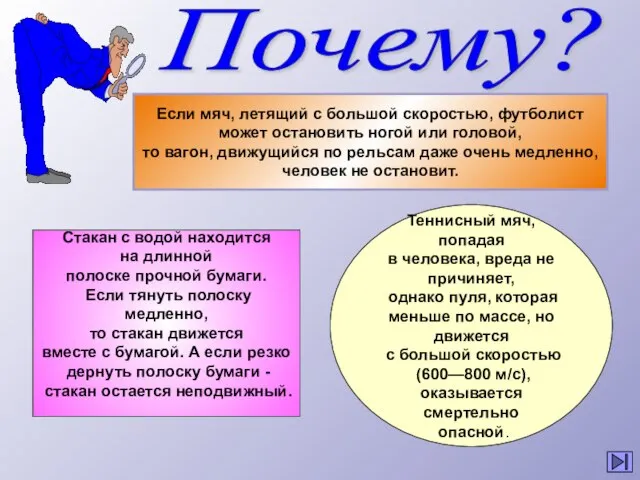
- 17. Эвристические задачи Сульфат бария используют в медицине как рентгено- контрастное средство, но в нем недопустима примесь
- 18. Задачи на растворы Для рентгеновского исследования желудка больному дают выпить суспензию сульфата бария. Почему используют именно
- 19. Задачи на растворы Глюкозу в медицине используют в виде растворов различной концентрации, которые служат источником жидкости
- 20. Задачи, возникающие из жизнедеятельности школы. ГО и ЧС В случае загрязнения атмосферы хлором, можно защититься марлевыми
- 21. Правила техники безопасности Простейшим способом удаления пролившейся ртути является обработка загрязненного места йодной настойкой. Какую массу
- 22. « Домашние » задачи Плохой уход за зубами, особенно несвоевременное удаление остатков пищи, - одна из
- 23. « Домашние » задачи При неправильном уходе за ротовой полостью зубы становятся очень чувствительны к горячей
- 24. « Домашние » задачи В составе желудочного сока содержится соляная кислота. Избыток ее (повышенная кислотность) вызывает
- 25. « Домашние » задачи Перманганат калия –KMnO4 используется в медицине в виде 5% раствора для смазывания
- 26. « Домашние » задачи Какие вещества, находящиеся в домашней аптечке, как дезинфицирующие препараты, можно использовать для
- 27. « Домашние » задачи В домашней аптечке хранятся такие вещества как перманганат калия, нашатырный спирт, этиловый
- 28. « Домашние » задачи Используя вещества из домашней аптечки, ученик попытался провести химические реакции. Какие вещества
- 29. « Домашние » задачи Пурген (фенолфталеин) применяют как слабительное средство. Какую окраску приобретет пурген в растворах
- 30. Задачи можно: предложить учащимся как химическую разминку в начале урока при закреплении нового материала как дополнительное
- 32. Скачать презентацию




























 Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Информационное оснащение женских консультаций
Информационное оснащение женских консультаций Презентация на тему Сложение чисел с помощью координатной прямой
Презентация на тему Сложение чисел с помощью координатной прямой  Что такое натуральные ткани? каковы их свойства?
Что такое натуральные ткани? каковы их свойства? Неорганические кислоты
Неорганические кислоты Фторхинолоны клиническая фармакология иособенности действия
Фторхинолоны клиническая фармакология иособенности действия ИГРА С БУДУЩИМ
ИГРА С БУДУЩИМ Антонио Гауди - великий архитектор
Антонио Гауди - великий архитектор Сообщающиеся сосуды
Сообщающиеся сосуды Плавание тел
Плавание тел Любимые места отдыха
Любимые места отдыха Повседневная жизнь земледельцев и горожан в средние века
Повседневная жизнь земледельцев и горожан в средние века Сводный медиаплан рекламной кампании
Сводный медиаплан рекламной кампании Лагерь молодёжного актива
Лагерь молодёжного актива Повесть Н.С.Лескова «Очарованный странник»
Повесть Н.С.Лескова «Очарованный странник» Мельник М.В. Управление риском
Мельник М.В. Управление риском Ошибки вокруг нас
Ошибки вокруг нас Приблизительные размеры территорий
Приблизительные размеры территорий Chanel SS21. Alberta Ferretti SS21. Вдохновение
Chanel SS21. Alberta Ferretti SS21. Вдохновение Обязательные условия при сканировании
Обязательные условия при сканировании chekhov
chekhov Презентация на тему Происхождение рас
Презентация на тему Происхождение рас  Обзор Информационно-аналитической системы «Семантический архив» 3.0
Обзор Информационно-аналитической системы «Семантический архив» 3.0 ГАЗЕТАК ПРАЗДНИКУ «ДЕНЬ МАТЕРИ»
ГАЗЕТАК ПРАЗДНИКУ «ДЕНЬ МАТЕРИ» Презентация на тему Памятник русскому солдату в Болгарии
Презентация на тему Памятник русскому солдату в Болгарии Как маркетинговая аналитика увеличивает продажи. Часть 1
Как маркетинговая аналитика увеличивает продажи. Часть 1 აუდიტი გამა
აუდიტი გამა Изделия из бересты
Изделия из бересты