Содержание
- 2. Цель проектной работы. Создании альтернативного способа производства аммиака. Обеспечить оптимальное протекание химических реакций. Создать производство, основанное
- 3. Термодинамические основы химического производства. Скорость химической реакции - это быстрота изменения количества вещества в единицу времени.
- 4. Химические равновесие – это состояние системы, при котором скорость прямой реакции равна скорости обратной реакции. Правила
- 5. Сырье. Сырье- это минералы, которые лежат в основе производства. СаСО3- известняк (карбоната кальция) N2- азот С
- 6. Химизм. Химизм – это химические реакции, лежащие в основе производства. CaCO3 тв CaOтв + CO2 г
- 7. Аппаратное оформление. Мельница для измельчения известняка. Печь для получения оксида кальция. Мельница для измельчения каменного угля
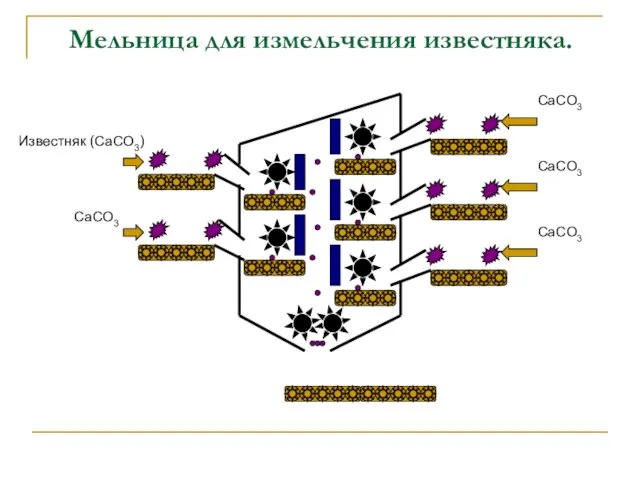
- 8. Мельница для измельчения известняка. Известняк (CaCO3) CaCO3 CaCO3 CaCO3 CaCO3
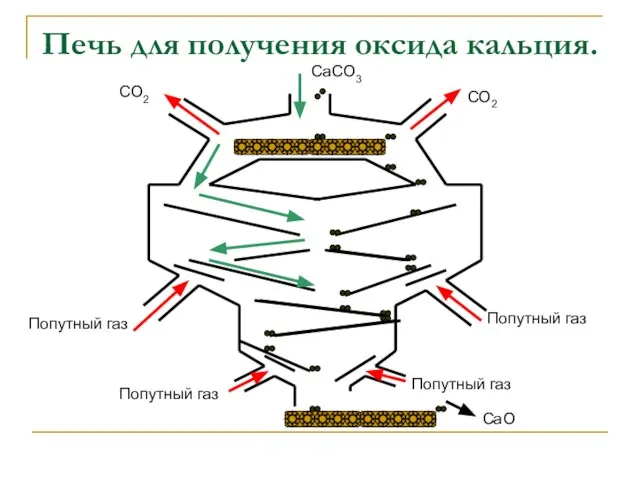
- 9. Печь для получения оксида кальция. Попутный газ Попутный газ Попутный газ Попутный газ CaO CO2 CO2
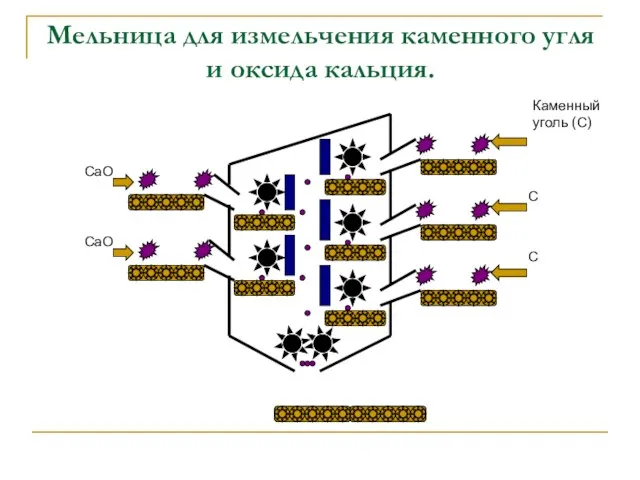
- 10. Мельница для измельчения каменного угля и оксида кальция. CaO CaO Каменный уголь (С) C C
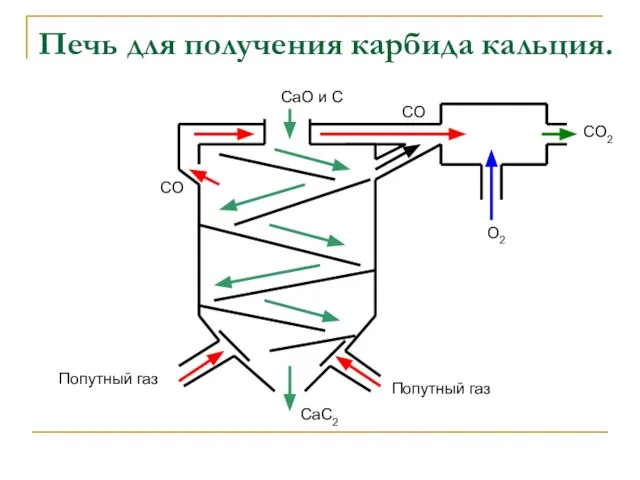
- 11. Печь для получения карбида кальция. CaO и С Попутный газ Попутный газ CO CO O2 CO2
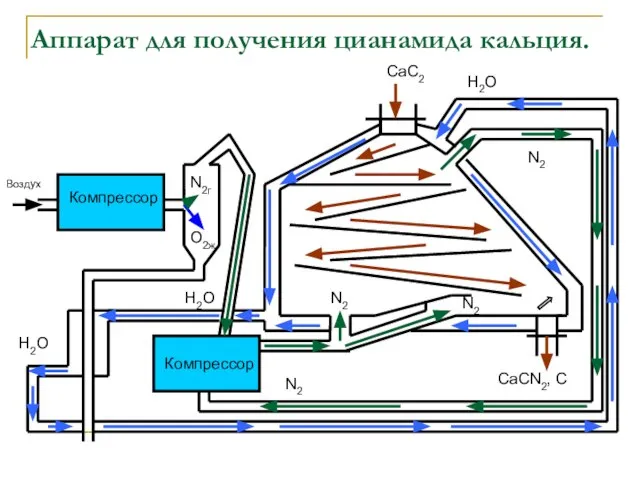
- 12. Аппарат для получения цианамида кальция. Компрессор Компрессор Воздух N2г O2ж N2 N2 N2 N2 СаС2 СаСN2,
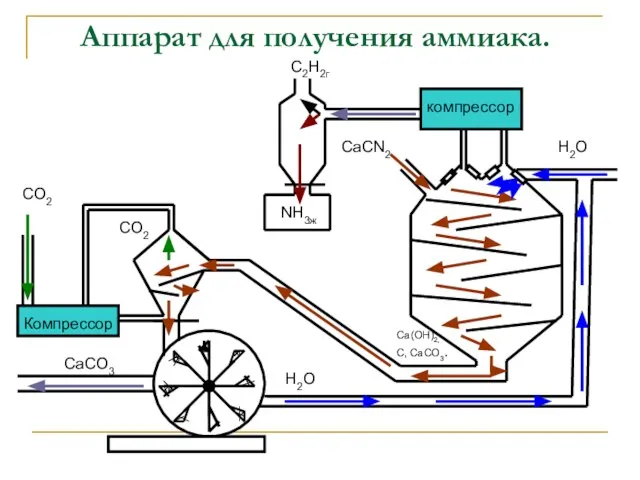
- 13. Аппарат для получения аммиака. компрессор Компрессор CO2 CO2 NH3ж C2Н2г СаСN2 Са(ОН)2, С, СаСО3. СаСО3 Н2О
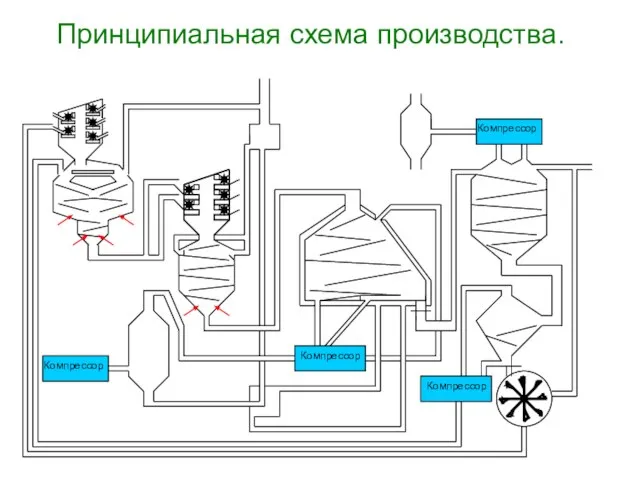
- 14. Принципиальная схема производства. Компрессор Компрессор Компрессор Компрессор
- 16. Скачать презентацию






 Время и календарь
Время и календарь Методические рекомендации по организации портфолио по курсу «Юридическая психология»
Методические рекомендации по организации портфолио по курсу «Юридическая психология» Яркие представители мира динозавров
Яркие представители мира динозавров Тип кольчатые черви 7 класс
Тип кольчатые черви 7 класс Дизайн и реклама – составляющие художественной культуры
Дизайн и реклама – составляющие художественной культуры Рождение капитализма (новый общественный строй)
Рождение капитализма (новый общественный строй) Сущность и принципы маркетинга
Сущность и принципы маркетинга Древние мифы, легенды, сказки, предания, благожеланиея дальневосточной земли.
Древние мифы, легенды, сказки, предания, благожеланиея дальневосточной земли. Всероссийский День правовой помощи детям. Права человека
Всероссийский День правовой помощи детям. Права человека Талант помогает исправиться
Талант помогает исправиться Зинин
Зинин Urok_11
Urok_11 Политическое поведение
Политическое поведение Спорт в Британии
Спорт в Британии Таможенное оформление круизных лайнеров и их пассажиров
Таможенное оформление круизных лайнеров и их пассажиров «Построение маркетинговых коммуникаций с молодёжной аудиторией в соответствии с её образом жизни и моделью потребления»
«Построение маркетинговых коммуникаций с молодёжной аудиторией в соответствии с её образом жизни и моделью потребления» Виды Дверей
Виды Дверей Рецепция римского права
Рецепция римского права 幅作品. 戴花的惠安阿婆
幅作品. 戴花的惠安阿婆 Основы научных исследований и инновационной деятельности
Основы научных исследований и инновационной деятельности “Fried Green Tomatoes at the Whistle Stop Café”
“Fried Green Tomatoes at the Whistle Stop Café” Синяя лента апреля
Синяя лента апреля Формы и системы оплаты труда на предприятиях
Формы и системы оплаты труда на предприятиях КАК ОРГАНИЗОВАТЬ КОНКУРС КИО В ШКОЛЕ
КАК ОРГАНИЗОВАТЬ КОНКУРС КИО В ШКОЛЕ Числа с собственными именами
Числа с собственными именами Послеоперационный период
Послеоперационный период  Программа amoCRM
Программа amoCRM Реализация PR и IR стратегий: особенности национального информационного поля
Реализация PR и IR стратегий: особенности национального информационного поля